原发性膀胱浆细胞样/印戒细胞尿路上皮癌的临床特征和诊治分析
李曾 廖洪 毛顿 谭政 吴毅 肖英明 杨盛柯 钟磊 陈勇吉
在2016版WHO泌尿及男性生殖系统肿瘤分类中,原发性膀胱印戒细胞癌(signet-ring cell carcinoma, SRCC)(不伴有细胞外黏液者)被命名为膀胱浆细胞样尿路上皮癌(plasmacytoid urothelial carcinoma, PUC),伴有印戒细胞形态,既往文献报道的原发性膀胱SRCC几乎都属于该类[1]。此类型膀胱癌临床较罕见,生物学行为独特,恶性程度高,预后极差。国内文献报道仅40多例,多为个案报道,且尚无大宗研究对其进行总结分析,故我们结合曾收治的1例病例,并检索1986~2017年国内文献报道的原发性膀胱SRCC(即原发性膀胱浆细胞样/印戒细胞尿路上皮癌)病例44例,共45例,进行总结分析,以期对临床工作起到一定的指导作用。
对象与方法
一、病例收集
使用检索关键词“膀胱癌”和“印戒细胞癌”,检索时限从1986年至2017年,在“中国知网”、“万方医学网”、“维普期刊全文数据库”等对篇名及摘要进行系统文献检索,共检索到相关文献33篇。纳入标准:原发性膀胱SRCC(缺乏细胞外黏液)伴有印戒细胞形态;排除标准:转移性膀胱SRCC。检出文献中,符合上述条件的相关病例有44例[2-30],结合我们曾收治的1例病例,共45例。
二、一般资料
45例患者中,1例既往有右颌下黏液表皮样癌病史,其余病史无特殊。男39例(86.7%),女6例(13.3%),男女比例6.5∶1。发病年龄为24~80岁,以中老年居多,其中30岁以下2例(4.4%),30~40岁1例(2.2%),41~50岁12例(26.7%),51~60岁12例(26.7%),61~70岁10例(22.2%),70岁以上8例(17.8%),平均年龄56.2岁。临床表现:肉眼血尿38例(84.4%),其中单纯性肉眼血尿24例(63.2%)、肉眼血尿伴有尿路刺激症状(尿频、尿急、尿痛)14例(36.8%);镜下血尿1例(2.2%);排尿困难伴尿频1例(2.2%);单纯尿路刺激症状(尿频、尿急、尿痛)5例(11.1%)。其中1例合并黏液尿;伴双侧肾积水3例(6.7%),单侧肾积水1例(2.2%)。见表1。
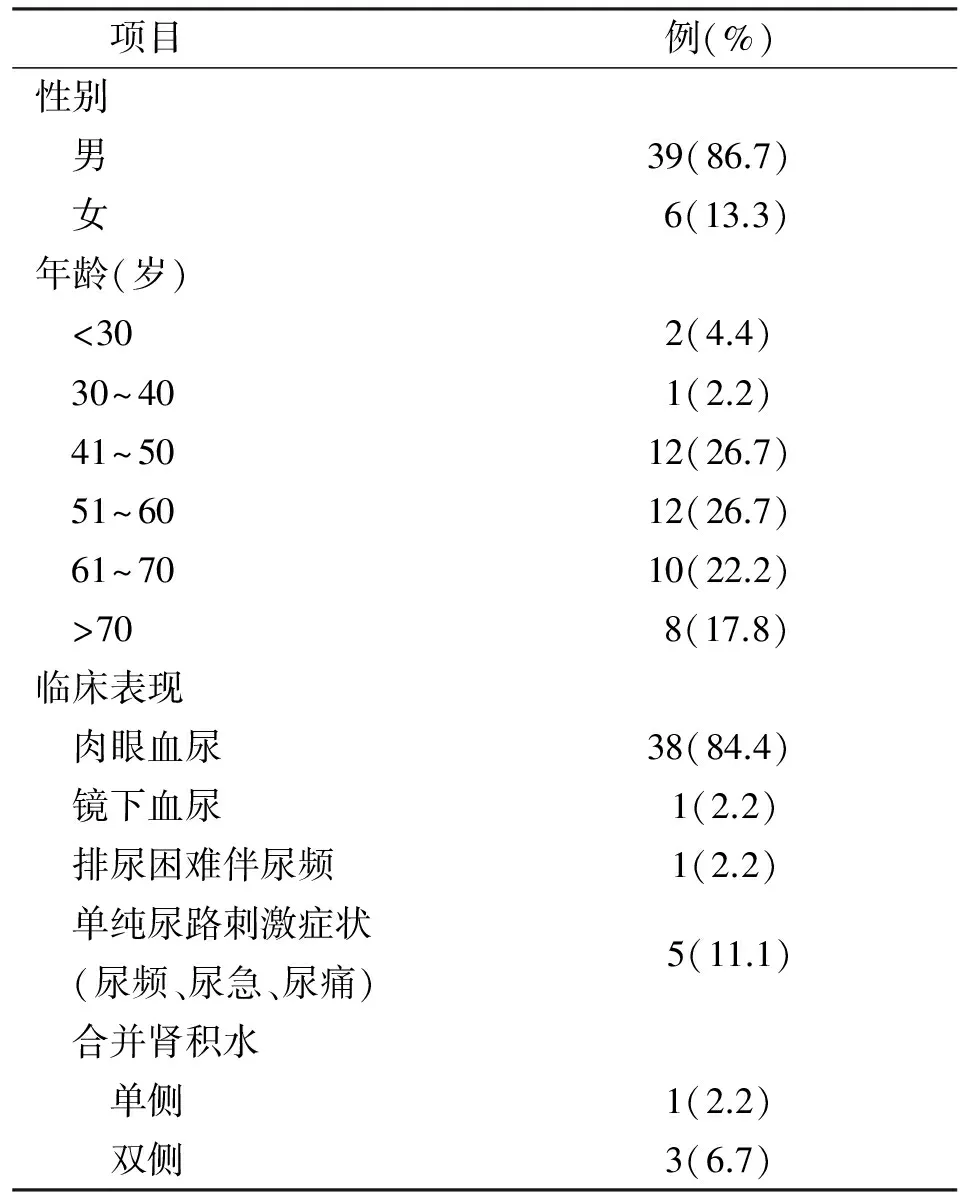
表1 45例患者的一般临床资料
三、研究方法
总结分析45例患者的发病部位、病理特点、临床分期和治疗预后等特征。
四、数据分析
应用SPSS 18.0统计软件进行统计学分析,生存数据分析使用Kaplan-Meier法进行单因素分析,总体存活率计算从患者诊断到死亡或最后失访的日期,P<0.05被认为差异有统计学意义。
结 果
一、患者的发病部位、病理和临床分期
45例患者中,发病部位:好发于顶壁31例(68.9%),其中顶前壁27例(87.1%),顶后壁4例(12.9%);侧壁8例(17.8%);三角区3例(6.7%);顶壁、侧壁和三角区多发1例(2.2%);另有2例(4.4%)仅表现为膀胱壁增厚,膀胱腔内无明显新生物。根据病理成分是否为单一SRCC分为单纯性SRCC和混合性SRCC[6,20]:单纯性SRCC 37例(82.2%);混合性SRCC 8例(17.8%),其中混合尿路上皮癌5例、混合腺癌3例。TNM分期:T分期,除外Tx8例(17.8%),其余T2期11例(24.4%)、T3期17例(37.8%)、T4期9例(20.0%);发生淋巴结(N)转移2例(4.4%),其中1例为单侧髂血管旁淋巴结3/3,1例为单侧髂血管和腹主动脉旁淋巴结6/6;远处转移(M)3例(6.7%),其中腹壁、肠系膜和大网膜转移1例,腹膜、大网膜和肝脏转移1例,阑尾转移1例。见表2。
表245例患者发病部位、病理和临床分期的特点

项目例(%)发病部位 顶壁31(68.9) 侧壁8(17.8) 三角区3(6.7) 顶壁、侧壁和三角区1(2.2) 壁增厚2(4.4)SRCC组成成分 单纯性37(82.2) 混合性8(17.8)TNM分期 T211(24.4) T317(37.8) T49(20.0) Tx8(17.8) 淋巴结转移(N)2(4.4) 远处转移(M)3(6.7)
二、患者的治疗方式和随访预后
治疗方面,除1例患者高龄、体弱,属于肿瘤晚期,未行任何治疗外,其余44例患者均接受了治疗,但其中有3例(6.7%)因分期晚而未行肿瘤相关手术,仅行对症姑息治疗,包括全身化疗1例(2.2%)、膀胱造瘘1例(2.2%)、双侧髂内动脉栓塞1例(2.2%)。手术病例41例(91.1%),其中采用经尿道膀胱肿瘤切除术(TURBT) 3例(7.3%);膀胱部分切除术17例(41.5%);根治性膀胱全切术21例(51.2%)。早年多采用膀胱部分切除为主,近年基本采用根治性膀胱全切术。早年病例术后多未行任何辅助治疗(15例,36.6%)或仅行膀胱灌注化疗(5例,12.2%),近年多采用全身化疗或放疗等综合治疗[全身化疗13例(31.7%)、全身化疗+膀胱灌注化疗5例(12.2%)、全身化疗+放疗3例(7.3%)]。随访预后方面,失访6例;随访时间≤1年的有28例(62.2%)(我们收治的1例已随访9个月无复发),其中有15例在1年内死亡,2例复发;1年<随访时间≤2年的有8例(17.8%),其中有2例在13个月时死亡;生存时间>2年的只有3例(6.7%)。见表3。生存期最短的为2个月,最长的为44个月无复发,平均生存时间约25.1个月,中位生存时间约13个月。见图1。

表3 45例患者的治疗方式和随访预后结果

图145例患者的总生存情况(Kaplan-Meier分析)
讨 论
膀胱癌是泌尿系统中最常见的恶性肿瘤,95%是尿路上皮癌,腺癌仅占约0.5%~2%[31],其中大部分是脐尿管腺癌[32]和转移性腺癌。既往认为原发性膀胱SRCC是膀胱腺癌的一种特殊类型,属于低分化腺癌,它专指几乎全部由印戒细胞,或由具有细胞内黏液、无丰富细胞外黏液的分化较差的圆形细胞组成的肿瘤。90%的SRCC发生在胃肠道[33]、前列腺[34]等,发生在膀胱的SRCC甚少,且多是转移癌,原发性膀胱SRCC仅占膀胱腺癌的2%~43%,占所有膀胱恶性肿瘤的0.24%,故临床上更为罕见,以男性多见,男女比例3∶1,好发年龄为70~80岁[35]。对于膀胱PUC数年前虽已报道,但是近期研究全面重新定义了其形态学、临床表现和基因学特点[36],其分子水平的特点是存在E-cadherin(CDH1)的基因突变和缺乏钙粘蛋白表达[37],其约占肌层浸润性膀胱尿路上皮癌的2.3%~3.1%[38]。最新2016版WHO泌尿及男性生殖系统肿瘤分类中,正式将原发性膀胱SRCC(不伴有细胞外黏液者)命名为膀胱浆细胞样/印戒细胞尿路上皮癌[1]。我们总结的45例病例中,男女比例为6.5∶1,发病年龄为24~80岁,平均年龄56.2岁,好发年龄较国外年轻化。
关于其组织学起源主要存在以下几种假说:①多数学者倾向其来源于膀胱移行上皮的全能干细胞,膀胱腔中多种致癌因素(如反复慢性炎症)的刺激使得Brunn’s巢发生囊性退变,形成“囊性膀胱炎”,继而转化为柱状细胞,获得生成黏液的能力,即所谓的“腺性膀胱炎”,并进一步去分化形成“印戒细胞”[39];②亦有认为其起源于脐尿管残存上皮(大约占20%);③或与长期局部刺激导致尿路上皮化生有关;④或与K-ras基因突变有关。组织学特征:比例不同的圆形或椭圆形肿瘤细胞存在于疏松或黏液样的基质中,胞质嗜酸性或透亮,核大、深染偏位,似浆细胞,核位于一端呈印戒细胞样形态,部分区域细胞胞质呈空泡状,有或没有细胞内黏液蛋白,但缺乏细胞外黏液蛋白[36]。弥漫浸润膀胱黏膜固有层和肌层,脉管内可见癌栓。可单独存在,亦可与普通高级别浸润性尿路上皮癌及其他变异亚型(如微乳头癌)等共同存在。免疫组化染色:AB/PAS阳性;标记:CEA、EMA、CK7、CK20等多为阳性,CDX2、酸性磷酸酶和PSA阴性。Terada[40]报道3例免疫标记(CK)AE1/3、CK、CAM5.2、CK8、CK18、CK19、CK20、p53、Ki-67(30,50,70%)、MUC1阳性,MUC2、CK34BE12、CK5/6、CK14、EMA、p63、Vimentin 和MUC6阴性,CK7(1/3)、CA19-9(1/3)和MUC5AC(2/3)阳性。浆细胞样肿瘤细胞CD138阳性,LCA(白细胞共同抗原)、Vimentin和绝大部分E-cadherin阴性,E-cadherin阴性表达是诊断PUC的必备条件[38]。在我们统计的资料中,以单纯性SRCC多见(82.2%,37/45)。
其临床表现无特异性,血尿和尿路刺激症状最常见,亦可早期出现上尿路积水,或肿瘤压迫侵犯导致的相关症状,甚至因转移灶症状就医,如支气管内转移[41]等。可发生于膀胱的任何部位,Wang等[42]的研究则提示肿瘤好发于膀胱顶壁和前壁,但也只占12.6%。由于该病具有先浸润膀胱黏膜和黏膜下层,最后累及全层的特性,能够在早期引起弥漫性的累及,而早期影像学或膀胱镜检查可无阳性发现[39],呈现出症状无特异性、浸润性强、恶性程度高、进展迅速、早期易扩散转移的特点,故难以早期诊断,确诊时往往已处于中晚期。我们的研究亦发现84.4%(38/45)的患者主要表现为血尿,合并肾积水(单/双侧)的少见,只有4例(8.9%);肿瘤好发于膀胱顶壁,占68.9%(31/45),这也解释了为什么合并肾积水的少,其次为侧壁,占17.8%(8/45),另有2例(4.4%)仅表现为膀胱壁增厚,腔内无明显新生物,比文献报道的20%要低[39],其中1例合并肾积水,且预后差,2例均在半年内死亡,与文献报道的肿瘤生长特点符合[39];中晚期占绝大部分,为82.2%(37/45),其中T3、T4期占57.8%(26/45)。该病确诊需依赖病理检查,需排除转移癌或邻近器官(如前列腺等)肿瘤侵犯的可能。此外,由于脐尿管腺癌中也可能有印戒细胞,且在组织形态及免疫组化上的特点相似,因此还需与具有浆细胞形态的淋巴瘤、神经内分泌癌、无色素性恶性黑色素瘤、胚胎性横纹肌肉瘤等鉴别。
治疗方面,早期研究认为根治性膀胱全切术可能是唯一有效的治疗手段,单纯的放化疗不敏感[43]。Wang等[31]总结分析230例患者后发现其1年、3年和10年肿瘤特异生存率分别是66.8%、40.6%和25.8%,肿瘤分期和是否行根治性膀胱全切术是肿瘤特异生存的独立预测因子,膀胱全切能显著改善患者的生存获益,不过只有少于50%的患者有手术机会。但亦有单纯化疗获得较好疗效的报道(单卡铂动脉内化疗获得44个月无瘤生存)[44],近年还有采用根治性膀胱全切+原位膀胱术(Studer膀胱)治疗暂未见复发的报道[45]。我们发现早年国内治疗多采用膀胱部分切除术,占41.5%(17/41),近年基本采用根治性膀胱全切术,占51.2%(21/41),对于能手术的患者应积极行根治性膀胱全切术,仅行化疗(全身或髂内动脉灌注)效果差。术后的辅助治疗方案还处于探索阶段,有研究认为术后放疗能显著提高患者的5年生存率,化疗亦可能是有效手段,但效果各异[46]。早期有采用环磷酰胺、阿霉素和顺铂化疗,Tagami等[47]对T4期未行手术者,采用替吉奥联合顺铂化疗2个疗程无效,改用多西他赛治疗有效。El Ammari等[48]对1例pT3bN1M0期患者术后采用吉西他滨联合顺铂方案化疗,患者存活22个月。Hamakawa等[49]对1例T3bN0M0期患者在术后以顺铂联合替吉奥化疗3个周期,患者治疗后90个月无复发及转移。Pugashetti等[50]对T4aN2Mx期患者采用FOLFOX-6方案化疗8个周期,患者存活已12个月。我们的统计资料中,63.4%(26/41)的病例术后采用了膀胱灌注、全身化疗和放疗等单一或联合辅助治疗。
25%的患者在确诊时即有远处转移,60%在诊断后1年内死亡,5年生存率小于11%[31]。即使接受了根治性膀胱全切等治疗,大部分患者仍出现盆腔复发并最终死亡。Akamatsu等[43]分析54例患者后发现46%的患者属于Ⅳ期,2年总生存率为43%,但所有Ⅳ期患者均在2年内死亡,肿瘤分期和CEA升高是影响肿瘤进展的显著因素。此外,印戒细胞所占的比例与总生存率呈负相关,单纯性的平均生存期为327 d,混合性的为586 d[31]。目前对于预后判断尚无公认的指标,有病例观察到CA19-9和CA50升高,CEA升高亦较常见,CEA水平的变化对评估肿瘤进展及预后有重要参考意义[43]。我们收治的病例CEA正常,但CA19-9略高,术后恢复正常,已随访9个月,无复发及转移。45例病例中,生存期最短的为2个月,最长的为44个月无复发,平均生存时间约25.1个月,中位生存时间约13个月。行根治手术联合化疗或放疗虽有助于提高患者的生存期,但整体预后差,5年生存率低。
综上,原发性膀胱浆细胞样/印戒细胞尿路上皮癌发病率低,临床多以个案报道,其表现缺乏特异性,具有恶性程度高、进展迅速、预后差等特点,目前缺乏十分有效的诊疗经验和手段。建议:①提高对不明原因血尿但未发现膀胱新生物,且膀胱弥漫性增厚患者的重视,必要时可行膀胱镜多点、深活检或诊断性电切术,以期早期诊断本病;②对于确诊者,在病情及全身情况允许的条件下宜及早行根治性膀胱全切术,辅以放化疗等综合治疗手段,有望改善患者的预后。
[1]Humphery PA, Moch H, Cubilla AL, et al. The 2016 WHO Classification of Tumours of the Urinary System and Male Genital Organs-Part B: Prostate and Bladder Tumours[J]. Eur Urol,2016,70(1):106-119.
[2]刘先礼,卫焘,龙翠森. 膀胱原发性印戒细胞癌二例报告[J]. 山西医药杂志,1986,6(3):168-169.
[3]张磊,李炎唐. 原发性膀胱印戒细胞癌一例报告[J]. 临床泌尿外科杂志,1990,1:66.
[4]井元恒,张广菊,袁凤林,等. 原发性膀胱印戒细胞癌1例[J]. 新乡医学院院报,1993,10(2):104.
[5]张维日,吴洪绪,张进生,等. 原发性膀胱印戒细胞癌一例报告[J]. 北京医学,1997,19(5):303.
[6]孙咏梅,严小娟,石群立. 膀胱尿道原发性印戒细胞癌临床病理观察[J]. 诊断病理学杂志,1999,6(3):137-139.
[7]高建津,刘洁华,张秀芹,等. 原发性膀胱印戒细胞癌1例[J]. 癌症,2000,19(5):462-463.
[8]史佳凤,廖松林,廖旭. 膀胱原发性印戒细胞癌一例[J]. 中华病理学杂志,2000,29(1):62.
[9]常鲜华,白俊,刘立民. 膀胱原发性印戒细胞癌1例[J]. 沈阳部队医药,2000,13(5):454.
[10]隋立荣,王平静. 膀胱原发性印戒细胞癌1例[J]. 诊断病理学杂志,2003,10(2):124-125.
[11]周玉海,陈昌伟. 原发性膀胱印戒细胞癌一例报道并文献复习[J]. 肿瘤防治杂志,2005,12(13):1039-1040.
[12]孙元星,叶晶,洪宝发. 原发性膀胱印戒细胞癌(附2例报告并文献复习)[C]. 第十二届全国、第七届全球华人泌尿外科学术会议论文汇编(上册),2005.
[13]郭桂迎,修有成,王毅,等. 原发性膀胱印戒细胞癌1例[J]. 临床泌尿外科杂志,2006,21(12):885.
[14]李登宝,吉春玲,谷江,等. 原发性膀胱印戒细胞癌2例报告[J]. 山东医药,2006,46(36):74.
[15]李登宝,谷江,陈方敏,等. 原发性膀胱、前列腺印戒细胞癌(附3例报告并文献复习)[J]. 中国医师进修杂志,2006,29(10):30-32.
[16]谢斌,张厚彬,黄仕泉. 原发性膀胱印戒细胞癌1例[J]. 重庆医学,2007,36(14):1362-1363.
[17]贤少忠,杜林栋,田野,等. 原发性膀胱印戒细胞癌一例报道并文献复习[J]. 中华临床医师杂志:电子版,2007,1(6):55-56.
[18]陈杰,高轶,徐丹枫,等. 膀胱原发性印戒细胞癌3例报道并文献复习[J]. 中国癌症杂志,2009,19(8):634-636.
[19]任伟,刘宝瑞,徐新运,等. 原发性膀胱印戒细胞癌1例报道并文献复习[J]. 现代肿瘤医学,2010,18(3):532-534.
[20]龚玉爱,郭宗华,李刚. 原发性膀胱印戒细胞癌的诊治(附3例报告)[J]. 临床泌尿外科杂志,2011,26(11):866-868.
[21]胡善彪,王荫槐,易路,等. 原发性膀胱印戒细胞癌1例报告并文献复习[J]. 临床泌尿外科杂志,2011,26(8):584-586.
[22]车宪平,古军,陈道虎,等. 原发性膀胱印戒细胞癌的诊断和治疗:附2例报告[J]. 中华腔镜泌尿外科杂志:电子版,2011,5(1):51-54.
[23]李戈,王洁琼,王明,等. 原发性膀胱印戒细胞癌1例[J]. 基础医学与临床,2013,33(4):485-487.
[24]杨佳佳,张贤生. 原发性膀胱印戒细胞癌1例报告并文献分析[J]. 现代泌尿生殖肿瘤杂志,2013,5(5):306-307.
[25]邢继章,姚志勇,孙斌,等. 根治性膀胱全切治疗原发性膀胱印戒细胞癌1例报告及随访观察[J]. 临床泌尿外科杂志,2015,30(3):258-259.
[26]陈绪龙,王海平,赵亚昆,等. 原发性膀胱印戒细胞癌的诊断与治疗(附一例报道)[J]. 现代医学,2014,42(6):641-644.
[27]杨博,周波,孙中义,等. 原发性膀胱印戒细胞癌2例报告并文献复习[J]. 现代泌尿生殖肿瘤杂志,2015,7(3):154-156.
[28]彭云鹏,庄岩,范利,等. 原发性膀胱印戒细胞癌——附2例报告及文献复习[J]. 中国校医,2015,29(7):551-553.
[29]葛仙伟,程庆水,黄后宝,等. 原发性膀胱印戒细胞癌1例报道[J]. 辽宁医学院学报,2016,37(5):77-78.
[30]许晖阳,王道虎. 原发性膀胱印戒细胞癌1例并文献复习[J]. 罕少疾病杂志,2017,24(5):32-34.
[31]Wang J, Wang FW. Clinical characteristics and outcomes of patients with primary signet-ring cell carcinoma of the urinary bladder[J]. Urol Int,2011,86(4):453-460.
[32]Hayes Ryan D, Paramanathan P, Russell N, et al. Primary urachal malignancy: case report and literature review[J]. Ir J Med Sci,2013,182(4):739-741.
[33]Skodras G, Wang J, Kragel PJ. Primary prostatic signet-ring cell carcinoma[J]. Urology,1993,42(3):338-342.
[34]Okutur K, Eren OO, Demir G. Metastasis of gastric signet-ring cell carcinoma to the urinary bladder: a case report and review of the literature[J]. Case Rep Oncol Med,2015,2015:127516.
[36]Kaimakliotis HZ, Monn MF, Cheng L, et al. Plasmacytoid bladder cancer: variant histology with aggressive behavior and a new mode of invasion along fascial planes[J]. Urology,2014,83(5):1112-1116.
[37]Keck B, Ellmann C, Stoehr R, et al. Comparative genomic hybridization shows complex genomic changes of plasmacytoid urothelial carcinoma[J]. Urol Oncol,2014,32(8):1234-1239.
[38]Olsen DL, Anderson SR. Metastatic plasmacytoid urothelial carcinoma: a case report and review of the literature[J]. Acta Cytol,2014,58(1):108-112.

[40]Terada T. Primary pure signet-ring cell adenocarcinoma of the urinary bladder: a report of three cases with an immunohistochemical study[J]. Med Oncol,2012,29(4):2866-2869.
[41]Cekmen N, Aciksoz S, Serdaroglu H, et al. Endobronchial metastasis of a primary transitional-cell and signet-ring cell carcinoma of the urinary bladder[J]. Respir Care,2011,56(7):1033-1036.
[42]Wang J, Wang FW, Kessinger A. The impact of signet-ring cell carcinoma histology on bladder cancer outcome[J]. World J Urol,2012,30(6):777-783.
[43]Akamatsu S, Takahashi A, Ito M, et al. Primary signet-ring cell carcinoma of the urinary bladder[J]. Urology,2010,75(3):615-618.
[44]Hirano Y, Suzuki K, Fujita K, et al. Primary signet ring cell carcinoma of the urinary bladder successfully treated with intra-arterial chemotherapy alone[J]. J Urol,2002,59(4):601.
[45]Fujita M, Otoshi T, Kobayashi K, et al. Primary signet-ring cellcarcinoma of the urinary bladder: a case report[J]. Hinyokikakiyo,2009,55(9):579-582.
[46]Zaghloul MS, Nouh A, Nazmy M, et al. Long-term results of primary a denocarcinoma of the urinary bladder:a report on 192 patients[J]. Urol Oncol,2006,24(1):13-20.
[47]Tagami K, Tanda S, Satake Y, et al. Successful chemotherapy with a docetaxel regimen for primary signet-ring cell carcinoma of the urinary bladder-a case report[J]. Gan To Kagaku Ryoho,2012,39(11):1737-1741.
[48]El Ammari JE, Ahsaini M, Riyach O, et al. Primary signet-ring cell carcinoma of the urinary bladder successfully managed with cisplatin and gemcitabine: a case report[J]. J Med Case Rep,2013,7(1):37-40.
[49]Hamakawa T, Kojima Y, Naiki T, et al. Long-term survival of a patient with invasivesignet-ring cell carcinoma of the urinary bladder managed by combined s-1 and Cisplatin adjuvant chemotherapy[J]. Case Rep Urol,2013,2013:915874.
[50]Pugashetti N, Yap SA, Lara PN Jr, et al. Metastatic signet-ring cell carcinoma of the urinary bladder: A novel management approach to a rare tumour[J]. Can Urol Assoc J,2015,9(3-4):204-207.

