膀胱癌的脂肪酸β氧化代谢研究综述
成松桃 王刚 王行环
近三十年来,膀胱癌的全球发病率逐年增高,现已居于癌症发病率第九位,男性高于女性(男女比例为3.5∶1),发达程度越高的地区其发病率相对更高[1]。膀胱肿瘤的发生由多种内部与外界因素相互作用导致[2],目前的手术和放化疗等综合治疗具有一定的疗效,但是膀胱肿瘤仍然有较高的复发率及致死率[3]。因此探寻特异而敏感的早期肿瘤标志物,是解决其诊断、治疗困境的有效方法。癌症发生的一个重要标志是其能量代谢的改变[4],肿瘤细胞在氧充足的环境下,仍然依靠大量糖酵解供能,最终生成乳酸而非进入三羧酸循环彻底氧化,称为Warburg效应[5]。Otto Warburg认为这种代谢的变化可能是肿瘤发生、发展的关键因素。近年来涌现出许多关于膀胱癌能量代谢的研究[6],均揭示能量代谢的改变在膀胱癌的早期诊断、预后、生物标记的探索方面发挥着重要的作用。但是,这些研究主要集中在肿瘤细胞的糖酵解、脂肪酸合成代谢等方面,对于脂肪酸氧化与膀胱癌之间关系的报道相对较少,而脂肪酸氧化作为肿瘤细胞能量代谢的重要组成部分,对其深入研究有助于我们了解脂肪酸氧化在膀胱癌发生、发展中的作用及机制,为探索膀胱癌诊断及治疗方法另辟蹊径。为此,我们将脂肪酸氧化及其在膀胱癌中相关情况进行综述。
一、脂肪酸β氧化为肿瘤细胞提供大量ATP
脂肪酸的β氧化发生在线粒体基质,大部分的长链脂肪酸需在线粒体外膜上一类脂酰CoA合成酶的作用下活化为脂酰CoA。由于长链的脂酰CoA不能直接透过线粒体内膜,因此需要专门的转运系统将其转变为线粒体基质内的脂酰CoA(图1)。相比于糖类,相同的干质量,脂肪酸通过β氧化所产生的ATP是糖类的2倍,如果是用于能量储存的甘油三酯和糖原,这种差异会达到6倍以上[7]。ATP是各种细胞活动、生物合成的直接能量来源,ATP不足常导致细胞凋亡[8]。Schafer等[9]首次证明了脂肪酸氧化对肿瘤细胞代谢应激状态下的生存起着至关重要的作用。而Samudio等[10]的一项研究则表明了抑制脂肪酸氧化在白血病中的治疗潜力。CPT1是脂酰CoA进入线粒体进行β氧化的关键酶,肝同种型CPT1A存在于除棕色脂肪和骨骼肌细胞的全身其他细胞线粒体中[11],Schlaepfer等[12]通过乙莫克舍不可逆的抑制前列腺癌细胞CPT1A活性,使前列腺癌细胞β氧化受到抑制,细胞的生存能力明显降低,而在前列腺非肿瘤细胞中则无此效果,动物实验结果也表明抑制前列腺癌β氧化可抑制肿瘤组织的生长。Lin等[13]也报道了在恶性胶质瘤中抑制脂肪酸β氧化会抑制细胞增殖,延长小鼠胶质瘤模型的生存时间。
二、脂肪酸β氧化来源的NADPH对细胞存活至关重要
NADPH是关系到细胞存活的另一重要因素,尤其在肿瘤细胞中,NADPH参与核酸和脂肪酸的大量合成,为细胞分裂增殖做准备。另一方面,NADHP还是细胞内重要的还原剂,在氧化应激、肿瘤细胞的代谢应激状态下对细胞的生存具有重要作用[14]。通常细胞内NADPH的来源主要是磷酸戊糖途径。由于线粒体内脂肪酸β氧化的代谢产物乙酰CoA不能自由通过线粒体内膜扩散到胞质,需借助柠檬酸-丙酮酸循环进行转运,此过程也可在胞质中生成NADPH。Jo等[15]报道线粒体内的IDH2对于肿瘤细胞对抗氧化应激、促进细胞存活所需的NADPH的提供也有不可忽视的作用。Pike等[16]发现,抑制恶性胶质瘤细胞的脂肪酸β氧化,不仅显著降低细胞内ATP水平,也会导致细胞内NADPH水平的降低以及活性氧的聚集,从而提示脂肪酸β氧化来源的NADPH可以对抗细胞内氧化损伤所导致的细胞死亡,而对于脂肪酸氧化通过何种生化途径生成NADPH并未给出直接证明。Jeon等[17]的研究表明,代谢应激状态下肿瘤细胞通过AMPK通路激活脂肪酸氧化,维持细胞内NADPH水平,对抗细胞内活性氧聚集,促进细胞生存。
三、脂肪酸β氧化为膀胱癌细胞生物合成提供底物
肿瘤细胞为适应其快速增殖的能力需大量合成新细胞所需的生物大分子,脂类作为体内各种生物膜的组分,多种生物活性物质的前体,其合成量直接关系到肿瘤细胞的增殖速度,比如在许多人类肿瘤细胞中都发现脂肪酸的从头合成途径极其活跃[18]。一般人们认为脂肪酸合成和氧化互相拮抗,脂肪酸合成增强必然会抑制脂肪酸氧化,这是因为脂肪酸从头合成的第一步关键步骤——两分子乙酰CoA在ACC作用下生成丙二酰CoA,其关键酶ACC的活性决定了细胞是进行脂肪酸氧化还是脂肪酸合成。Jeon等[17]的报道指出ACC1和ACC2的基因调控会导致肿瘤细胞进行脂肪酸氧化或合成的不同结果,考虑到ACC1和ACC2在细胞内的定位不同[19],并且脂肪酸β氧化能为细胞质中脂肪酸的从头合成提供大量乙酰CoA以及脂肪酸合成所需的NADPH和ATP等,脂肪酸合成和氧化在肿瘤细胞中有可能同时被激活,或相互支持[20]。另外脂肪酸β氧化也可为膀胱癌细胞合成胆固醇提供大量底物,若抑制膀胱癌细胞胆固醇合成,其增殖也会受到抑制[21]。
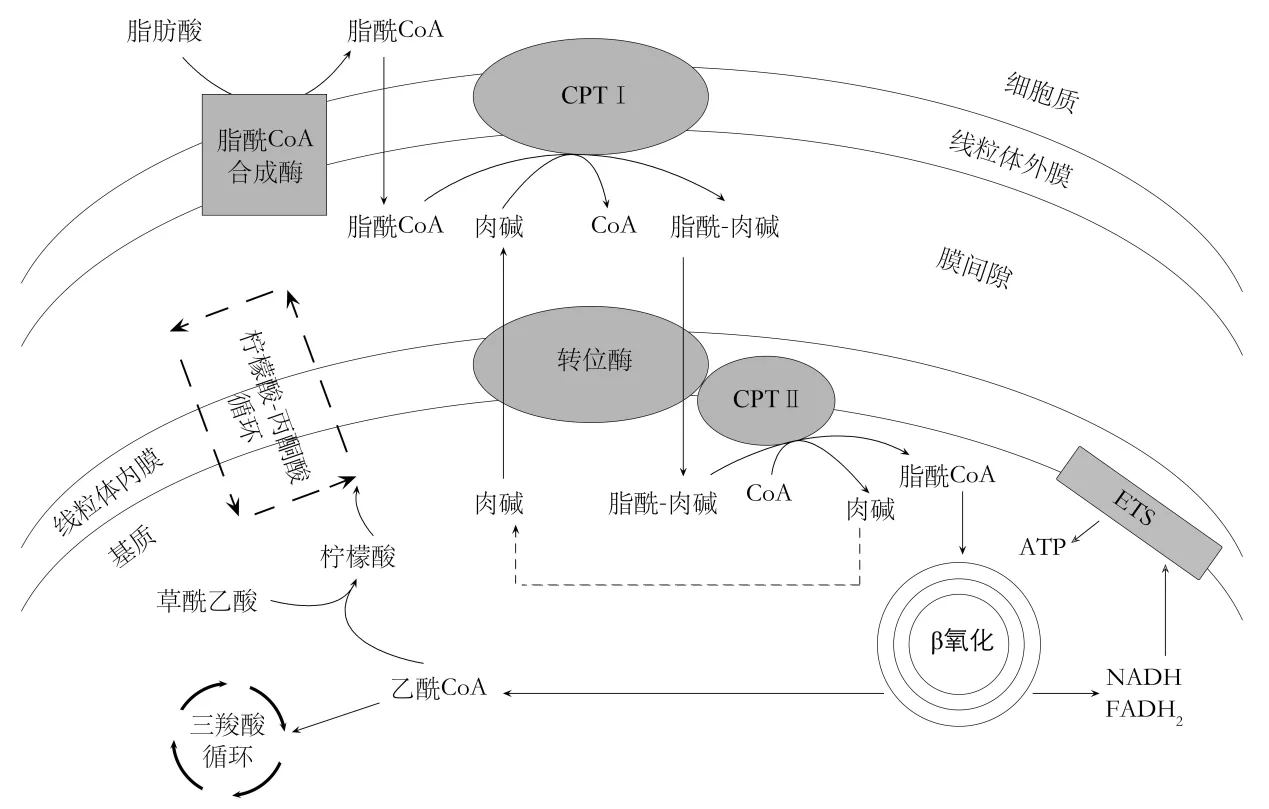
图1脂肪酸跨线粒体膜进行β氧化:胞质中的长链脂肪酸通过肉碱转运系统进入线粒体基质,每一次的β氧化脱下2个碳原子,生成一分子乙酰CoA、NADH和FADH2,NADH和FADH2可直接进入位于线粒体内膜的电子传递体系,参与氧化磷酸化,乙酰CoA随后进入三羧酸循环或转运出基质,作为胆固醇或脂肪酸合成等的底物
四、膀胱癌中活跃的脂肪酸β氧化
代谢组学是对生物体内所有代谢产物的综合分析,以此来寻找代谢物变化与病理生理变化间的相对关系[22]。癌细胞相比于正常细胞,需要大量的能量和大分子物质的供应,来满足其快速增殖。因此深入研究此类代谢产物的变化,有助于我们对肿瘤发生、发展的病理机制的理解,同时,也有利于我们发现一些潜在的癌症诊断治疗的生物标志物。随着色谱、质谱等技术的发展和应用[23],用于膀胱癌代谢组学研究的样本包括了细胞系、切除的癌组织和人体的体液(尿液和血液),其中尿液和血液标本在临床上可以非常方便快捷的取得。相比于其他类型肿瘤代谢组学的研究[24-25],虽然膀胱癌有关的研究相对较少,但仍有部分研究揭示了一些可能用于膀胱癌早期诊断的潜在生物标记[26-28]。陈永婧等[29]采用液相色谱-电喷雾质谱连用技术,对20例膀胱癌患者和24名正常人进行分析,在其尿液和血清中分别发现13个潜在标志物,其中包括了肉碱、酰基肉碱等脂肪酸β氧化过程中重要的代谢物。
为探索不同级别膀胱癌代谢物的改变,Alberice等[30]根据治疗后随访信息将48例膀胱癌患者按分期、分级的不同以及是否复发进展分为4个组:低风险-稳定(LS),低风险-复发(LR),高风险-稳定(HL),高风险-复发(HR)。并利用LC-MS和CE-MS 分析了患者在治疗前和治疗后随访的尿液样本,发现27种在不同组间具有显著差异的代谢物。这些代谢物可能成为临床诊断膀胱癌、区分疾病发展阶段,以及判断预后的候选生物标记。Jin等[27]用HPLC-QTOFMS分析了138例膀胱癌患者和121例非膀胱癌患者的尿液代谢物,发现12种可区分膀胱癌和正常对照、肌层浸润性和非浸润性膀胱癌的代谢物,包括脂肪酸β氧化过程中的肉碱、脂酰肉碱等,揭示脂肪酸β氧化可能在膀胱癌发生、发展中起着关键的作用。Cao等[31]采用基于1H NMR的代谢组学分析,发现相比正常人群,膀胱癌患者血清中乙酰乙酸和脂类处于升高状态。Tripathi等[32]也报道了膀胱癌组织中甘油三酯(脂肪酸的主要来源)水平低于正常对照而其代谢产物水平增高。Putluri等[33]采用LC/MS发现膀胱癌尿液样本中游离脂肪酸浓度增高,以及丙酮、β-羟丁酸等酮体的升高都提示了膀胱癌细胞中脂肪酸β氧化途径的活跃。
五、总结和展望
正常细胞中的糖代谢、脂肪酸合成和氧化相互联系,处于动态平衡中,膀胱癌细胞的代谢改变使这种平衡发生变化。因细胞的快速增殖、分裂需要合成大量相关蛋白、核酸以及能量供应,并且在恶劣环境中依然能保持这种状态。现阶段代谢组学的相关研究已经揭示了膀胱癌细胞中相关代谢物的改变,并尝试寻找作为区分正常人群和膀胱癌患者,甚至膀胱癌不同分期、分级的生物标记。相对于基因检测,许多代谢产物的检测应用于临床可行性更好,病人更易于接受,尤其是在疾病的早期诊断方面。通过过去的大量研究,我们知道,由于肿瘤细胞内代谢途径的复杂性及相互关联性,针对某一特定酶类或代谢通路的治疗往往难以取得较好的效果,因此,通过了解不同代谢通路的改变及其相关性,通过联合某一代谢通路与其他通路,或与化疗药物联用,有望在膀胱癌患者治疗中起到突破性的作用。脂肪酸β氧化作为肿瘤细胞代谢的重要组成部分,其在ATP生成及生物合成过程中有着不可替代的作用,针对脂肪酸β氧化的研究在膀胱癌早期诊断、预后以及联合治疗方面有着巨大的潜力。
[1]Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer,2015,136(5):E359-386.
[2]Burger M, Catto JW, Dalbagni G, et al. Epidemiology and risk factors of urothelial bladder cancer[J]. Eur Urol,2013,63(2):234-241.
[3]Kamat AM, Hahn NM, Efstathiou JA, et al. Bladder cancer[J]. Lancet,2016,388(10061):2796-2810.
[4]Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation[J]. Cell,2011,144(5):646-674.
[5]Koppenol WH, Bounds PL, Dang CV. Otto Warburg's contributions to current concepts of cancer metabolism[J]. Nat Rev Cancer,2011,11(5):325-337.
[6]Massari F, Ciccarese C, Santoni M, et al. Metabolic phenotype of bladder cancer[J]. Cancer Treat Rev,2016,45:46-57.
[7]Carracedo A, Cantley LC, Pandolfi PP. Cancer metabolism: fatty acid oxidation in the limelight[J]. Nat Rev Cancer,2013,13(4):227-232.
[8]Izyumov DS, Avetisyan AV, Pletjushkina OY, et al. "Wages of fear": transient threefold decrease in intracellular ATP level imposes apoptosis[J]. Biochim Biophys Acta,2004,1658(1-2):141-147.
[9]Schafer ZT, Grassian AR, Song L, et al. Antioxidant and oncogene rescue of metabolic defects caused by loss of matrix attachment[J]. Nature,2009,461(7260):109-113.
[10]Samudio I, Harmancey R, Fiegl M, et al. Pharmacologic inhibition of fatty acid oxidation sensitizes human leukemia cells to apoptosis induction[J]. J Clin Invest,2010,120(1):142-156.
[11]Brown NF, Hill JK, Esser V, et al. Mouse white adipocytes and 3T3-L1 cells display an anomalous pattern of carnitine palmitoyltransferase (CPT) I isoform expression during differentiation. Inter-tissue and inter-species expression of CPT I and CPT II enzymes[J]. Biochem J,1997,327(Pt 1):225-231.
[12]Schlaepfer IR, Rider L, Rodrigues LU, et al. Lipid catabolism via CPT1 as a therapeutic target for prostate cancer[J]. Mol Cancer Ther,2014,13(10):2361-2371.
[13]Lin H, Patel S, Affleck VS, et al. Fatty acid oxidation is required for the respiration and proliferation of malignant glioma cells[J]. Neuro Oncol,2017,19(1):43-54.
[14]Jones RG, Thompson CB. Tumor suppressors and cell metabolism: a recipe for cancer growth[J]. Genes Dev,2009,23(5):537-548.
[15]Jo SH, Son MK, Koh HJ, et al. Control of mitochondrial redox balance and cellular defense against oxidative damage by mitochondrial NADP+-dependent isocitrate dehydrogenase[J]. J Biol Chem,2001,276(19):16168-16176.
[16]Pike LS, Smift AL, Croteau NJ, et al. Inhibition of fatty acid oxidation by etomoxir impairs NADPH production and increases reactive oxygen species resulting in ATP depletion and cell death in human glioblastoma cells[J]. Biochim Biophys Acta,2011,1807(6):726-734.
[17]Jeon SM, Chandel NS, Hay N. AMPK regulates NADPH homeostasis to promote tumour cell survival during energy stress[J]. Nature,2012,485(7400):661-665.
[18]Kuhajda FP. Fatty acid synthase and cancer: new application of an old pathway[J]. Cancer Res,2006,66(12):5977-5980.
[19]Abu-Elheiga L, Brinkley WR, Zhong L, et al. The subcellular localization of acetyl-CoA carboxylase 2[J]. Proc Natl Acad Sci U S A,2000,97(4):1444-1449.
[20]Caro P, Kishan AU, Norberg E, et al. Metabolic signatures uncover distinct targets in molecular subsets of diffuse large B cell lymphoma[J]. Cancer Cell,2012,22(4):547-560.
[21]Wang G, Cao R, Wang Y, et al. Simvastatin induces cell cycle arrest and inhibits proliferation of bladder cancer cells via PPARγ signalling pathway[J]. Sci Rep,2016,6:35783.
[22]Monteiro MS, Carvalho M, Bastos ML, et al. Metabolomics analysis for biomarker discovery: advances and challenges[J]. Curr Med Chem,2013,20(2):257-271.
[23]Aboud OA, Weiss RH. New opportunities from the cancer metabolome[J]. Clin Chem,2013,59(1):138-146.
[24]Sreekumar A, Poisson LM, Rajendiran TM, et al. Metabolomic profiles delineate potential role for sarcosine in prostate cancer progression[J]. Nature,2009,457(7231):910-914.
[25]Ganti S, Taylor SL, Kim K, et al. Urinary acylcarnitines are altered in human kidney cancer[J]. Int J Cancer,2012,130(12):2791-2800.
[26]Conde VR, Oliveira PF, Nunes AR, et al. The progression from a lower to a higher invasive stage of bladder cancer is associated with severe alterations in glucose and pyruvate metabolism[J]. Exp Cell Res,2015,335(1):91-98.
[27]Jin X, Yun SJ, Jeong P, et al. Diagnosis of bladder cancer and prediction of survival by urinary metabolomics[J]. Oncotarget,2014,5(6):1635-1645.
[28]Bansal N, Gupta A, Mitash N, et al. Low- and high-grade bladder cancer determination via human serum-based metabolomics approach[J]. J Proteome Res,2013,12(12):5839-5850.
[29]陈永婧,王小华,黄真真,等. 膀胱癌血清及尿液代谢组学研究[J]. 分析化学,2012,40(9):1322-1328.
[30]Alberice JV, Amaral AF, Armitage EG, et al. Searching for urine biomarkers of bladder cancer recurrence using a liquid chromatography-mass spectrometry and capillary electrophoresis-mass spectrometry metabolomics approach[J]. J Chromatogr A,2013,1318:163-170.
[31]Cao M, Zhao L, Chen H, et al. NMR-based metabolomic analysis of human bladder cancer[J]. Anal Sci,2012,28(5):451-456.
[32]Tripathi P, Somashekar BS, Ponnusamy M, et al. HR-MAS NMR tissue metabolomic signatures cross-validated by mass spectrometry distinguish bladder cancer from benign disease[J]. J Proteome Res,2013,12(7):3519-3528.
[33]Putluri N, Shojaie A, Vasu VT, et al. Metabolomic profiling reveals potential markers and bioprocesses altered in bladder cancer progression[J]. Cancer Res,2011,71(24):7376-7386.

