自噬促进骨髓间充质干细胞复制性衰老过程中衰老相关基因表达
吴尚蓉,郑勇,卓儒红,何柳,胡成俊*
(1武汉大学基础医学院人体解剖学与组织胚胎学系;2武汉大学中南医院综合医疗科,武汉,430071)
骨髓间充质干细(Bone marrow mesenchymal stem cells, BMSCs)具有自我更新和分化成多种细胞谱系的特性[1-3],并且具有来源广泛、易于分离培养和免疫调节作用等特点[4],这些特性使其成为组织工程和再生医学中的种子细胞。然而,BMSCs像其它正常体细胞一样体外寿命有限,在经过一定数量的细胞分裂后,BMSCs进入生长停滞的复制性衰老状态[5]。随着BMSCs进入衰老的状态,BMSCs逐渐丧失多向分化的能力,这既不利于组织的更新和修复,也是阻碍BMSCs临床应用的重要瓶颈[6,7]。因此,需要进一步阐明BMSCs的衰老机制,探讨延缓BMSCs衰老的可能的方法,这对基于BMSCs的治疗和组织工程的应用具有重要的价值。
细胞衰老是一个包括氧化应激、端粒异常、染色体损伤和细胞自噬等多种细胞分子事件共同参与的复杂生物现象[7,8],根据衰老的发生是否与端粒缩短有关,可以分为复制性衰老和应激性衰老两种类型。衰老的细胞虽然出现细胞周期的停滞,但是细胞的新陈代谢还在继续[8]。以往对应激性衰老的研究发现,衰老细胞中自噬活性的增强起到稳定衰老状态的作用[9]。然而,自噬对复制性衰老的影响和具体调控机制仍然不甚明确。
自噬能够清除异常的蛋白质和受损的细胞器,从而维持细胞的能量代谢以利于细胞的存活[10]。异常的蛋白质和损伤的线粒体主要由活性氧(reactive oxygen species, ROS)的积累引起[11,12]。ROS是氧化应激反应中的重要诱导因子,过度积累的ROS会破坏细胞稳态,引起多种氧化应激损伤和线粒体的功能障碍[13]。有报道指出,衰老BMSCs中ROS含量增加[14]。自噬可以通过清除ROS损伤的线粒体和蛋白质,减轻ROS导致的氧化应激损伤[15]。本研究旨在探讨自噬对BMSCs复制性衰老的调控作用,分析自噬对ROS的调控与BMSCs复制性衰老的关系。
材料和方法
1 材料
雄性Sprague-Dawley大鼠,110~150g,购自武汉大学动物中心。5-溴脱氧尿嘧啶核苷(Brdu)、雷帕霉素(rapamycin, Rap)购自Selleck公司;巴佛洛霉素A1(ba fi lomycin A1, BaF1)购自Cayman Chemical公司;细胞衰老β-半乳糖苷酶染色试剂盒购自上海翊圣生物科技有限公司;逆转录试剂盒购自TaKaRa公司;RT-PCR试剂盒购自Bimake公司;LC3I/II一抗购自CST公司;Brdu一抗、Cy3标记的羊抗小鼠IgG二抗均购自武汉博士德生物公司;活性氧检测试剂盒、RIPA裂解液、苯甲基磺酰氟(PMSF)、BCA蛋白浓度测定试剂盒均购自碧云天生物技术公司;辣根过氧化物酶标记的山羊抗小鼠IgG二抗购自北京博奥龙免疫技术有限公司;引物均由武汉擎科生物技术有限公司合成。
2 骨髓间充质干细胞的分离、培养以及体外衰老模型的建立
参照本实验室已有的方法[16],全骨髓贴壁法获得大鼠骨髓间充质干细胞,标记为P0,置于37℃,5%的CO2的培养箱中培养,3d后首次换液,后期每2~3d换一次液以去除未贴壁的杂细胞,细胞70%~80%融合后用含有EDTA的0.25%胰蛋白酶消化传代。待细胞传到第6代时,分别以400nmol/L BaF1和400nmol/L Rap处理24h,进行后续实验。
3 细胞衰老β-半乳糖苷酶染色检测细胞衰老情况
六孔板中细胞长到70%~80%融合时,按照衰老β-半乳糖苷酶染色试剂盒说明书进行染色,在37℃孵育过夜,光学显微镜下随机选取3个视野计数半乳糖苷酶阳性细胞的比率。
4 5-溴脱氧尿嘧啶核苷(Brdu)掺入法检测细胞增殖能力
将细胞接种到24孔板,待细胞达到70%融合时,加入Brdu(终浓度10mmol/L)孵育24h后,弃掉培养基,PBS洗3次,加入固定液(甲醇:乙酸=3:1)后于-20℃固定20min,PBS洗3次,1mol/L HCl冰上变性30min,2mol/L HCl 37℃变性30min。Brdu一抗(1:150)室温孵育2h,PBST洗3次,Cy3标记的羊抗小鼠IgG二抗(1:800)孵育1h,PBST洗3次后DAPI(1:1000)染核5min,在荧光显微镜下观察阳性细胞的比率。
5 Western blot检测自噬相关蛋白表达情况
待细胞长到80%融合时,将细胞用胰酶消化下来后,用含有PMSF的RIPA裂解液于冰上裂解30mim。样品的蛋白浓度用BCA试剂盒测定。样品经聚丙烯酰胺凝胶电泳分离后转移到PVDF膜上后,5%脱脂牛奶封闭1h,分别加入一抗LC3I/II(1:1000),GAPDH(1:5000),4℃孵育过夜,TBST洗3次,加入辣根过氧化物酶标记的二抗(1:5000),室温孵育1h,TBST洗3次后用ECL化学发光试剂盒显影蛋白条带。
6 实时荧光定量qPCR检测衰老和自噬相关基因的表达情况
用Trizol法提取细胞总RNA,按照说明书的操作方法用TaKaRa逆转录试剂盒将RNA逆转录成cDNA。各引物序列见表1。qPCR反应条件:预变性:95℃ 5min,变性:95℃ 5s,退火:56℃ 30s,延伸:72℃ 20s,40个循环。采用2-ΔΔCt法对试验结果进行数据处理,每组实验至少重复3次。
7 DCFH-DA染色法检测细胞内活性氧(ROS)

表1 定量引物序列Tab. 1 Primer sequence
待细胞70%~80%融合时,用胰酶将细胞消化下来,PBS洗一遍后离心,加入1ml稀释的DCFH-DA染液,37℃培养箱中孵育20min,使探针与细胞充分接触。PBS洗3次后,用PBS重悬,上流式细胞仪检测DCFH-DA荧光,其荧光强度反映胞内活性氧(ROS)的水平。
8 统计学分析
采用Prism5软件进行实验数据分析,所有数据以均数±标准差表示,组间比较采用t检验,P<0.05时表示具有显著性差异。
结 果
1 第6代BMSCs进入复制性衰老状态
通过分析BrdU掺入率,SA-β-gal染色阳性率和衰老相关基因(p21Waf1和p16ink4a)的表达确定BMSCs的衰老状态。与第二代(passage 2, P2)的BMSCs比较,P6细胞大多扁平宽厚,形态不规则;细胞增殖停滞,Brdu掺入率由P2细胞的80%降低到10%(图1A)。通过SA-β-gal染色,发现在P6 BMSCs有90%的细胞的核周呈现蓝色(SA-β-gal染色阳性)染色(图1B)。在P6 BMSCs,衰老相关基因p21Waf1和p16ink4amRNA表达水平较在P2 BMSCs明显升高(图1C)。这些结果说明BMSCs在培养至P6时即进入了复制性衰老的状态。
2 衰老BMSCs自噬活性增强
为了观察体外连续传代培养BMSCs自噬活性的变化,利用qPCR和Western blot检测自噬基因的表达情况。与P2 BMSCs比较,P6 BMSCs自噬相关基因ATG12 mRNA的表达水平明显升高(图2A),自噬特征性蛋白LC3II/LC3I比值也明显升高(图2B)。这些结果说明体外连续培养BMSCs发生复制性衰老时伴随着自噬活性增强。
3 衰老BMSCs氧化应激增强
应用DCFH-DA染色法检测细胞内ROS的含量,观察细胞内氧化应激水平的改变。DCFH-DA染色结果显示,与P2 BMSCs比较,P6 BMSCs的荧光强度较P2细胞明显增强(图3)。由此提示,体外连续培养BMSCs发生复制性衰老时,伴随着氧化应激水平增强。
4 衰老BMSCs自噬活性的增强可促进衰老相关基因表达
为了分析复制性衰老的BMSCs自噬活性的改变与衰老基因表达的关系,我们使用自噬抑制剂巴佛洛霉素A1(BaF1)和自噬激活剂雷帕霉素(Rap)处理P6 BMSCs。结果显示,与未作处理的P6组相比,BaF1处理组的自噬流被阻断(图4A),自噬相关基因ATG12 mRNA和衰老相关基因p21Waf1、p16ink4amRNA表达水平降低(图4B);而Rap处理组ATG12 mRNA表达水平和LC3II/LC3I蛋白比值均明显升高(图4C, D),且衰老相关基因p21Waf1和p16ink4amRNA表达水平升高(图4E)。由此提示,自噬活性的增强可促进BMSCs复制性衰老的进程。
5 衰老BMSCs自噬活性增强能降低细胞ROS含量
为了观察复制性衰老BMSCs(P6 BMSCs)自噬活性的改变对细胞内氧化应激水平的影响,P6 BMSCs在分别经过BaF1和Rap处理后,通过DCFHDA染色检测发现,与未作处理的P6 BMSCs相比,BaF1处理组荧光强度增强,ROS含量增加,而Rap处理组荧光强度减弱(图5),ROS含量减低。由此提示,在复制性衰老BMSCs中自噬参与细胞中ROS含量的调节。
讨 论

图1 体外连续培养对BMSCs增殖能力及衰老的影响。 A,BrdU掺入法检测P2和P6 BMSCs的增殖能力; B,SA-β-gal染色法检测P2和P6 BMSCs的衰老情况;C,qPCR检测p21Waf1和p16ink4a mRNA的表达水平; *,与P2 BMSCs比较,0.01<P<0.05;比例尺:A,100µm;B,250µmFig. 1 The proliferation and aging of BMSCs during continuous in vitro culture. A, Brdu incorporation assay was performed to compare the proliferative ability of BMSCs at P2 and P6; scale bar, 100µm; B, SA-β-gal staining comparison between passage 2 and 6; scale bar, 250µm; C, qPCR analysis of p21Waf1 and p16ink4a mRNA levels; *, 0.01<P<0.05, compared with P2 BMSCs
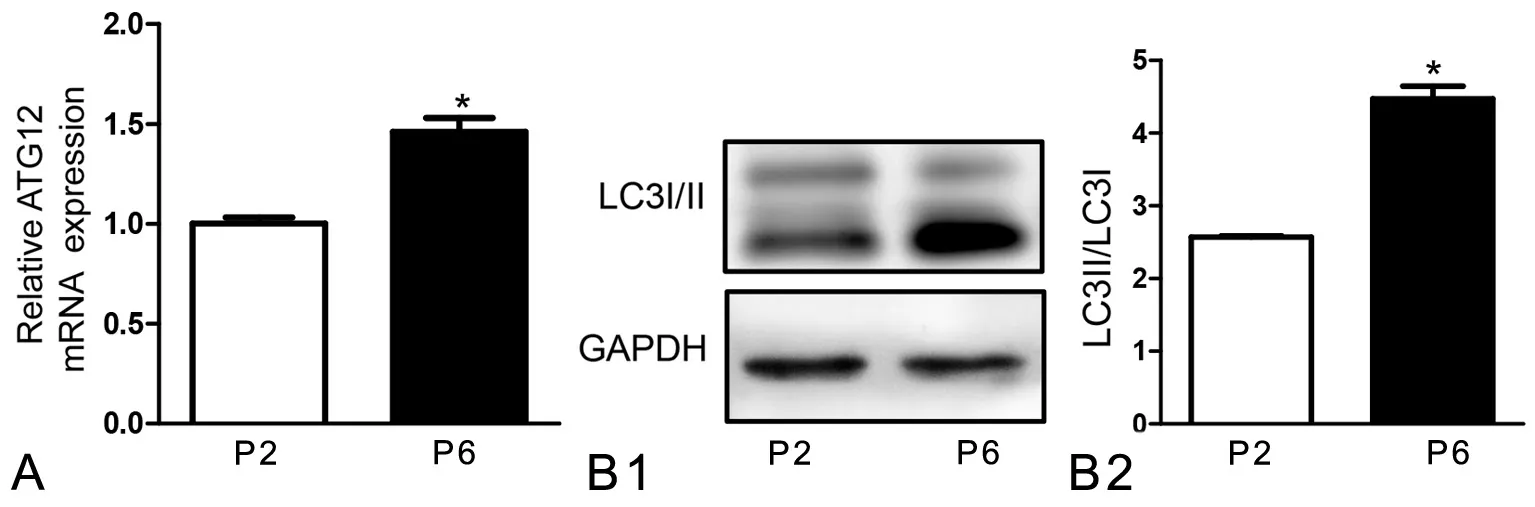
图2 体外连续培养BMSCs时自噬相关蛋白和基因的变化。A,qPCR检测ATG12 mRNA的表达水平;B, LC3I/II水平Western blot检测(B1)及统计学分析(B2);*,与P2 BMSCs比较,0.01<P<0.05Fig. 2 The changes of aging related gene and protein expressions in BMSCs during continuous in vitro culture. A, qPCR analysis of Atg12 mRNA levels;B, Western blot detection of LC3I/II and statistical analysis (B2); *, 0.01<P <0.05, compared with P2 BMSCs
骨髓间充质干细胞在细胞治疗和组织工程中有很大的应用潜力[17,18]。但由于BMSCs会经历复制性衰老,这对BMSCs的广泛使用是极其不利的。在本研究中,我们通过在体外连续传代培养BMSCs来获取复制性衰老的BMSCs,在培养BMSCs至P6时,BMSCs增殖停滞,且呈现出宽大而扁平的细胞形态,SA-β-gal染色显示P6染色阳性率达到90%,并且在P6细胞中p21Waf1和p16ink4amRNA的表达水平也较P2 BMSCs明显升高。按照以往衰老研究标准,在本研究中的P6 BMSCs已经进入复制性衰老的状态。

图3体外连续培养BMSCs时 ROS含量的变化。A,流式细胞术分析DCF荧光强度;B, DCF荧光强度统计学分析;*,与P2 BMSCs比较,0.01<P<0.05Fig. 3 The changes of intracellular ROS during continuous culture of BMSCs in vitro; A, flow cytometry analysis of DCF fl uorescence intensity; B,statistical analysis of DCF fl uorescence intensity; *, 0.01< P <0.05, compared with P2 BMSCs

图4 自噬活性对P6 BMSCs衰老相关基因表达影响的检测。 A,Western blot检测BaF1组LC3I/II表达;B,qPCR检测 BaF1组p21Waf1和p16ink4a mRNA表达水平的变化;C,qPCR检测Rap组ATG12 mRNA的表达;D,Western blot检测Rap组LC3I/II表达; E,qPCR检测Rap组p21Waf1和p16ink4a mRNA的表达情况;*,与P2 BMSCs比较,0.01<P<0.05Fig. 4 The effect of autophagy on aging-related gene expression in P6 BMSCs. A, Western blot analysis of LC3 in BMSCs treated with BaF1; B, qPCR analysis of p21Waf1 and p16ink4a mRNA level changes in response to BaF1 treatment; and C, ATG12 mRNA level changes after Rap treatment; D, Western blot analysis of LC3 in BMSCs treated with Rap; E, qPCR analysis of p21Waf1 and p16ink4a mRNA levels in BMSCs treated with Rap; *, 0.01< P <0.05,compared with P2 BMSCs
细胞在进入衰老状态后,虽然发生细胞周期的阻滞,但细胞代谢并没有停止。其中自噬参与的代谢在细胞由增殖状态转变为衰老状态时起重要作用[19,20]。本研究中,我们发现在体外培养BMSCs至P6时,自噬相关基因ATG12 mRNA的表达水平升高,自噬特征性蛋白LC3II/LC3I比值也明显升高,表明自噬机制也参与BMSCs复制性衰老的过程。以往的研究发现,BMSCs自噬活性的降低能够延缓细胞进入衰老状态[16]。为了进一步分析自噬活性在BMSCs复制性衰老过程中的作用,我们采用自噬抑制剂BaF1和自噬激活剂Rap对P6 BMSCs进行处理,发现在BaF1处理后,自噬流发生阻断,同时衰老相关基因p21Waf1和p16ink4amRNA的表达水平明显降低;在Rap处理组,ATG12 mRNA的表达和LC3II/LC3I的比值增加,p21Waf1和p16ink4amRNA表达水平也增加。因此在复制性衰老的BMSCs中,自噬对其衰老状态的建立起重要的调控作用,通过抑制自噬可以在一定程度上缓解BMSCs的衰老状态。
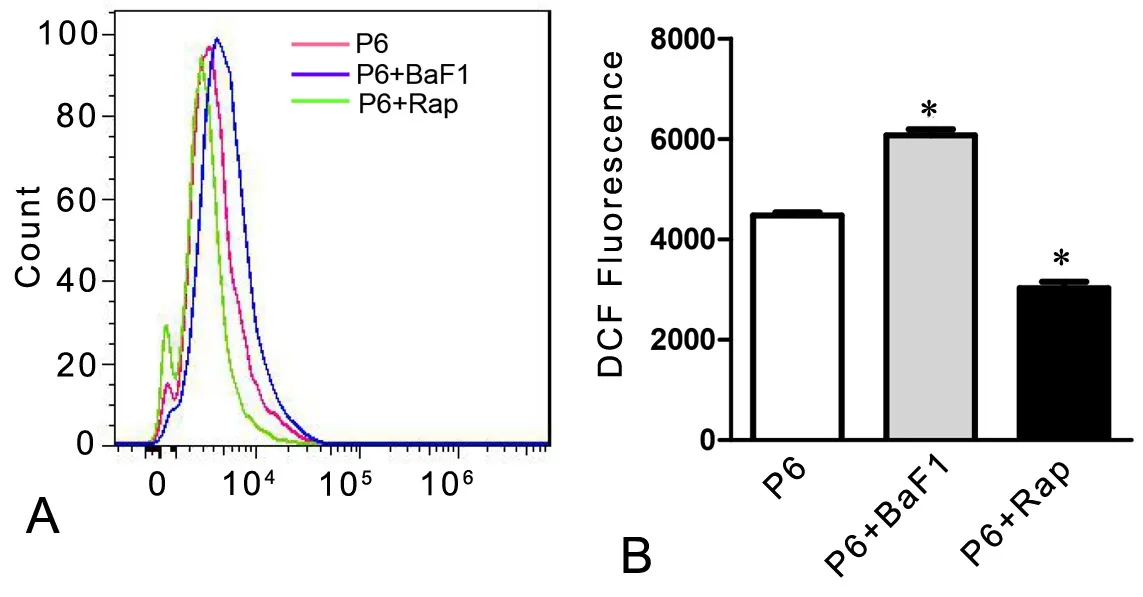
图5 自噬活性对衰老 BMSCs细胞内ROS产生的影响。A,流式细胞术分析DCF荧光强度;B,DCF荧光强度统计学分析;*,与P2 BMSCs比较,0.01<P<0.05Fig. 5 Effect of autophagy on ROS accumulation in P6 BMSCs. A, flow cytometry analysis of DCF fl uorescence intensity; B, statistical analysis of DCF fl uorescence intensity in P2 and P6 BMSCs; *, 0.01< P<0.05, compared with P2 BMSCs
细胞衰老的发生与ROS的关系密切,Banaban发现细胞内ROS含量的增加是BMSCs衰老的重要原因[21]。在本研究中,发现在体外培养BMSCs至P6时,伴随BMSCs进入复制性衰老状态,细胞ROS的含量增加,说明ROS很可能是BMSCs发生复制性衰老的一个重要原因。以往研究发现自噬能降解氧化损伤蛋白和降低ROS含量从而有利于氧化应激条件下的细胞存活[22],并且自噬缺陷时ROS产生增多导致细胞发生DNA损伤[23,24]。为了进一步探讨自噬对衰老的调控机制,在自噬抑制剂BaF1和自噬激活剂Rap对P6 BMSCs进行处理后,我们观察了ROS的改变。研究发现用BaF1处理后,ROS含量增加,这可能是由于抑制自噬活性影响异常蛋白质和线粒体的清除的原因[25]。在Rap处理组,伴随着激活自噬后对异常蛋白质和损伤线粒体的清除能力增强[25],ROS的积累减少。一般情况下,细胞内ROS含量的降低能够缓解细胞的衰老状态,而在本研究中在对P6 BMSCs用Rap处理后,衰老相关基因的表达增加,但ROS含量反而减低;BaF1处理组BMSCs出现衰老相关基因表达降低,但ROS含量反而升高。这说明在复制性衰老的过程中,自噬对复制性衰老具有一定调节作用,虽然复制性衰老伴有ROS含量的增加,但自噬活性对衰老的调控并不是完全通过ROS机制。
在本研究中,我们在建立BMSCs复制性衰老模型的基础上,探讨了自噬在BMSCs复制性衰老中的作用机制。伴随BMSCs复制性衰老的进程,细胞内自噬活性增强,细胞内ROS的含量增加。在我们对自噬进行抑制和促进后发现复制性衰老的进程和ROS的含量的变化并不一致,这说明自噬活性对BMSCs复制性衰老有一定的调节作用,但是其调控并不是完全通过ROS机制。通过解释BMSCs复制性衰老过程中自噬的具体作用机制能够让我们更好的认识衰老的本质,自噬对BMSCs复制性衰老的具体调控机制也是我们下一步深入研究的方向。
[1] Barry FP, Murphy JM. Mesenchymal stem cells: clinical applications and biological characterization. Int J Biochem Cell Biol, 2004, 36(4): 568-584.
[2] Dominici M, Le Blanc K, Mueller I, et al. Minimal criteria for de fi ning multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement.Cytotherapy, 2006, 8(4): 315-317.
[3] Paniushin OV, Domaratskaia EI, Starostin VI. Mesenchymal stem cells: sources, phenotype, and differentiation potential.Izv Akad Nauk Ser Biol, 2006, 33(1): 6-25.
[4] Mareschi K, Ferrero I, Rustichelli D, et al. Expansion of mesenchymal stem cells isolated from pediatric and adult donor bone marrow. J Cell Biochem, 2006, 97(4): 744-754.
[5] Wagner W, Horn P, Castoldi M, et al. Replicative senescence of mesenchymal stem cells: a continuous and organized process. PLoS One, 2008, 3(5): e2213.
[6] Bonab MM, Alimoghaddam K, Talebian F, et al. Aging of mesenchymal stem cell in vitro. BMC Cell Biol, 2006, 7(1):14.
[7] Baxter MA, Wynn RF, Jowitt SN, et al. Study of telomere length reveals rapid aging of human marrow stromal cells following in vitro expansion. Stem Cells, 2004, 22(5): 675-682.
[8] Campisi J, D’Adda DFF. Cellular senescence: when bad things happen to good cells. Nat Rev Mol Cell Biol, 2007,8(9): 729-740.
[9] Narita M, Young AR, Narita M. Autophagy facilitates oncogene-induced senescence. Autophagy, 2009, 5(7): 1046-1047.
[10] Ureshino RP, Rocha KK, Lopes GS, et al. Calcium signaling alterations, oxidative stress, and autophagy in aging. Antioxid Redox Signal, 2014, 21(1): 123-137.
[11] Chakrabarti S, Jahandideh F,Wu J. Food-derived bioactive peptides on in fl ammation and oxidative stress. Biomed Res Int, 2014, 2014: 608979.
[12] Knight JA. Diseases related to oxygen-derived free radicals.Ann Clin Lab Sci, 1995, 25(2): 111-121.
[13] Li L, Tan J, Miao Y, et al. ROS and Autophagy: Interactions and Molecular Regulatory Mechanisms. Cell Mol Neurobiol, 2015, 35(5): 615-621.
[14] Ksiazek K. A comprehensive review on mesenchymal stem cell growth and senescence. Rejuvenation Res, 2009, 12(2):105-116.
[15] Li L, Tan J, Miao Y, et al. ROS and Autophagy: Interactions and Molecular Regulatory Mechanisms. Cell Mol Neurobiol, 2015, 35(5): 615-621.
[16] Zheng Y, Hu CJ, Zhuo RH, et al. Inhibition of autophagy alleviates the senescent state of rat mesenchymal stem cells during long-term culture. Mol Med Rep, 2014, 10(6): 3003-3008.
[17] Fukuda K, Sakamoto N, Narita T, et al. Application of effi-cient and speci fi c gene transfer systems and organ culture techniques for the elucidation of mechanisms of epithelial-mesenchymal interaction in the developing gut. Dev Growth Differ, 2000, 42(3): 207-211.
[18] Bruder SP, Kurth AA, Shea M, et al. Bone regeneration by implantation of purified, culture-expanded human mesenchymal stem cells. J Orthop Res, 1998, 16(2): 155-162.
[19] Narita M, Narita M, Krizhanovsky V, et al. A novel role for high-mobility group a proteins in cellular senescence and heterochromatin formation. Cell, 2006, 126(3): 503-514.
[20] Young AR, Narita M, Ferreira M, et al. Autophagy mediates the mitotic senescence transition. Genes Dev, 2009, 23(7):798-803.
[21] Balaban RS, Nemoto S, Finkel T. Mitochondria, oxidants,and aging. Cell, 2005, 120(4): 483-495.
[22] Xiong Y, Contento AL, Nguyen PQ, et al. Degradation of oxidized proteins by autophagy during oxidative stress in Arabidopsis. Plant Physiol, 2007, 143(1): 291-299.
[23] Kodama R, Kato M, Furuta S, et al. ROS-generating oxidases Nox1 and Nox4 contribute to oncogenic Ras-induced premature senescence. Genes Cells, 2013, 18(1): 32-41.
[24] Ramsey MR, Sharpless NE. ROS as a tumour suppressor?Nat Cell Biol, 2006, 8(11): 1213-1215.
[25] Mizushima N, Levine B, Cuervo AM, et al. Autophagy fi ghts disease through cellular self-digestion. Nature, 2008,451(7182): 1069-1075.

