在线提取-高效液相色谱-二极管阵列检测-四极杆飞行时间质谱法快速鉴定陈皮中黄酮类化合物
童超英, 彭密军, 施树云*(. 中南大学化学化工学院, 湖南 长沙 40003; . 广东省测试分析研究所, 中国广州分析测试中心, 广东 广州 50070)
中药活性成分的分析鉴定是阐明其药效物质基础的前提,也是中药质量控制的基础和核心。中药活性成分的分析鉴定一般包括样品前处理和色谱分析两部分。传统的样品前处理方法(如加热回流、索氏提取等)需要使用大量的提取溶剂(乙醇、甲醇和水等)、经过长时间的加热回流和去溶剂浓缩过程,占整个分析时间的90%以上,同时在提取过程中还存在热不稳定性成分流失的现象。因此,繁琐耗时的样品前处理过程是中药成分快速分析的瓶颈。近年来发展的新型提取方法,如超临界流体萃取法[1]、负压空化萃取法[2]、微波或超声辅助提取法[3]、机械化学辅助提取法[4]、可转换溶剂和离子液体提取法[5]等,旨在减少样品前处理过程中时间、能量和溶剂的消耗。另外,在样品的前处理过程中一般需要克级样品,这增加了微量样品的操作难度。因此,建立快速、简便、高效的样品前处理方法迫在眉睫。Ferreira等[6]提出了在线提取(online extraction, OLE)技术:通过将微量固体样品填入固相萃取小柱,与HPLC在线联用,无需额外的提取时间、溶剂消耗和提取设备,可实现样品的高效提取和分析。因此,在线提取技术可加快中药活性成分分析鉴定的进程,缩短研究周期。
高效液相色谱-二极管阵列检测-四极杆飞行时间质谱法(HPLC-DAD-QTOF-MS)被广泛应用于分析鉴定中药活性成分[7]。高分辨率质谱可提供准确的元素组成,为活性成分的定性分析提供了可靠的手段[8,9]。因此,OLE和HPLC-DAD-QTOF-MS在线联用可快速提取并分析鉴定中药中的活性成分。
黄酮类化合物具有抗氧化、抗炎、抗肿瘤、抗微生物等活性[10,11],广泛存在于柑橘属植物中[12]。陈皮(PericarpiumCitriReticulatae)是柑橘属植物橘及其栽培变种的干燥成熟果皮,具有理气健脾、燥湿化痰等功效。目前陈皮中黄酮类化合物的分析鉴定步骤主要为溶剂提取和基于HPLC-MS的主成分分析[13-17]。本文以陈皮为研究对象,建立了OLE-HPLC-DAD-QTOF-MS在线联用方法,快速分析鉴定出陈皮中24种黄酮类化合物,其中新圣草次苷、柠檬黄素-3-O-(3-羟基-3-甲基戊二酸)-葡萄糖苷及其异构体在陈皮中被首次报道。OLE方法与传统的溶剂回流提取法相比具有更高的提取效率。因此,OLE-HPLC-DAD-QTOF-MS在线联用方法为复杂样品的快速分析鉴定提供了新的可行手段,在中药样品快速真伪鉴别、定性定量分析、质量控制等方面具有广泛的应用前景。
1 实验部分
1.1 仪器、试剂与材料
Agilent 1200高效液相色谱系统(配有在线脱气机、四元泵、恒温柱温箱、手动进样阀和二极管阵列检测器)、6530 Accurate-Mass QTOF质谱仪(Agilent,美国); RE-2000A旋转蒸发仪(上海贤德仪器有限公司); KQ-500B超声波清洗器(昆山市超声仪器有限公司); CP224C万分之一电子天平(奥豪斯仪器(常州)有限公司); 400Y多功能粉碎机(永康市铂欧五金制品有限公司)。
甲醇和甲酸(色谱纯)均购自国药集团化学试剂有限公司; C18填料(500 μm)购自加拿大Silicycle公司;超纯水(18.2 MΩ5cm)由Milli-Q水净化系统(Millipore,美国)制备。圣草次苷、新圣草次苷、柚皮芸香苷、橙皮苷、橙皮素、橙黄酮、川陈皮素、3,5,6,7,8,3′,4′-七甲氧基黄酮和橘皮素均购自中药药品生物制品检定所(北京);陈皮购自康美药业有限公司(广东)。
1.2 OLE-HPLC-DAD-QTOF-MS分析
首先将陈皮样品置于粉碎机中粉碎10 min,得到粒径约为48~250 μm的陈皮粉末。在空的预柱芯(10 mm×4.6 mm)内填入一半体积的C18填料,然后装入2.0 mg粉碎的陈皮样品,再用C18填料填满,最后将装有样品的固相萃取柱连接于手动进样阀上(见图1)。在样品分析过程中,进样阀首先处于“Load”位置,使用0.1%(v/v)甲酸水-甲醇(75∶25, v/v)平衡Agilent ZORBAX SB-C18色谱柱(250 mm×4.6 mm, 5 μm, Agilent,美国),流速为0.7 mL/min,温度为25 ℃;将手动进样阀切换至“Inject”状态,使用0.1%(v/v)甲酸水(A)和甲醇(B)进行梯度洗脱(0~42 min, 25%B~95%B),检测波长为254 nm。

图 1 OLE-HPLC-QTOF-MS方法的流程图Fig. 1 Flow diagram of online extraction-high perform-ance liquid chromatography-diode array detection-quadrupole time-of-flight mass spectrometry (OLE-HPLC-DAD-QTOF-MS)
扫描模式为正离子扫描;扫描范围m/z100~1 200;毛细管电压3 500 V;干燥气温度350 ℃,流速10.0 L/min;鞘气温度350 ℃,流速12.0 L/min;雾化气压强241.3 kPa;毛细管出口电压180 V;碰撞电压40 eV。24种黄酮类化合物的其他质谱参数见表1。
2 结果与讨论
2.1 样品粒径的优化
本文研究了陈皮样品的粉碎粒径对OLE提取效率的影响。结果表明,普通粉碎样品(粒径48~250μm)和超微粉末(粒径<10μm)具有相同的提取效率,因此本工作统一使用普通粉碎(粒径48~250 μm)的粉末样品。
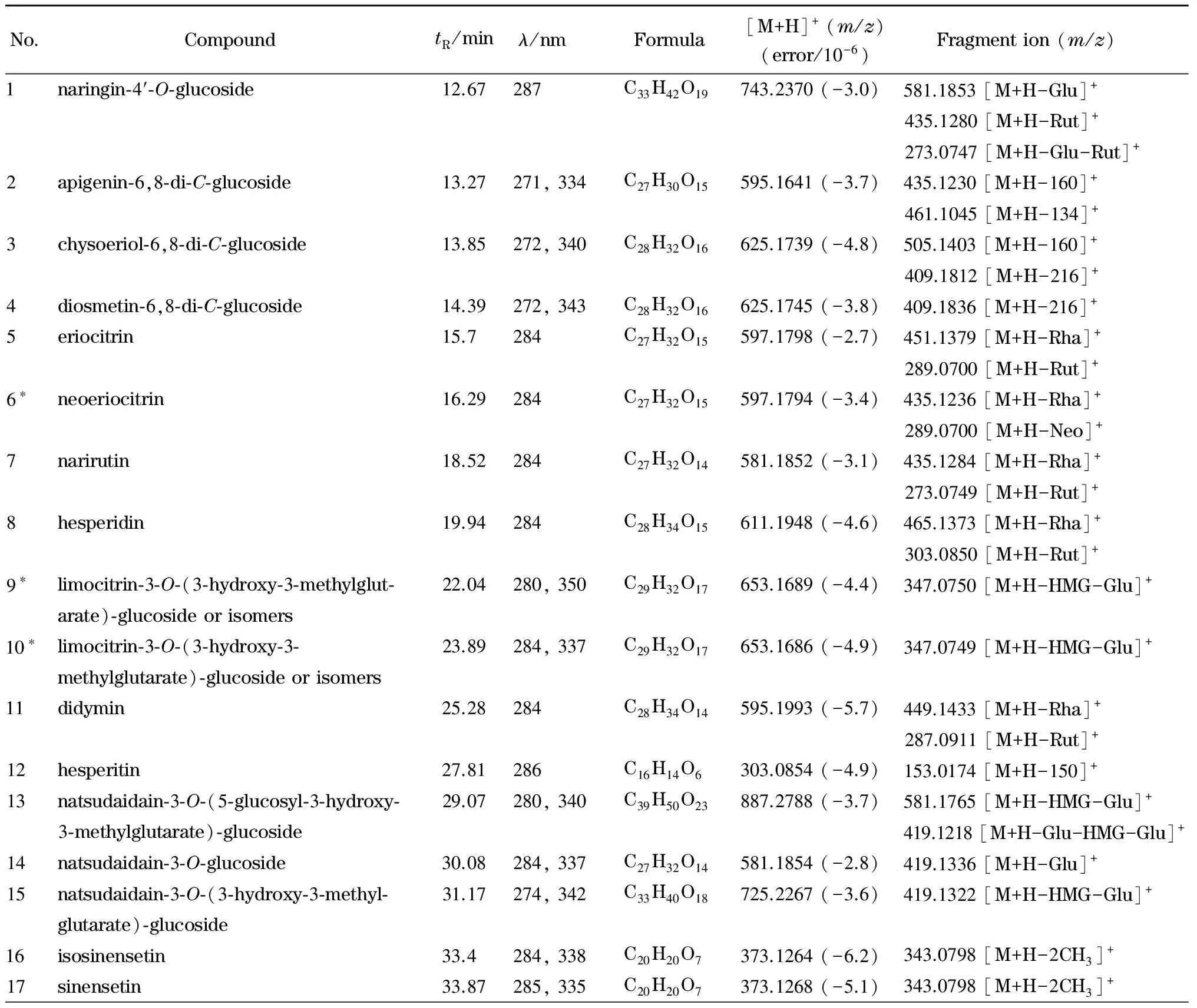
表 1 陈皮中24种黄酮类化合物的保留时间(tR)、紫外特征吸收波长(λ)、分子式和碎片离子Table 1 Retention times (tR), ultraviolet characteristic absorption wavelengths (λ), formulas and fragment ions of 24 identified flavonoid compounds in Pericarpium Citri Reticulatae

表 1 (续)Table 1 (Continued)
* The compound reported inPericarpiumCitriReticulataefor the first time. Glu: glucoide; Rut: rutinoside; Neo: neohesperidoside; Rha: rhamnoside; HMG: 3-hydroxy-3-methylglutarate.
2.2 流动相的选择
陈皮中的主要活性成分为黄酮类化合物,流动相中加入酸可以抑制色谱峰拖尾,提高分离效果。实验优化了流动相的组成及添加酸的种类,结果表明,以0.1%(v/v)甲酸水和甲醇为流动相进行梯度洗脱时各组分能达到较好的分离效果。
2.3 快速鉴定陈皮中的黄酮类化合物
QTOF-MS可精准提供化合物的分子量信息,将其与HPLC联用可实现复杂中药体系中活性成分的分离分析和鉴定。在对陈皮样品的分析中,各个成分在正离子模式下具有较高的灵敏度和较低的背景干扰,其色谱图见图2。

图 2 陈皮(2.0 mg)在正离子模式下的总离子流色谱图Fig. 2 Total ion current chromatogram of Pericarpium Citri Reticulatae (2.0 mg) in positive ion modeNos. 1-24 are the same as those in Table 1.
对图2中的24种化合物进行紫外检测,其紫外吸收谱图表明陈皮中主要包含三类黄酮类化合物:二氢黄酮、黄酮和黄酮醇。二氢黄酮在285 nm左右有一个较强的紫外吸收峰;黄酮和黄酮醇在240~270 nm和320~350 nm有两个较强的紫外吸收峰[18,19]。通过化合物的紫外吸收、分子离子峰、碎片离子信息以及参考文献对化合物进行结构鉴定,鉴定得到的化合物结构信息见图3。
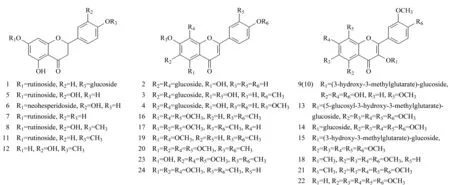
图 3 陈皮中鉴定到的24种黄酮类化合物的结构式Fig. 3 Structures of the 24 flavonoid compounds identified in Pericarpium Citri ReticulataeNos. 1-24 are the same as those in Table 1.
化合物1、5~8和11~12具有二氢黄酮的紫外吸收特征,在QTOF-MS谱图中,可以得到失去糖基后的碎片离子峰:m/z273、287、289和303,分别为柚皮素、异野樱素、圣草酚和橙皮素。糖基丢失的信息:[M+H-162]+为丢失的葡萄糖配基;[M+H-146]+为丢失的失鼠李糖配基;[M+H-308]+可能为丢失的芸香糖或新橙皮糖配基[20]。因此,通过进一步与标准品比对,化合物5~8确定为圣草次苷(5)、新圣草次苷(6)、柚皮芸香苷(7)和橙皮苷(8)。化合物12中丢失的m/z为150的碎片离子为黄酮C环跨环断裂产生的特征碎片,通过与标准品的保留时间、紫外特征吸收和碎片比对,化合物12鉴定为橙皮素。通过碎片分析和文献[21,22]对照,化合物1和11被依次鉴定为柚皮苷-4′-O-葡萄糖苷和香风草苷。化合物6新圣草次苷为首次从陈皮中分离得到。
化合物2~4、9~10和13~24在240~270 nm和320~350 nm处有两个较强的紫外吸收峰。化合物3和4具有相同的分子离子峰[M+H]+(m/z625)和子离子峰[M+H-120]+(m/z505)、[M+H-216]+(m/z409),表明化合物3和4为二碳糖苷[23]。通过文献[23]对比确定化合物3和4分别为金圣草黄素-6,8-二-C-葡萄糖苷和香叶木素-6,8-二-C葡萄糖苷。同理,推测化合物2为芹菜素-6,8-二-C-葡萄糖苷[24]。
化合物14、16~24中存在[M+H-2CH3]+的分子离子峰,表明其为多甲氧基黄酮类化合物[25]。通过与标准品的紫外谱图、保留时间以及质谱数据比对,化合物16~17、20~21、24分别确定为异橙黄酮(16)、橙黄酮(17)、川陈皮素(20)、3,5,6,7,8,3′,4′-七甲氧基黄酮(21)和橘皮素(24)。通过分子离子峰的精确分子量、碎片、保留时间和紫外吸收特征与文献[21,26]对比,鉴定化合物14、18、19、22和23依次为:柚皮黄素-3-O-葡萄糖苷(14)、3,5,6,7,3′,4′-六甲氧基黄酮(18)、四甲基-O-异黄芩素(19)、柚皮黄素(22)和5-羟基-6,7,8,3′,4′-五甲氧基黄酮(23)。
化合物9、10、13和15存在[M+H-144]+分子离子峰,是3-羟基-3-甲基戊二酸取代的黄酮类化合物[27]。化合物9和10具有相同的分子离子峰(m/z653),推测其为柠檬黄素-3-O-(3-羟基-3-甲基戊二酸)-葡萄糖苷及其异构体,该物质在桔叶[28]、枳实[21]中已有报道,在陈皮中为首次报道。同理,化合物13和15分别被鉴定为柚皮黄素-3-O-(5-葡萄糖苷-3-羟基-3-甲氧基戊二酸)-葡萄糖苷和柚皮黄素-3-O-(3-羟基-3-甲基戊二酸)-葡萄糖苷[21]。
共从陈皮中鉴定出24种黄酮类化合物:7种二氢黄酮,9种黄酮和8种黄酮醇,其中新圣草次苷、柠檬黄素-3-O-(3-羟基-3-甲基戊二酸)-葡萄糖苷及其异构体为首次在陈皮中报道。

图 4 不同提取方式下陈皮样品的色谱图Fig. 4 Chromatograms of Pericarpium Citri Reticulatae by different extraction methods a. reflux extraction (39.6 g/L); b. first OLE (2.0 mg); c. second sequential OLE (2.0 mg).
2.4 OLE-HPLC-DAD-QTOF-MS法可行性验证
本工作参照文献[8]用热回流法提取了陈皮粗提物。采用定量环手动注射进样法对粗提物溶液(39.6 g/L, 20 μL)进行HPLC分析,与用OLE-HPLC法对固体样品(2.0 mg)的分析结果进行比较。如图4所示,采用OLE法提取黄酮类化合物时的提取效率明显高于溶剂回流提取法;对上述同一陈皮样品(2.0 mg)进行二次提取,可以明显观察到其色谱图(见图4c)中几乎没有残留物质,因此证明一次梯度洗脱基本能提取完全。
为进一步阐明OLE的高提取效率,对陈皮中的两个主要成分柚皮芸香苷(7)和橙皮苷(8)进行外标法定量分析。在10~100.0 mg/L范围内两个物质均呈现良好的线性关系,线性相关系数(r)均大于0.99(见表2)。以3倍和10倍信噪比(S/N)计算两个物质的检出限(LOD)和定量限(LOQ),柚皮芸香苷和橙皮苷的检出限均为2.0 mg/L,定量限分别为6.0 mg/L(柚皮芸香苷)和5.0 mg/L(橙皮苷)。

表 2 柚皮芸香苷和橙皮苷的回归方程、相关系数、线性范围、检出限、定量限和含量Table 2 Regression equations, correlation coefficients (r), linear range, LODs, LOQs and contents of narirutin and hesperidin
y: peak area;x: mass concentration, mg/L.
对柚皮芸香苷和橙皮苷进行定量分析,计算出采用OLE法和回流提取法时其在陈皮中的含量,结果见表2。结果表明,OLE法对柚皮芸香苷和橙皮苷提取效率高于回流提取方法,可能是OLE-HPLC-DAD-QTOF-MS体系中的高压状态以及梯度溶剂提取的原因。
对陈皮固体(2.0 mg)进行平行3次的OLE-HPLC分析,鉴定得到的24种化合物峰面积的RSD均在5%以内,表明该方法具有很好的可重复性。
综上所述,OLE-HPLC-DAD-QTOF-MS法具有操作简便、提取效率高、样品用量少、重复性好等优势,剔除了传统复杂的样品前处理过程,在中药活性成分快速分析领域具有十分突出的优势。
3 结论
本文建立了OLE-HPLC-DAD-QTOF-MS法在线提取和分离鉴定陈皮中的黄酮类化合物。在线提取技术简单、快速,无需额外的溶剂、时间和设备用于陈皮样品的前处理,所需样品量少,且提取效率高于传统的溶剂回流提取法。方法最终鉴定出24种黄酮类化合物,其中新圣草次苷,柠檬黄素-3-O-(3-羟基-3-甲基戊二酸)-葡萄糖苷及其异构体在陈皮中首次被报道。该方法可以直接应用于快速提取和分离鉴定其他中药复杂体系中的活性成分。
参考文献:
[1]Liu J, Lin S Y, Wang Z Z, et al. Food Bioprod Process, 2011, 89(4): 333
[2]Wang X Q, Wei W, Zhao C J, et al. Sep Purif Technol, 2015, 156: 116
[3]Benitez-Villalba J C, Zafra-Gomez A, Dorival-Garcia N, et al. J Sep Sci, 2013, 36(16): 2635
[4]Wang M, Bi W T, Huang X H, et al. J Chromatogr A, 2016, 1449: 8
[5]Huie C W. Anal Bioanal Chem, 2002, 373(1/2): 23
[6]Ferreira V G, Leme G M, Cavalheiro A J, et al. Anal Chem, 2016, 88(17): 8421
[7]Blunder M, Orthaber A, Bauer R, et al. Food Chem, 2017, 218: 600
[8]Zhang S H, Hu X, Shi S Y, et al. Anal Bioanal Chem, 2016, 408(13): 3659
[9]Millan L, Sampedro M C, Sanchez A, et al. J Chromatogr A, 2016, 1454: 67
[10]Skerget M, Kotnik P, Hadolin M, et al. Food Chem, 2005, 89(2): 191
[11]Hu X R, Chou G X, Zhang C G. Phytochemistry, 2017, 143: 64
[12]Tripoli E, Guardia M L, Giammanco S, et al. Food Chem, 2007, 104(2): 466
[13]Ye X L, Song F Y, Fan G R, et al. Chinese Journal of Chromatography, 2015, 33(4): 423
叶晓岚, 宋粉云, 范国荣, 等. 色谱, 2015, 33(4): 423
[14]Sun Y S, Liu Z B, Wang J H, et al. Chinese Journal of Chromatography, 2009, 27(2): 244
孙印石, 刘政波, 王建华, 等. 色谱, 2009, 27(2): 244
[15]Zheng G D, Zhou P, Yang H, et al. Food Chem, 2013, 136(2): 604
[16]Ye X, Cao D, Song F, et al. Sep Sci Technol, 2016, 51(5): 807
[17]Liu E H, Zhao P, Duan L, et al. Food Chem, 2013, 141(4): 3977
[18]Gao Q, Ma R, Chen L, et al. Food Chem, 2017, 225: 55
[19]Anagnostopoulou M A, Kefalas P, Kokkalou E, et al. Biomed Chromatogr, 2005, 19(2): 138
[20]Mencherini T, Campone L, Piccinelli A L, et al. J Agric Food Chem, 2013, 61(8): 1686
[21]Wang S, Chen P, Jiang W, et al. J Chromatogr A, 2014, 1348: 105
[22]Lin Z, Wang H, Xu Y, et al. Food Chem, 2012, 134(2): 1181
[23]Geng P, Sun J, Zhang M, et al. J Mass Spectrom, 2016, 51(10): 914
[24]Roowi S, Crozier A. J Agric Food Chem, 2011, 59(22): 12217
[25]Zhang J Y, Zhang Q, Zhang H X, et al. J Agric Food Chem, 2012, 60(36): 9023
[26]Li S, Lo C Y, Ho C T, et al. J Agric Food Chem, 2006, 54(12): 4176
[27]Barreca D, Gattuso G, Lagana G, et al. Food Chem, 2016, 196: 619
[28]Fu Q, Zhang C, Lin Z, et al. Food Chem, 2016, 192: 250

