胰腺癌高表达抗原MUC4 CTL表位肽的体内免疫原性*
范柳笛,张 岩,时冉冉
(漯河医学高等专科学校医学生物工程重点实验室,河南 漯河 462002)
肿瘤疫苗可以诱导机体产生强有力的细胞免疫应答。T细胞介导的抗原特异性免疫识别是由人类白细胞抗原(human leukocyte antigen,HLA)Ⅰ类分子和Ⅱ类分子提呈的肿瘤相关抗原衍生肽激发的,自然杀伤细胞(natural killer cell,NK)介导的非抗原特异性免疫是由缺乏识别信号的自身HLAⅠ类分子激发的。尽管目前肿瘤疫苗的应用还存在一定的问题,但是临床试验结果表明接种了疫苗的肿瘤患者长期存活率和生活质量均得到改善[1]。
黏蛋白4(mucin 4,MUC4)在胰腺癌的发生发展中有重要的作用,并有望成为胰腺癌潜在特异性肿瘤分子标记物[2-4]。基于有关MUC4的HLA-A2限制性表位肽的前期研究发现,P1944、P1944-1Y2L、P2004和P2004-1Y9V 4条表位肽可在体外实验中诱导产生免疫应答[5],但在体内是否具有免疫原性还有待进一步研究。通用性Th表位是由13个氨基酸构成的,可以和主要组织相容性(抗原)复合物(major histocompability complex,MHC)Ⅱ类分子结合而刺激CD4+Th细胞增殖分化[6]。为了鉴定表位肽在体内是否能够诱导较强的免疫应答,以及进一步确定表位肽在体内抗原提呈的效果,本研究将来源于MUC4的HLA-A2限制性表位肽与弗氏不完全佐剂(incomplete Freund’s adjuvant,IFA)乳化后联合Th表位皮下免疫BALB/c小鼠,检测小鼠脾细胞对各表位肽特异性的细胞免疫应答情况,评估候选HLA-A2表位肽的体内免疫原性。
材 料 和 方 法
1 材料
T2A2细胞系和人胰腺癌细胞CAPAN-2(HLA-A2+,MUC4+)由漯河医学高等专科学校分子医学实验室常规保存,采用37 ℃、5% CO2、饱和湿度培养条件常规培养。6~8周龄BALB/c小鼠由南京大学南京生物医药研究院提供;HLA-A2限制性细胞毒性T淋巴细胞(cytotoxic lymphocyte,CTL)表位肽P1944(SMAEVNASV)、P1944-1Y2L(YLAEVNASV)、 P2004(FLNNQLLAA)、P2004-1Y9V(YLNNQLLAV)、对照肽HBcAg18-27(FLPSDFFPSV)和通用性Th表位由上海生工生物工程有限公司合成;IFA购自Sigma-Aldrich;鼠源干扰素γ(interferon-γ,IFN-γ) ELISPOT 试剂盒购自达科为生物技术有限公司。
2 方法
2.1效应CTL的体内诱导随机选取6~8周龄小鼠,雌雄随机分配。实验共设置PBS组、Th 表位组、P1944组、P1944-1Y2L组、P2004组和P2004-1Y9V组,共6组,每组5只。每组小鼠体内的注射剂量如下:(1)PBS组:PBS∶IFA=1∶1;(2)Th 表位组:PBS∶Th表位∶IFA=1∶1∶2;(3)实验组:PBS∶候选肽∶IFA=1∶1∶2。第1次免疫注射记为第0天,按照上面各个组分别进行皮下免疫注射,在第5天和第10天时进行第2次和第3次加强免疫;同时每次免疫注射前,对小鼠进行观察,记录体重。
2.2制备效应细胞将免疫后的小鼠于第11天脱颈处死,置于75%乙醇中,浸泡10 min消毒后,无菌条件下开腹腔取出脾脏,祛除脂肪和结缔组织放于200目不锈钢网筛中;培养皿中加入少量pH 7.2的PBS,并将200目钢网置于其上,用20 mL医用注射器内芯研磨,尽量研磨干净。PBS冲洗,移去筛网,培养皿中得脾细胞悬液(约10 mL),转移至无菌离心管中;1 000 r/min水平离心10min,弃上清,收集细胞;每管加入5 mL红细胞裂解液,轻轻吹打重悬细胞,4 ℃孵育15 min,裂解红细胞;1 000 r/min水平离心10min,弃上清,收集细胞。PBS洗涤2次;将脾细胞重悬于10 mL含10%胎牛血清的RPMI-1640培养基中。计数后将脾细胞悬液置于6孔板中培养,每孔5 mL;次日每孔加入250 U重组鼠源白细胞介素2(interleukin-2,IL-2)(Prospec)、β2-M(Merck)以及与相对应的多肽,37 ℃、5% CO2培养5 d,收获后作为效应细胞。
2.3ELISA法检测小鼠血清中IFN-γ的浓度在小鼠脱颈处死之前,用眼球取血的方法取各组免疫小鼠静脉血,室温静置2~4 h后,3 000 r/min离心10 min,取上层血清,标记后-80 ℃保存。将酶标板室温平衡0.5 h以上,每孔加入待测样品50 μL,每孔再加入50 μL HRP-conjugated,轻轻晃动混匀,37 ℃、5% CO2共孵育1 h,弃去液体,甩干,加满洗涤液,振荡30 min,弃去液体,用吸水纸重复拍干;每孔加入显色剂共100 μL,振荡混匀,37 ℃避光显色15 min,加入终止液 50 μL,在波长450 nm处测量各孔的吸光度(A)值[6]。
2.4ELISPOT法检测IFN-γ的分泌水平取出ELISPOT板条,加200 μL无血清的IMDM培养基进行封闭,静置10 min;以诱导的CTL作为效应细胞,荷肽的T2A2作为刺激细胞,细胞浓度均调整为2×109/L;设立对照孔和实验孔;37 ℃、5% CO2孵育18 h;倾尽孔中培养基,每孔加入200 μL无菌去离子水,4℃ 裂解细胞10 min;倾尽孔内液体,加入200 μL 1×Washing Buffer进行洗涤,洗涤6次,每次停留60 s;加入 100 μL生物素标记的抗体,37 ℃ 孵育1 h;倾尽孔内液体,加入200 μL 1×Washing Buffer进行洗涤,洗涤方法同上,在吸水纸上拍干;加入100 μL酶联亲和素,37 ℃ 孵育1 h;每孔加入200 μL 1×Washing Buffer进行洗涤,洗涤方法同上;加入100 μL现配的AEC显色液,25℃避光静置30 min;结束后置于通风处,室温静置干燥;结果用 ELISPOT 图像分析仪对96 孔板中每孔的斑点数进行计数[7]。
2.5细胞毒活性检测调整CTL浓度为5×109/L;调整靶细胞CAPAN-2浓度为1×108/L;按50∶1、25∶1和12.5∶1的不同效靶比铺于96孔板中,同时设立效应细胞自发释放组、靶细胞自发释放组、靶细胞最大释放组、体积校正组和背景对照组,每孔终体积为100 μL。37 ℃、5% CO2培养4 h。于孵育结束前45 min,在靶细胞最大释放组及体积校正组中加入10 μL裂解液。1 000 r/min离心4 min,转移50 μL上清至另一干净96孔板中,每孔加入50 μL底物混合液,室温避光孵育30 min;每孔再加入50 μL终止液。用酶标仪检测其在490 nm波长处的吸光度值。杀伤率(%)=(实验孔A值-效应细胞自发释放A值-CTL自发释放A值)/(靶细胞A值-效应细胞自发释放A值)×100%[8]。
2.6流式细胞术检测胞内因子免疫小鼠后,将5×109/L脾细胞重悬于含10%胎牛血清的RPMI-1640培养基中,加入10 mg/L 的单表位多肽,培养7 d。培养结束后,收获细胞,PBS洗涤3次,加入终浓度为10 mg/L的布雷菲德菌素A(Brefeldin A,BFA,购自Biolegend),于37 ℃、5% CO2培养箱中培养6 h。培养结束后,PBS洗涤细胞,加4%多聚甲醛于4 ℃固定细胞20 min,PBS洗涤细胞,0.1%皂素(破膜剂)室温处理细胞10 min,PBS洗涤细胞。加入FITC标记的小鼠CD8抗体(1∶200稀释),PE标记抗小鼠IFN-γ流式单克隆抗体(均购自BD),4 ℃避光孵育30 min,PBS洗2遍,离心弃上清,PBS重悬细胞,流式仪检测。
3 统计学处理
实验数据用均数±标准差(mean±SD)表示,采用单因素方差分析检验多组均数之间的差异,以P<0.05为差异有统计学意义。统计图由GraphPad Prism 5.0软件绘制。
结 果
1 ELISA法检测候选肽免疫小鼠后IFN-γ的分泌水平
将接受尾根部皮下注射免疫刺激小鼠脾淋巴细胞进行培养,以相应的候选肽作为刺激物,对各组分离的淋巴细胞进行刺激,小鼠眼球取血获得的血清,用ELISA法检测血清中IFN-γ的分泌量,结果示,P1944 、P1944-1Y2L、P2004和P2004-1Y9V在小鼠体内均可显著增强IFN-γ的分泌量,且P1944-1Y2L和P2004-1Y9V在小鼠体内分泌IFN-γ的水平略高于原肽(P<0.05),见图1。
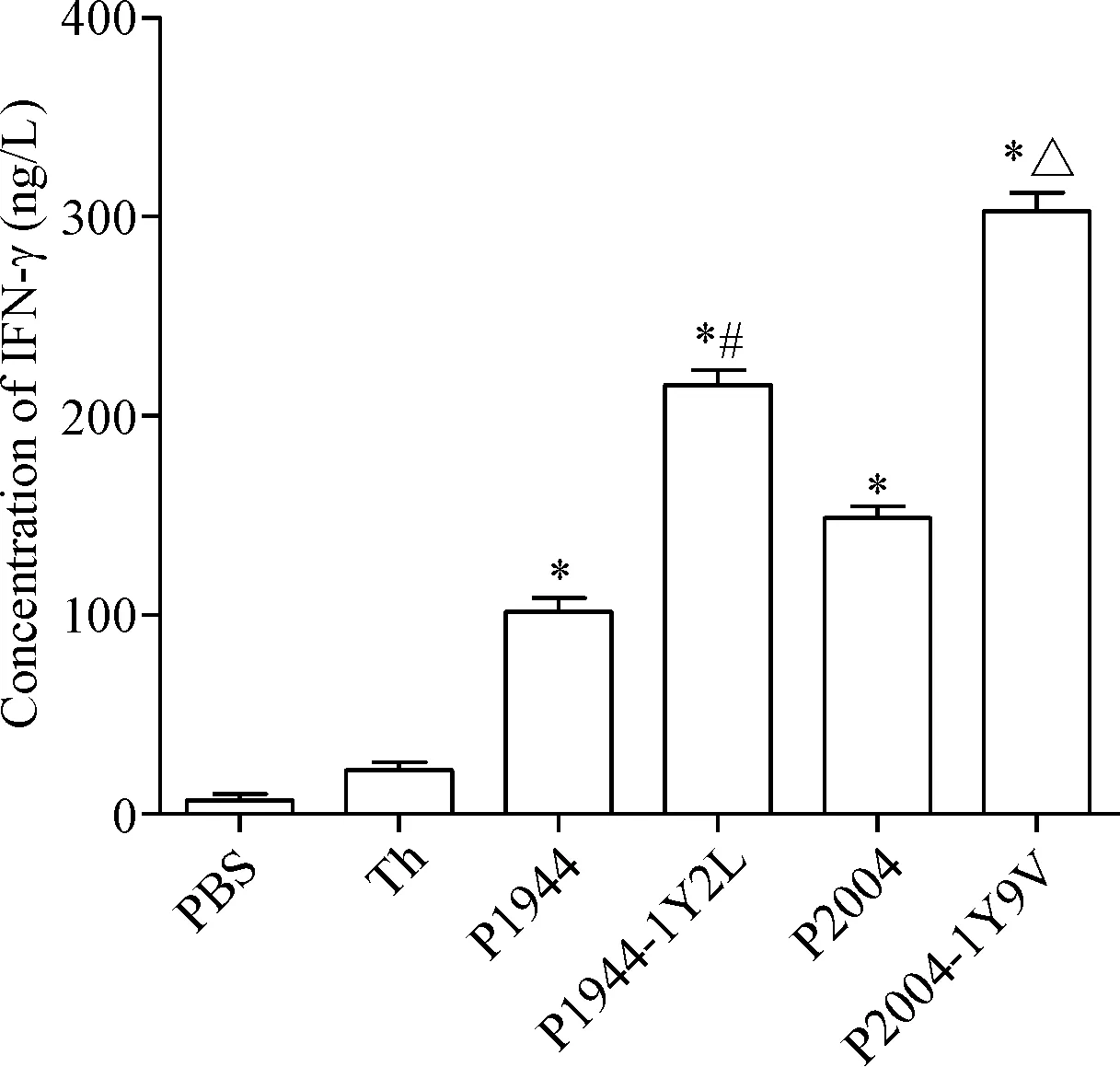
Figure 1.IFN-γ release by CTLs generated from immunized BALB/c mice.Mean±SD.n=5.*P<0.05vsPBS group;#P<0.05vsP1944 group;△P<0.05vsP2004 group.
图1ELISA法检测候选肽在小鼠体内特异性CTL分泌IFN-γ的能力
2 ELISPOT法检测候选肽免疫小鼠后IFN-γ的分泌水平
HLA-A2限制性表位肽分别免疫小鼠的结果表明,与原肽组比较,P1944-1Y2L和 P2004-1Y9V免疫产生特异性分泌IFN-γ的细胞频数较高(P<0.05),诱导的细胞应答较强,体内免疫原性较强,P1944和P2004也可诱导特异性的细胞免疫应答,但是分泌IFN-γ的细胞频数较低,见图2。

Figure 2.IFN-γ release by CTLs generated from immunized BALB/c mice measured by ELISPOT assay.Mean±SD.n=5.*P<0.05vsPBS group;#P<0.05vsP1944 group;△P<0.05vsP2004 group.
图2ELISPOT法检测候选肽在小鼠体内特异性CTL分泌IFN-γ的能力
3 候选肽免疫小鼠产生特异性CTL的检测
以胰腺癌细胞CAPAN-2(HLA-A2+,MUC4+)作为靶细胞,将已免疫小鼠的脾淋巴细胞进行分离,进一步研究候选表位肽能否在小鼠体内被正常加工和递呈并且诱导出特异性的CTL。结果示,P2004和 P2004-1Y9V在效靶比为50∶1时对靶细胞CAPAN-2(HLA-A2+,MUC4+)的杀伤效率分别为26.6%和39.6%,说明P2004和 P2004-1Y9V诱导产生的CTL可以对CAPAN-2显示出较强的细胞毒活性;同时,对靶细胞CAPAN-2未显示出杀伤活性说明了P2004和P2004-1Y9V诱导的特异性CTL杀伤靶细胞具有HLA-A2限制性,见图3。

Figure 3.Specific lysis of cancer cell lines by the CTLs generated from immunized BALB/c mice.LDH cytotoxicity assay was used to evaluate the lysis of CAPAN-2(HLA-A2+,MUC4+)cells (A) and CAPAN-2 cells (B) on which the surface HLA-A2 molecules were blocked by anti-HLA-A2 mAb.Mean±SD.n=5.*P<0.05vsPBS group;▲P<0.05vsP2004 group.
图3候选肽特异性CTL的体内细胞毒实验结果
4 胞内因子染色法检测小鼠体内产生特异性的CD8+ T细胞
胞内因子染色法检测候选肽体内免疫刺激后IFN-γ的分泌水平。流式细胞术结果进一步证实,P2004和P2004-1Y9V候选肽免疫小鼠可诱导产生特异性的CD8+T细胞。以空载T2A2和荷肽T2A2作为靶细胞。结果显示,P2004和P2004-1Y9V均能分泌较多的IFN-γ,而P2004-1Y9V多肽疫苗比P2004能分泌更多的IFN-γ(P<0.05),见图4。
5 各实验组小鼠的体重变化
在小鼠体内实验期间,各实验组小鼠的体重与阴性对照组相比均没有显著差异。说明表位疫苗对小鼠体重没有明显的影响,见图5。
讨 论
肿瘤免疫治疗的最佳方式是以切除的原发肿瘤对患者进行免疫,这样在任何部位、任何时间的复发均可被识别、记忆以及消灭。由于需要免疫效应细胞对抗原进行特异性识别,所以在这种情况下记忆效应比较重要[9]。理论上,B淋巴细胞与抗体发生反应,而T淋巴细胞则通过肿瘤特异性细胞介导的应答来发挥作用[10-12]。肿瘤疫苗最大的优势是通过诱发机体全身性抗肿瘤的主动特异性免疫并形成免疫记忆,监测肿瘤的复发,产生有效而持久的抗肿瘤作用,从而有效地治疗肿瘤,并预防复发和转移[13]。肿瘤疫苗必须具有克服免疫耐受的特性才能维持CTL的特异性和亲合力。改造肽可以增强HLA结合能力和TCR信号转导,比同源野生型表位更能有效地打破免疫耐受。表位肽中氨基酸的取代能更有效地诱导特异性CTL[14-15]。研究表明,在一些肿瘤抗原如GP2、NY-ESO-1、gp100、HER-2/neu、p53和Hsp60以及MART-1中替换了MHC锚定残基处的氨基酸,明显提高了CTL表位的免疫原性[15-20]。

Figure 4.The splenocytes from peptide vaccinated mice were pooled and restimulated with peptide for 1 week.The restimulated splenocytes were then stained with IFN-γ and CD8+.The number in the figure represented the percentage of IFN-γ positive cells among CD8+T cells.Mean±SD.n=5.*P<0.05vsPBS group;▲P<0.05vsP2004 group.
图4胞内因子染色法检测候选表位肽体内诱导CTL分泌IFN-γ的能力

Figure 5.The BALB/c mice were immunized with peptide emulsified on days 0,5 and 10.The changes of the body weight on these days were recorded.Mean±SD.n=5.
图5各组小鼠体重的变化
我们前期对肿瘤抗原MUC4的HLA-A2限制性表位肽的体外实验研究发现了4条有潜力的表位肽:P1944、P1944-1Y2L、P2004和P2004-1Y9V[5],这些表位肽是否具有临床疫苗应用的潜力,需要对其体内免疫原性进行研究评估。
本研究将使用BALB/c小鼠进行表位肽的体内免疫原性研究[21-23]。在我们的研究中将HLA-A2限制性表位肽和通用Th表位与弗氏不完全佐剂进行乳化,并且连续皮下给予免疫,结果证实体外实验研究发现的来源于MUC4的4条HLA-A2限制性表位肽中,P2004和P2004-1Y9V的体内免疫原性最强。野生型肽P2004及其类似物P2004-1Y9V能够在体内诱导特异性CTL。P2004-1Y9V诱导的特异性CTL可以识别人肿瘤细胞上的内源肽,表明在这些小鼠中培养的T细胞能够识别与天然HLA-A2分子结合的肽。经改造过的P2004-1Y9V表位肽比原肽P2004能分泌更多的IFN-γ,P2004和P2004-1Y9V是否具有抗肿瘤的作用,要通过小鼠荷瘤模型来验证,这就需要我们在接下来的研究中构建稳定表达MUC4和HLA-A2的肿瘤细胞株,进而研究表位肽P2004-1Y9V的抗肿瘤作用。
以上结果表明,来源于MUC4的HLA-A2限制性表位肽P2004-1Y9V具有较强的体内免疫原性,能够在体内被抗原提呈细胞所提呈,经提呈的肽/HLA 复合物可以被存在于 CTL 表面的 TCR 所识别,进而产生针对MUC4的细胞免疫途径,从而产生对胰腺癌细胞的杀伤作用。鉴定出的新CTL优势表位为研制基于MUC4抗原的肿瘤疫苗提供了理论基础[24-25],并为胰腺癌的多表位疫苗设计和免疫治疗提供新的候选表位。
[参考文献]
[1]Alberts DS,Liu PY,Wilczynski SP,et al.Phase II trial of imatinib mesylate in recurrent,biomarker positive,ovarian cancer (Southwest Oncology Group Protocol S0211) [J].Int J Gynecol Cancer,2007,17(4):784-788.
[2]Singh AP,Chaturvedi P,Batra SK.Emerging roles of MUC4 in cancer:a novel target for diagnosis and therapy[J].Cancer Res,2007,67(2):433-436.
[3]Carraway KL,Theodoropoulos G,Kozloski GA,et al.Muc4/MUC4 functions and regulation in cancer[J].Future Oncol,2009,5(10):1631-1640.
[4]Gautam SK,Kumar S,Cannon A,et al.MUC4 mucin-a therapeutic target for pancreatic ductal adenocarcinoma[J].Expert Opin Ther Targets,2017,21(7):657-669.
[5]范柳笛,刘辉,袁磊,等.胰腺癌高表达抗原MUC4 CTL表位肽的筛选与改造[J].中国病理生理杂志,2017,33(5):811-816.
[6]Shi RR,Liu J,Zou Z,et al.The immunogenicity of a novel cytotoxic T lymphocyte epitope from tumor antigen PL2L60 could be enhanced by 4-chlorophenylalanine substitution at position 1[J].Cancer Immunol Immunother,2013,62(11):1723-1732.
[7]Pardy RD,Rajah MM,Condotta SA,et al.Analysis of the T cell response to Zika virus and identification of a novel CD8+T cell epitope in immunocompetent mice[J].PLoS Pathog,2017,13(2):e1006184.
[8]Peng S,Mattox A,Best SR,et al.Identification of the murine H-2Dband human HLA-A*0201 MHC class I-restricted HPV6 E7-specific cytotoxic T lymphocyte epitopes[J].Cancer Immunol Immunother,2016,65(3):261-271.
[9]Bethune MT,Joglekar AV.Personalized T cell-mediated cancer immunotherapy:progress and challenges[J].Curr Opin Biotechnol,2017,48:142-152.
[10] Hirbod-Mobarakeh A,Gordan HA,Zahiri Z,et al.Specific immunotherapy in renal cancer:a systematic review[J].Ther Adv Urol,2017,9(2):45-58.
[11] Khong H,Overwijk WW.Adjuvants for peptide-based cancer vaccines[J].J Immunother Cancer,2016,4:56.
[12] Tsukahara T,Hirohashi Y,Kanaseki T,et al.Peptide vaccination therapy:Towards the next generation[J].Pathol Int,2016,66(10):547-553.
[13] Weller M,Roth P,Preusser M,et al.Vaccine-based immunotherapeutic approaches to gliomas and beyond[J].Nat Rev Neurol,2017,13(6):363-374.
[14] Li F,Yang D,Wang Y,et al.Identification and modification of an HLA-A*0201-restricted cytotoxic T lymphocyte epitope from Ran antigen[J].Cancer Immunol Immunother,2009,58(12):2039-2049.
[15] Mimura K,Kono K,Southwood S,et al.Substitution analog peptide derived from HER-2 can efficiently induce HER-2-specific,HLA-A24 restricted CTLs[J].Cancer Immunol Immunother,2006,55(11):1358-1366.
[16] Parkhurst MR,Salgaller ML,Southwood S,et al.Improved induction of melanoma-reactive CTL with peptides from the melanoma antigen gp100 modified at HLA-A*0201-binding residues[J].J Immunol,1996,157(6):2539-2548.
[17] Valmori D,Fonteneau JF,Lizana CM,et al.Enhanced generation of specific tumor-reactive CTLinvitroby selected Melan-A/MART-1 immunodominant peptide analogues[J].J Immunol,1998,160(4):1750-1758.
[18] Walker EB,Miller W,Haley D,et al.Characterization of the class I-restricted gp100 melanoma peptide-stimulated primary immune response in tumor-free vaccine-draining lymph nodes and peripheral blood[J].Clin Cancer Res,2009,15(7):2541-2551.
[19] Walker EB,Haley D,Petrausch U,et al.Phenotype and functional characterization of long-term gp100-specific memory CD8+T cells in disease-free melanoma patients before and after boosting immunization[J].Clin Cancer Res,2008,14(16):5270-5283.
[20] Dominguez Mdel C,Lorenzo N,Barbera A,et al.An altered peptide ligand corresponding to a novel epitope from heat-shock protein 60 induces regulatory T cells and suppresses pathogenic response in an animal model of ad-juvant-induced arthritis[J].Autoimmunity,2011,44(6):471-482.
[21] Firat H,Garcia-Pons F,Tourdot S,et al.H-2 class I knockout,HLA-A2.1-transgenic mice:a versatile animal model for preclinical evaluation of antitumor immunotherapeutic strategies[J].Eur J Immunol,1999,29(10):3112-3121.
[22] Rangan L,Galaine J,Boidot R,et al.Identification of a novel PD-L1 positive solid tumor transplantable in HLA-A*0201/DRB1*0101 transgenic mice[J].Oncotarget,2017,8(30):48959-48971.
[23] Srivastava R,Khan AA,Garg S,et al.Human asymptomatic epitopes identified from the herpes simplex virus te-gument protein VP13/14 (UL47) preferentially recall polyfunctional effector memory CD44highCD62LlowCD8+TEMcells and protect humanized HLA-A*02:01 transge-nic mice against ocular herpesvirus infection[J].J Virol,2017,91(2):e01793-16.
[24] 时冉冉,李伯和,袁磊,等.肿瘤抗原PIWIL2的HLA-A2限制性CTL表位鉴定[J].中国病理生理杂志,2015,31(7):1315-1319.
[25] 袁磊,李伯和,时冉冉,等.沉默JAG1基因对人乳腺癌MDA-MB-231细胞增殖和凋亡的影响[J].中国病理生理杂志,2014,30(2):262-267.

