自噬在熊果酸抑制人肺癌PC9细胞增殖中的作用
罗 敏,吴爱祥,郑林龙,邵中一
(宁波市鄞州人民医院药剂科,浙江 宁波 315040)
自噬(autophagy)现象在近十年来越来越受到重视,它在疾病演变过程中具有促进同时也具有抑制的双相作用。研究表明,抗肿瘤药物可以不同程度引起肿瘤细胞自噬,抑制自噬可以提高抗肿瘤药物对肿瘤细胞增殖的抑制作用,使肿瘤细胞对抗肿瘤药物的敏感性增加[1]。近年来环境污染严重,我国肺癌的死亡率呈逐年上升趋势,并且低龄化趋势也越来越明显,肺癌已经成为我国恶性肿瘤的第一位死亡原因[2]。熊果酸(ursolic acid,UA)是广泛存在于自然界中的五环三萜类单体化合物,具有广泛的生物学活性,包括抗炎、抗病毒、调节免疫和保肝等作用[3]。近年来有研究表明,熊果酸可抑制恶性肿瘤细胞增殖、诱导肿瘤细胞凋亡、抗肿瘤侵袭和抗氧化等多种作用,其抗肿瘤生物活性日益受到人们重视,但其具体抗肿瘤机制仍有待研究。熊果酸在肺癌中的抗肿瘤作用是否与诱导自噬相关尚不清楚。本实验通过体外研究观察熊果酸对非小细胞肺癌(non-small cell lung cancer,NSCLC)PC9细胞自噬的作用,检测反映细胞自噬现象和细胞内自噬泡数量变化的自噬标志分子LC3Ⅱ的含量[4],并在此基础上探讨自噬的功能,进一步明确熊果酸抗肿瘤作用机制,为熊果酸用于肺癌治疗提供实验依据。
材 料 和 方 法
1 细胞、主要试剂与仪器
PC9细胞购自中国科学院上海细胞所。UA、DMSO、自噬抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA)、自噬诱导剂雷帕霉素(rapamycin)和吖啶橙(acridine orange,AO)购自Sigma;胎牛血清购自Gibco;胰蛋白酶和RPMI-1640培养基购自吉诺生物医药技术有限公司;MTT购于碧云天生物公司;抗GAPDH、LC3和ATG5抗体购自Cell Signaling Technology。倒置荧光显微镜(Leica);凝胶成像系统(上海培清科技有限公司);CO2恒温培养箱(Thermo Forma);iMARK型全自动酶标仪(Bio-Rad)。
2 方法
2.1细胞培养PC9细胞于含10%胎牛血清的RPMI-1640培养液中培养,置于37 ℃、5% CO2、饱和湿度培养箱中。细胞贴壁生长良好,每3 d传代1次。取对数生长期的细胞进行实验。
2.2MTT实验检测细胞活力取对数生长期细胞以5.0×107/L的密度接种于96孔细胞培养板中,每孔100 μL,置于37 ℃、5% CO2、饱和湿度培养箱中培养24 h,待细胞贴壁后,加入不同浓度的UA作用,于培养箱中培养一定时间后,每孔加入20 μL MTT(2 g/L),继续孵育4 h后,终止培养。吸去培养液,每孔加DMSO 150 μL,在酶标仪490 nm波长处测定各孔吸光度(A)。每个浓度设平行重复6孔,重复实验3次。按以下公式计算细胞存活率,细胞存活率(%)=实验组A值/对照组A值×100%。
2.3台盼蓝染色活细胞计数于24孔板中接种肺癌PC9细胞,置于37 ℃、5% CO2、饱和湿度培养箱中培养24 h,待细胞贴壁后,加入相应的药物作用,0.25%胰酶消化,用0.04%台盼蓝分别对各作用组细胞进行染色,显微镜下计数活细胞数(其中着色细胞为死细胞),每个样品计数3次。
2.4吖啶橙染色收集对数期细胞,调整细胞悬液浓度,将细胞接种于24孔板,37 ℃、5% CO2孵育培养,分别加入不同浓度的UA及雷帕霉素,各组药物作用于肺癌PC9细胞24 h后,吸尽旧培养液,用PBS缓冲液清洗3遍,加入终浓度为1 mg/L的吖啶橙溶液,避光染色15 min,弃去吖啶橙溶液,用PBS缓冲液清洗3遍,在倒置荧光显微镜下观察细胞形态,吖啶橙可将胞质内酸性自噬泡染成红色。实验重复3次。
2.5Western blot法检测相关蛋白表达取对数生长期的肺癌PC9细胞接种于6孔板,培养24 h,加入各种药物处理。收集各组细胞,提取总蛋白,BCA蛋白定量法测定蛋白浓度定量。经 SDS-PAGE 分离后,将蛋白转移至PVDF膜上,用含5% BSA的PBST封闭1 h,分别加入对应 I 抗4 ℃孵育过夜,TBST洗膜后,加入对应 Ⅱ 抗室温摇床孵育2 h,TBST洗膜3次,ECL发光试剂盒显色,采用化学发光成像系统进行曝光采图,从而进行半定量分析。
3 统计学处理
应用SPSS 17.0统计软件进行数据分析。所有实验均重复3次,实验数据用均数±标准差(mean±SD)表示,多组间比较应用单因素方差分析,组间两两比较应用SNK-q检验,以P<0.05表示差异有统计学意义。
结 果
1 熊果酸抑制肺癌PC9细胞的活力
MTT实验结果显示,在不同浓度的UA作用后,肺癌PC9细胞的生长抑制率随着药物浓度的升高和时间的延长而增加(P<0.05或P<0.01),见图1。在给药24 h后,UA的IC50为29.07 μmol/L;在给药48 h后,UA的IC50为20.77 μmol/L;在给药72 h后,UA的IC50为14.84 μmol/L。上述结果表明,UA对肺癌PC9细胞具有抑制作用,见图1。

Figure 1.The effects of ursolic acid on the viability of PC9 cells.Mean±SD.n=3.*P<0.05,**P<0.01vs0 μmol/L group.
图1不同浓度的熊果酸对肺癌PC9细胞活力的影响
2 熊果酸诱导肺癌PC9细胞自噬
2.1吖啶橙染色观察熊果酸作用肺癌PC9细胞后自噬囊泡的变化与空白对照(control)组相比,雷帕霉素(100 nmol/L)阳性对照组的胞质内酸性自噬泡明显染成红色,提示自噬水平增加;与control组相比,UA作用于肺癌PC9细胞24 h后细胞内酸性滤泡染成亮红色荧光比例增多,其中以UA 10和20 μmol/L浓度较为明显(P<0.01),见图2。因此,后续实验选择10和20 μmol/L作为UA的实验浓度。
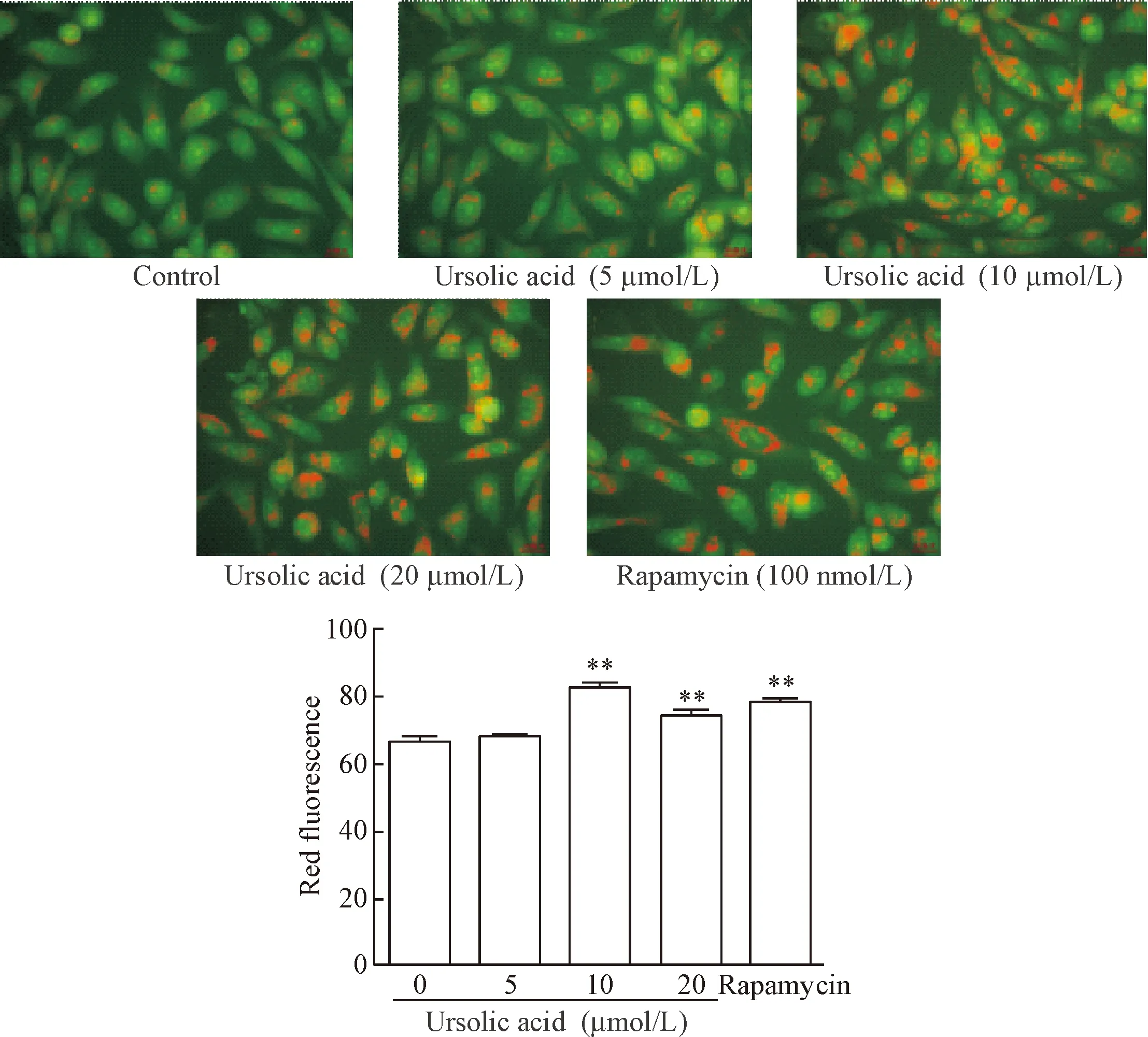
Figure 2.The change of autophagy vesicles in the PC9 cells after treated with ursolic acid (×400).Mean±SD.n=3.**P<0.01vs0 μmol/L group.
图2不同浓度的熊果酸对肺癌PC9细胞自噬的影响
2.2熊果酸对肺癌PC9细胞LC3蛋白表达的影响Western blot结果显示,UA作用于肺癌PC9细胞24 h后,与对照组相比,UA 10和20 μmol/L组的LC3-Ⅱ蛋白表达水平均升高,差异具有统计学显著性(P<0.01),说明UA诱导肺癌PC9细胞发生自噬,见图3。

Figure 3.The protein levels of LC3-Ⅰ and LC3-Ⅱin the lung cancer PC9 cells treated with ursolic acid.Mean±SD.n=3.**P<0.01vs0 μmol/L group.
图3熊果酸诱导肺癌PC9细胞LC3的表达
2.3熊果酸对肺癌PC9细胞自噬相关蛋白ATG5表达的影响Western blot结果显示,UA作用肺癌PC9细胞24 h后,与对照组相比,UA 10和20 μmol/L组的ATG5蛋白水平升高,差异具有统计学显著性(P<0.01),提示UA诱导自噬可能与上调自噬相关蛋白ATG5的表达有关,见图4。

Figure 4.The protein level of ATG5 in the lung cancer PC9 cells treated with ursolic acid.Mean±SD.n=3.**P<0.01vs0 μmol/L group.
图4熊果酸诱导肺癌PC9细胞ATG5的表达
3 抑制自噬可提高熊果酸对肺癌细胞的增殖抑制作用
在加入UA前1 h加入特异性的自噬抑制剂3-MA抑制自噬的发生,观察UA抑制肺癌PC9细胞增殖能力的变化。Western blot 实验结果表明,与UA 10 μmol/L组相比,UA 10 μmol/L联合3-MA组的LC3-Ⅱ蛋白表达水平下降,差异具有统计学显著性(P<0.01);与UA 20 μmol/L组相比,UA 20 μmol/L联合3-MA组的LC3-Ⅱ蛋白表达水平也下降,差异具有统计学显著性(P<0.01),说明3-MA减弱了UA诱导肺癌PC9细胞的自噬水平,见图5A。MTT实验结果表明,3-MA促进了UA对肺癌PC9细胞生长的抑制作用(P<0.01),见图5B。台盼蓝染色计算存活细胞的数目,结果显示3-MA联合UA作用组存活细胞数目明显减少,较UA作用组比较差异有统计学显著性(P<0.01),见图5C。上述说明3-MA联合UA作用能提高UA对肺癌细胞的增殖抑制作用。

Figure 5.Inhibition of autophagy facilitated the inhibitory effect of ursolic acid (UA) on the proliferation of PC9 cells.A:LC3 protein levels detected by Western blot; B:cell viability detected by MTT assay; C:viable cell number determined by Trypan blue exclusion test.Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsUA (10 μmol/L) group;&&P<0.01vsUA (20 μmol/L) group.
图5抑制自噬促进熊果酸对PC9细胞增殖的抑制作用
讨 论
肺癌居全球范围内肿瘤死因之首,其中非小细胞肺癌占80%~85%[2]。在我国随着环境的恶化,肺癌的死亡率已居恶性肿瘤的第一位。化疗目前是肺癌最有效的治疗方法之一,然而传统的肺癌化疗药物常因其各种严重的副作用使得其临床应用受到很大限制。即使目前分子靶向治疗的出现,非小细胞肺癌患者的5年存活率仍低于40%[5]。 因此寻找治疗肺癌的新方法及新策略成为医药界的一个重要课题。熊果酸是广泛存在于自然界中的五环三萜类化合物,具有广泛的生物学活性,包括抗肿瘤、抗炎、抗病毒、保肝和调节免疫功能等作用,且毒副作用较小。熊果酸的抗肿瘤主要通过诱导细胞凋亡、 抑制肿瘤细胞增殖、抑制肿瘤组织血管生成、抑制肿瘤侵袭和转移并干扰肿瘤微坏境等[6]。王文静等[7]研究发现熊果酸可抑制卵巢癌干细胞荷瘤裸鼠的瘤体生长,并通过下调耐药指标ABCG2,促进细胞凋亡,提高顺铂诱导的细胞凋亡来达到逆转耐药的作用。
自噬是真核生物中普遍存在的现象,越来越受到人们的关注,肿瘤研究者发现调节自噬可参与肿瘤的治疗,自噬与肿瘤的关系较为复杂,既存在抑制作用,又存在着一定的保护作用。在自噬发生的早期,自噬可作为一种保护机制,使肿瘤细胞避免受到低营养电离辐射和化疗等所致的损伤而持续生存;而当外部环境较差,肿瘤细胞过度自我吞噬时,就会引起自噬性死亡,从而抑制肿瘤的发生发展。自噬激活过度时则会引起肿瘤细胞发生自噬性死亡,自噬对肿瘤的生长起到一定的抑制作用。在本研究中,我们观察发现,经UA处理后,PC9细胞内酸性滤泡染成亮红色荧光比例增多,与文献中描述的自噬过程一致。细胞中LC3-Ⅱ的含量与细胞内自噬泡的数量呈正相关,可以反映细胞的自噬现象和细胞内自噬泡的多少,是研究自噬现象的标志分子[8-10]。本实验结果显示,经UA处理的肺癌PC9细胞与对照组相比,细胞中LC3-Ⅱ蛋白表达增多,自噬相关蛋白ATG5表达也增加,说明自噬在UA抑制肺癌PC9细胞增殖的过程中被激活。但是我们并不清楚自噬激活在这一过程中对肿瘤细胞是起促进作用还是抑制作用。为说明这一问题,我们使用自噬抑制剂3-MA。研究发现,3-MA与抗肿瘤药物联合应用,可增强肿瘤细胞敏感性。例如,3-MA抑制自噬提高了结肠癌5-FU的化疗效果[11];Liang等[12]研究发现,抑制自噬会增加卵巢癌细胞化疗的敏感性。Fukuda等[13]观察到自噬抑制增强白藜芦醇诱导的子宫内膜癌细胞凋亡;Fei等[14]的研究也发现,通过对自噬的抑制作用可增强PF-04691502对肺癌细胞凋亡和DNA损伤。本实验结果也显示,与UA单独作用组相比,UA联合自噬抑制剂3-MA组的LC3-Ⅱ蛋白表达水平显著下降,说明3-MA能减弱由UA诱导的肺癌PC9细胞的自噬水平。同时MTT法检测结果表明,自噬抑制剂3-MA提高了UA对肺癌PC9细胞的增殖抑制作用。这表明自噬活化导致肺癌PC9细胞对UA的敏感性降低,抑制自噬使得UA对肺癌细胞的抑制作用增加。这与现有的研究相一致,大多数研究认为抑制自噬可以提高肿瘤细胞对抗肿瘤治疗的敏感性,增加对肿瘤细胞的增殖抑制作用。
总之,UA可以诱导肺癌细胞自噬发生,其可能依赖于ATG5细胞自噬途径。自噬活化使得肺癌细胞对UA的敏感性降低,抑制自噬可以提高UA对肺癌细胞的抑制作用。UA诱导自噬的分子机制及抑制自噬提高UA的抗肿瘤作用是否与促进凋亡相关尚需进一步研究。
[参考文献]
[1]赵大海,陆友金.抑制自噬促进培美曲塞对 A549 细胞的增殖抑制作用[J].中国药理学通报,2015,31(5):664-668.
[2]You L,Shou J,Deng D,et al.Crizotinib induces auto-phagy through inhibition of the STAT3 pathway in multiple lung cancer cell lines[J].Oncotarget,2015,6(37):40268-40282.
[3]毕娟娟,何林,余音,等.自噬在熊果酸诱导的人脐静脉内皮细胞损伤中的作用[J].中国病理生理杂志,2012,28(4):601-607.
[4]Huang AC,Lien JC,Lin MW,et al.Tetrandrine induces cell death in SAS human oral cancer cells through caspase activation-dependent apoptosis and LC3-Ⅰand LC3-Ⅱactivation-dependent autophagy[J].Int J Oncol,2013,43(2):485-494.
[5]Sun C,Liu Z,Li S,et al.Down-regulation of c-Met and Bcl2 by microRNA-206,activates apoptosis,and inhibits tumor cell proliferation,migration and colony formation[J].Oncotarget,2015,6(28):25533-25574.
[6]赵志栋,高宁.熊果酸抗肿瘤作用分子机制的研究进展[J].中华肿瘤防治杂志,2011,18(24):1969-1972.
[7]王文静,吴韶飞,郭飘婷,等.熊果酸对卵巢癌干细胞荷瘤裸鼠耐药的逆转作用[J].上海中医药杂志,2016,50(5):70-76.
[8]Tucci P,Porta G,Agostini M,et al.Rapamycin regulates biochemical metabolites[J].Cell Cycle,2013,12(15):120-133.
[9]Mizushima N,Yoshimori T,Levine B.Methods in mammalian autophagy research[J].Cell,2010,140(3):313-326.
[10] 王伟,王坤.雷公藤甲素通过ERK通路诱导肺癌A549细胞自噬[J].中国病理生理杂志,2016,32(9):1551-1555.
[11] 侯妮,刘娜,韩佳,等.3-MA通过抑制自噬反应提高结肠癌5-FU的化疗效果[J].西安交通大学学报,2016,36(1):49-53.
[12] Liang B,Liu X,Liu Y,et al.Inhibition of autophagy sensitizes MDR-phenotype ovarian cancer SKVCR cells to chemotherapy[J].Biomed Pharmacother,2016,82(1):98-105.
[13] Fukuda T,Oda K,Wada-Hiraike O,et al.Autophagy inhibition augments resveratrol-induced apoptosis in Ishikawa endometrial cancer cells[J].Oncol Lett,2016,12(4):2560-2566.
[14] Fei HR,Tian H,Zhou XL,et al.Inhibition of autophagy enhances effects of PF-04691502 on apoptosis and DNA damage of lung cancer cells[J].Int J Biochem Cell Biol,2016,78(5):52-56.

