干扰HDAC1通过调控STAT3信号通路影响皮肤鳞癌细胞凋亡*
贾淑青,方锐华,莫金雪
(1广州市第一人民医院南沙医院皮肤科,广东 广州 511457; 2广州市第一人民医院皮肤科,广东 广州 510180)
皮肤是人体最大的器官,能够保护机体免于物理损伤,皮肤经过长时间的紫外线和辐射等损伤后,皮肤组织细胞中的DNA等发生断裂,导致皮肤发生癌变[1]。皮肤鳞状细胞癌(简称鳞癌)是一种常见的皮肤恶性肿瘤,其发病率呈现逐年上升的趋势,具有发展快、易转移等特点。组蛋白去乙酰化酶(histone deacetylase,HDAC)1参与核小体结构的变化过程和相关基因的表达,与转录因子的转录有关,参与细胞凋亡过程。HDAC1在前列腺癌、肾细胞癌和卵巢癌等肿瘤组织中表达升高,能够促进肿瘤细胞的生长[2-6]。信号转导及转录激活因子3(signal transdu-cer and activator of transcription 3,STAT3)信号通路在细胞生长和凋亡过程中发挥调控作用,STAT3磷酸化后,STAT3信号通路激活,细胞凋亡受到抑制[7-9]。有研究表明,抑制STAT3信号通路能够促进肿瘤细胞的凋亡[10-13]。本研究以皮肤鳞癌细胞为研究对象,通过RNA干扰(RNA interference,RNAi)技术探讨HDAC1对细胞凋亡的影响,以期为靶向HDAC1治疗皮肤鳞癌提供理论基础。
材 料 和 方 法
1 材料
HDAC1小干扰RNA(small interfering RNA,siRNA)和小干扰RNA阴性对照(siRNA negative control,siRNA NC)为广州医科大学实验室保存。Lipofectamine 2000转染试剂为Invitrogen产品;RT-PCR试剂盒为Thermo产品;BCA蛋白浓度检测试剂盒为碧云天生物技术研究所产品; 抗STAT3、p-STAT3和cleaved caspase-3单克隆抗体均为SAB产品;抗HDAC1多克隆抗体为Santa Cruz产品。HDAC1和GAPDH引物由TaKaRa合成。
2 方法
2.1细胞培养皮肤鳞癌细胞A431购自广州吉妮欧生物科技。用含有10%胎牛血清的DMEM细胞培养液,置于37 ℃、5% CO2培养箱中培养。将保存于液氮罐中的细胞放于37 ℃条件下不停地摇动,使细胞在1 min内融化,加入细胞培养液,1 000 r/min离心5 min,将上层液吸除后,加入5 mL的细胞培养液,接种于培养瓶中继续培养。待细胞密度超过80%时,用0.25%的胰蛋白酶对细胞进行消化传代。
2.2细胞分组及转染A431细胞培养至对数期后,分别转染HDAC1 siRNA和siRNA NC,记为HDAC1 siRNA组和siRNA NC组,同时设置空白对照(control)组,control组细胞不进行细胞转染。分别取HDAC1 siRNA和siRNA NC各12.5 μL,分别与250 μL不含血清的DMEM培养基混合,室温环境下孵育5 min;取Lipofectamine 2000转染试剂与250 μL不含血清的DMEM培养基混合,在室温静置5 min;将稀释后的siRNA和稀释后的Lipofectamine 2000混合后,室温环境下静置20 min,后加入到细胞密度约为60%的A431细胞中,孵育6 h,更换细胞培养液继续培养48 h,用于后续实验研究。
2.3RT-PCR检测转染后细胞中HDAC1的mRNA表达分别取培养48 h后的各组细胞,加入1 mL Trizol,混匀后裂解5 min。加200 μL氯仿,剧烈振荡反应15 s后,静置5 min,4 ℃、12 000 r/min离心15 min。吸取500 μL上清液于EP管中,加入500 μL的异丙醇溶液,混合后,静置5 min,4 ℃、12 000 r/min离心15 min。用75%的乙醇洗涤RNA 2次后,室温条件下晾干。用DEPC水溶解后,保存于-80 ℃。HDAC1 的上游引物序列为5’-AACTGGGGACCTACGG-3’,下游引物序列为5’-ACTTGGCGTGTCCTT-3’;GAPDH的上游引物序列为5’-CGGAGTCAACGGATTTGGTCGTAT-3’,下游引物序列为5’-AGCCTTCTCCATGGTGGTGAAGAC-3’。 PCR反应程序为:95 ℃ 5 min; 95 ℃ 20 s、60 ℃ 60 s、72 ℃ 30 s,40个循环。以GAPDH为内参照,分析HDAC1的表达水平,实验重复3次,取均值。
2.4Western blot检测转染后细胞中HDAC1的蛋白表达分别取培养48 h后的各组细胞,加入细胞裂解液,待细胞完全裂解后,4 ℃、12 000 r/min离心15 min,吸取蛋白上清液,按照BCA蛋白定量检测试剂盒检测蛋白样品的浓度。将蛋白样品与等体积的上样缓冲液混合煮沸后进行凝胶电泳,使用10%的分离胶和5%的浓缩胶,90 V恒压电泳至溴酚蓝进入到分离胶的底部;100 V电压将蛋白转移到硝酸纤维素膜上,用5%牛血清白蛋白在37 ℃封闭90 min。加入 I 抗 (1∶1 000倍稀释),4 ℃杂交过夜;再加入II抗(1∶2 000倍稀释),室温孵育90 min。显色后,用Quantity One对蛋白进行定量分析,内参照基因为GAPDH,实验重复3次,取均值。
2.5MTT法检测细胞活力取各组细胞以每孔3 000个细胞的密度接种到96孔细胞培养板中,培养48 h后,加入20 μL MTT溶液(5 g/L),37 ℃孵育4 h。弃上清液,在细胞中加入二甲基亚砜150 μL,待细胞结晶物融化后,用酶标仪检测每孔波长490 nm处的吸光度(A),实验重复3次,取均值。
2.6流式细胞术检测细胞凋亡取各组细胞培养48 h后,收集106个细胞,用200 μL结合缓冲液悬浮细胞,加入10 μL Annexin V-FITC和5 μL 碘化丙啶(propidium iodide,PI),于室温环境下,避光反应15 min,再加300 μL缓冲液,用流式细胞术检测细胞凋亡,实验重复3次,取均值。
2.7Western blot检测细胞中STAT3、p-STAT3和cleaved caspase-3的蛋白水平取各组细胞培养48 h后,按照2.4的方法提取细胞蛋白,并用Western blot检测STAT3、p-STAT3和cleaved caspase-3的蛋白水平,内参照为GAPDH,实验重复3次,取均值。
2.8抑制STAT3信号通路对细胞凋亡的影响HDAC1 siRNA组细胞用STAT3信号通路抑制剂AG490(40 μmol/L)处理后48 h(记为HDAC1 siRNA+AG490组),MTT法检测细胞活力(步骤参照2.5),流式细胞术检测细胞凋亡(步骤参照2.6),Western blot检测STAT3、p-STAT3和cleaved caspase-3水平(步骤参照2.7)。
3 统计学处理
所得的实验数据均采用SPSS 22.0统计学软件分析,数据以均数±标准差(mean±SD)表示,多组间比较应用方差分析并用Bonferroni校正的t检验进行两两比较,以P<0.05为差异有统计学意义。
结 果
1 转染后细胞中HDAC1的表达
RT-PCR和Western blot结果显示,与control组比较,siRNA NC组中HDAC1的mRNA和蛋白表达水平均无显著差异;HDAC1 siRNA组细胞中 HDAC1 的mRNA和蛋白表达水平均明显降低(P<0.05),说明HDAC1 siRNA能够有效抑制皮肤鳞癌细胞中HDAC1的mRNA和蛋白表达,见图1。
2 HDAC1对细胞活力的影响
MTT实验结果显示,与control组比较,HDAC1 siRNA组的细胞活力明显降低(P<0.05),说明干扰HDAC1表达能抑制皮肤鳞癌细胞的活力,见图2。
3 HDAC1对细胞凋亡的影响
流式细胞术结果显示,与control组比较,HDAC1 siRNA组细胞凋亡率明显升高(P<0.05),说明干扰HDAC1表达能促进皮肤鳞癌细胞凋亡,见图3。
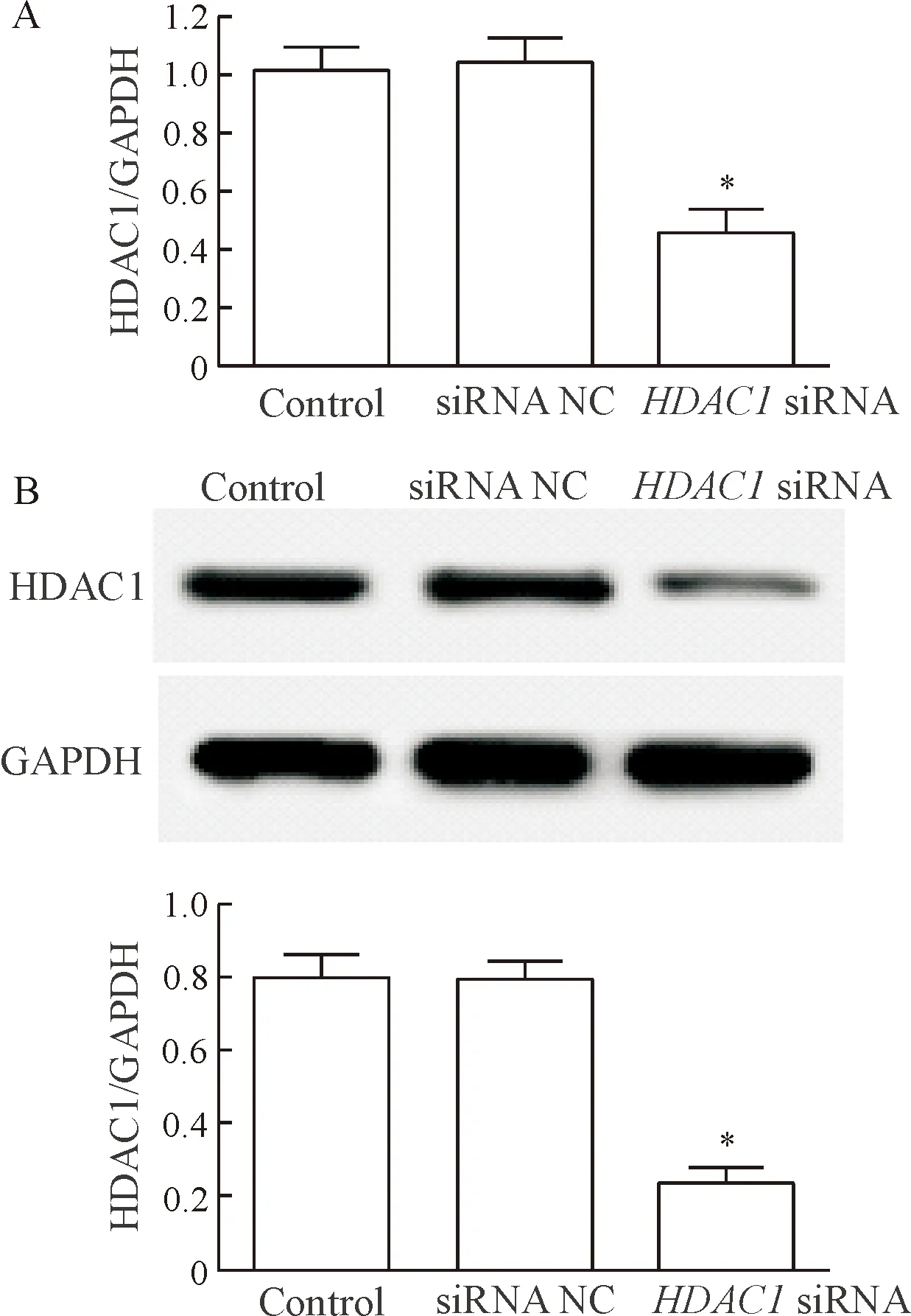
Figure 1.The expression level of HDAC1 in transfected cells.A:the mRNA level of HDAC1; B:Western blot was used to determine the protein expression of HDAC1.Mean±SD.n=3.*P<0.05vscontrol group.
图1转染后细胞中HDAC1表达水平的变化

Figure 2.The effect of HDAC1 on the cell viability.Mean±SD.n=3.*P<0.05vscontrol group.
图2HDAC1对细胞活力的影响
4 HDAC1对细胞STAT3、p-STAT3和cleaved caspase-3水平的影响
Western blot结果显示,与control组比较HDAC1 siRNA组细胞中的STAT3水平无显著差异,p-STAT3水平明显降低(P<0.05),cleaved caspase-3水平明显升高(P<0.05),说明干扰HDAC1表达能够促进皮肤鳞癌细胞中cleaved caspase-3的蛋白水平,抑制p-STAT3的蛋白水平,见图4。
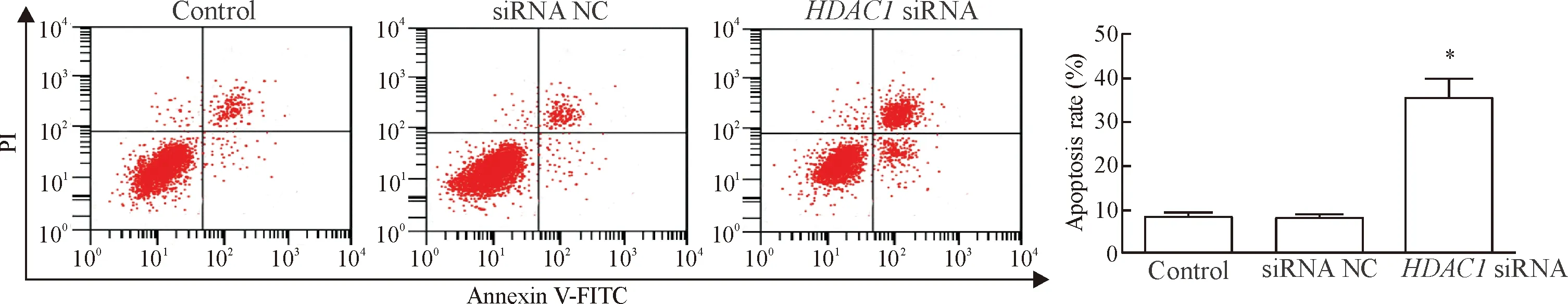
Figure 3.The effect of HDAC1 on the apoptosis.Mean±SD.n=3.*P<0.05vscontrol group.
图3HDAC1对细胞凋亡的影响

Figure 4.The effect of HDAC1 on the protein levels of STAT3,p-STAT3 and cleaved caspase-3 in the cells.Mean±SD.n=3.*P<0.05vscontrol group.
图4HDAC1对细胞中STAT3、p-STAT3和cleavedcaspase-3蛋白水平的影响
5 STAT3信号通路抑制剂对细胞活力的影响
如图5所示,与HDAC1 siRNA组比较,HDAC1 siRNA+AG490组的细胞活力明显降低(P<0.05),说明STAT3信号通路抑制剂AG490能够协同HDAC1 siRNA抑制皮肤鳞癌细胞的活力,见图5。

Figure 5.The effect of STAT3 signaling pathway inhibitor AG490 on the cell viability.Mean±SD.n=3.*P<0.05vsHDAC1 siRNA group.
图5STAT3信号通路抑制剂对细胞活力影响
6 STAT3信号通路抑制剂对细胞凋亡的影响
如图6所示,与HDAC1 siRNA组比较,HDAC1 siRNA+AG490组细胞凋亡率明显升高(P<0.05),STAT3蛋白水平无显著差异,p-STAT3蛋白水平明显降低(P<0.05),cleaved caspase-3蛋白水平明显升高(P<0.05),说明STAT3信号通路抑制剂AG490能够协同HDAC1 siRNA促进皮肤鳞癌细胞凋亡。
讨 论
HDAC1是第一个被发现的组蛋白去乙酰化酶,其编码的蛋白含有482个氨基酸,在非组蛋白和组蛋白的去乙酰过程化中发挥重要作用,能够调控基因的转录和表达[14]。有研究发现,HDAC1在肿瘤组织中过度表达[15]。朱鑫等[16]通过免疫组化和RT-PCR的方法检测了51例肾透明细胞癌标本和24例癌旁组织中HDAC1的阳性表达率依次为62%和37%,HDAC1的mRNA水平依次为0.35和0.10。钟丽颖等[17]研究表明,小干扰RNA靶向抑制HDAC1表达后,卵巢癌细胞的凋亡率增加,细胞生长减慢。研究表明,干扰HDAC1 siRNA表达后的大肠癌细胞SW480的细胞凋亡率高达31%[18]。之后的研究报道称,干扰HDAC1 siRNA表达能够抑制舌鳞癌、宫颈癌和胃癌等多种癌细胞的生长,促进癌细胞的凋亡[19-20]。本研究结果显示,干扰HDAC1 siRNA表达后的皮肤鳞癌细胞活力下降,细胞凋亡率增加,与之前的研究报道相符合,均说明干扰HDAC1表达能够促进癌细胞凋亡。
Caspase蛋白家族成员的活性位点上均含有一个半胱氨酸蛋白酶,能够特异性地切割某些蛋白质,参与细胞凋亡过程。Caspase-3级联反应激活后细胞凋亡发生[21]。Caspase-3是caspase蛋白家族成员之一,是凋亡的执行因子,caspase-3活化后生成cleaved caspase-3,标志着细胞凋亡进入不可逆的阶段。Caspase-3参与多种肿瘤相关基因和药物调控胃癌、肺癌和口腔癌等癌细胞生长的过程[22]。Ho 等[23]研究表明,小檗碱能够通过调控caspase-3的表达影响舌鳞状细胞癌细胞的凋亡。本研究结果显示,干扰HDAC1表达后的皮肤鳞癌细胞中cleaved caspase-3水平升高,这提示,干扰HDAC1表达可能通过提高cleaved caspase-3的水平促进皮肤鳞癌细胞凋亡。
STAT3信号通路参与细胞的生长和凋亡过程,与肿瘤、心血管等疾病的发生有关[24]。有研究表明,肿瘤组织中p-STAT3水平异常升高,细胞中STAT3信号通路异常激活[25]。AG490是STAT3信号通路是上游酪氨酸激酶JAK的抑制剂,能够抑制细胞内STAT3信号通路的激活[26]。用AG490作用于肿瘤细胞后,肿瘤细胞的生长受到抑制作用,细胞凋亡增加[27]。本研究结果显示,干扰HDAC1表达后皮肤鳞癌细胞中p-STAT3水平下降,而用AG490作用后细胞凋亡率升高更多,细胞活力下降更多。这提示,降低HDAC1表达可能通过调控STAT3信号通路影响皮肤鳞癌细胞凋亡。
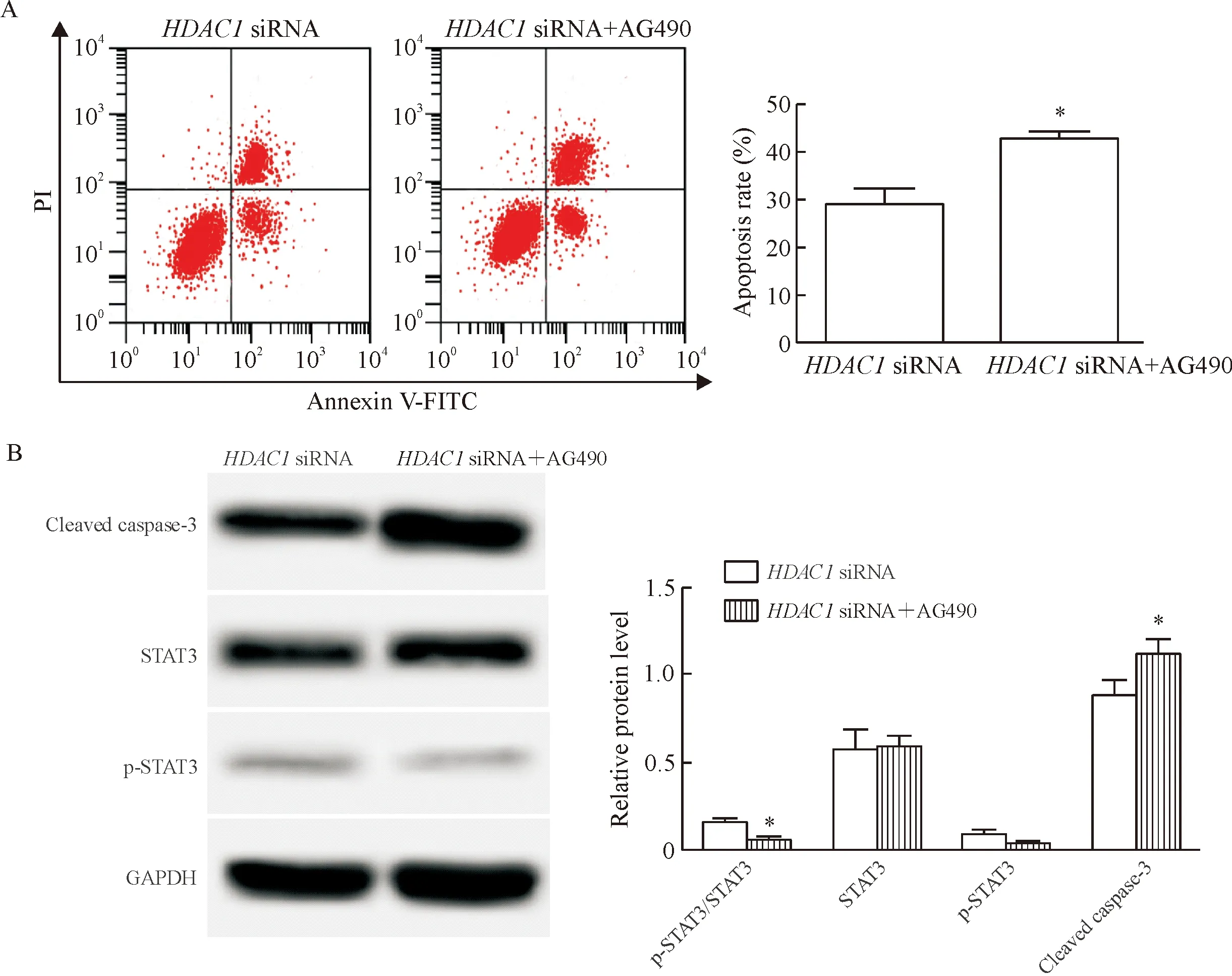
Figure 6.The effect of STAT3 signaling pathway inhibitor on apoptosis.A:the results of flow cytometry for analyzing the cell apoptosis; B:the results of Western blot for determining the protein levels of p-STAT3,STAT3 and cleaved caspase-3.Mean±SD.n=3.*P<0.05vsHDAC1 siRNA group.
图6STAT3信号通路抑制剂对细胞凋亡影响
HDAC1除了能够通过调控STAT3信号通路影响肿瘤细胞生长以外,还可以与DNA甲基转移酶1(DNA methyltransferase-1,DNMT-1)结合形成复合物,调控影响E2F反应性启动子的转录[28]。在T淋巴细胞恶性肿瘤中发现HDAC1能够与STAT3结合形成HDAC1-DNMT1-STAT3复合物,随后有关学者又在骨肉瘤细胞中同样发现该复合物的形成,并且该复合体还可以通过调控SHP-1酪氨酸磷酸酶(SHP-1 tyrosine phosphatase)与STAT结合区域SIE/GAS 的表观遗传性抑制细胞增殖[29-30]。HDAC1对肿瘤的作用机制十分复杂,对于HDAC1影响皮肤鳞癌细胞生长和凋亡的作用机制还需要后续进一步研究。
综上所述,降低HDAC1表达能够抑制皮肤鳞癌细胞活力,促进皮肤鳞癌细胞凋亡,其作用机制可能与STAT3信号通路有关。本研究为后续进一步探讨HDAC1在皮肤鳞癌中的作用奠定了基础,为靶向HDAC1治疗皮肤鳞癌提供了理论依据。本研究只在体外初步探讨了HDAC1在皮肤鳞癌中的作用,后续实验中会对HDAC1在癌症中的具体作用机制进行深入研究,并会对HDAC1调控STAT3信号通路影响癌细胞凋亡的机制做深入探讨。
[参考文献]
[1]Giralt J,Trigo J,Nuyts S,et al.Panitumumab plus radiotherapy versus chemoradiotherapy in patients with unresected,locally advanced squamous-cell carcinoma of the head and neck (CONCERT-2):a randomised,controlled,open-label phase 2 trial[J].Lancet Oncol,2015,16(2):221-232.
[2]Burdelski C,Ruge OM,Melling N,et al.HDAC1 overexpression independently predicts biochemical recurrence and is associated with rapid tumor cell proliferation and genomic instability in prostate cancer[J].Exp Mol Pathol,2015,98(3):419-426.
[3]Kim MJ,Kim DE,Jeong IG,et al.HDAC inhibitors synergize antiproliferative effect of sorafenib in renal cell carcinoma cells[J].Anticancer Res,2012,32(8):3161-3168.
[4]Wu MY,Fu J,Xiao X,et al.MiR-34a regulates therapy resistance by targeting HDAC1 and HDAC7 in breast can-cer[J].Cancer Lett,2014,354(2):311-319.
[5]Meyers-Needham M,Ponnusamy S,Gencer S,et al.Concerted functions of HDAC1 and microRNA-574-5p repress alternatively spliced ceramide synthase 1 expression in human cancer cells[J].EMBO Mol Med,2012,4(2):78-92.
[6]Chuang JY,Chang WC,Hung JJ.Hydrogen peroxide induces Sp1 methylation and thereby suppresses cyclin B1 via recruitment of Suv39H1 and HDAC1 in cancer cells[J].Free Radical Biol Med,2011,51(12):2309-2318.
[7]李逦,王纯,卢宏达.马钱子碱通过抑制IL-6/STAT3信号通路诱导结肠癌SW480细胞凋亡[J].中国病理生理杂志,2016,32(6):998-1003.
[8]Lee HJ,Zhuang G,Cao Y,et al.Drug resistance via feedback activation of Stat3 in oncogene-addicted cancer cells[J].Cancer Cell,2014,26(2):207-221.
[9]Siveen KS,Sikka S,Surana R,et al.Targeting the STAT3 signaling pathway in cancer:role of synthetic and natural inhibitors[J].Biochim Biophys Acta,2014,1845(2):136-154.
[10] Sen M,Thomas SM,Kim S,et al.First-in-human trial of a STAT3 decoy oligonucleotide in head and neck tumors:implications for cancer therapy[J].Cancer Discovery,2012,2(8):694-705.
[11] 崔照琼,张以芳.JAK-STAT 信号转导通路阻断剂 AG490 对肝癌 SMMC-7721 细胞移植瘤生长的影响[J].肿瘤,2016,36(12):1291-1297.
[12] Yue P,Lopez-Tapia F,Paladino D,et al.Hydroxamic acid and benzoic acid-based STAT3 inhibitors suppress human glioma and breast cancer phenotypesinvitroandinvivo[J].Cancer Res,2016,76(3):652-663.
[13] Chung SS,Vadgama JV.Curcumin and epigallocatechin gallate inhibit the cancer stem cell phenotype via down-regulation of STAT3-NFκB signaling[J].Anticancer Res,2015,35(1):39-46.
[14] Boucheron N,Tschismarov R,Goeschl L,et al.CD4+T cell lineage integrity is controlled by the histone deacetylases HDAC1 and HDAC2[J].Nat Immunol,2014,15(5):439-448.
[15] Zhao R,Chen K,Cao J,et al.A correlation analysis between HDAC1 over-expression and clinical features of laryngeal squamous cell carcinoma[J].Acta Otolaryngol,2016,136(2):172-176.
[16] 朱鑫,王亚轩,常学良,等.HDAC1 及 E2F1 在肾透明细胞癌中的表达及意义[J].河北医药,2015,37(19):2885-2888.
[17] 钟丽颖.siRNA 沉默 HDAC1 抑制人卵巢癌 SKOV3/DDP 细胞 EGFR 基因表达及诱导细胞凋亡[D].长春:吉林大学,2013.
[18] Thangaraju M,Carswell KN,Prasad PD,et al.Colon cancer cells maintain low levels of pyruvate to avoid cell death caused by inhibition of HDAC1/HDAC3[J].Biochem J,2009,417(1):379-389.
[19] Halkidou K,Gaughan L,Cook S,et al.Upregulation and nuclear recruitment of HDAC1 in hormone refractory prostate cancer[J].Prostate,2004,59(2):177-189.
[20] De Amicis F,Giordano F,Vivacqua A,et al.Resveratrol,through NF-Y/p53/Sin3/HDAC1 complex phosphorylation,inhibits estrogen receptor α gene expression via p38MAPK/CK2 signaling in human breast cancer cells[J].FASEB J,2011,25(10):3695-3707.
[21] 董雅洁,高维娟,钱涛,等.Bcl-2抑制剂对黄芪注射液降低缺氧缺糖/复氧复糖大鼠海马神经元caspase-3表达的影响[J].中国病理生理杂志,2016,32(6):1051-1056.
[22] Hajiahmadi S,Panjehpour M,Aghaei M,et al.Activation of A2b adenosine receptor regulates ovarian cancer cell growth:involvement of Bax/Bcl-2 and caspase-3[J].Biochem Cell Biol,2015,93(4):321-329.
[23] Ho YT,Lu CC,Yang JS,et al.Berberine induced apoptosis via promoting the expression of caspase-8,-9 and-3,apoptosis-inducing factor and endonuclease G in SCC-4 human tongue squamous carcinoma cancer cells[J].Anticancer Res,2009,29(10):4063-4070.
[24] 陈健芳,陈景福,陈巍,等.血管紧张素(1-7)通过抑制JAK/STAT信号通路对抗高糖诱导的人脐静脉内皮细胞损伤[J].中国病理生理杂志,2017,33(3):481-488.
[25] De Simone V,Franze E,Ronchetti G,et al.Th17-type cytokines,IL-6 and TNF-α synergistically activate STAT3 and NF-κB to promote colorectal cancer cell growth[J].Oncogene,2015,34(27):3493-3503.
[26] 马向涛,王杉,杜如昱,等.JAK 激酶抑制剂 AG490 联合 5-氟尿嘧啶抑制结肠癌细胞STAT3信号转导通路的研究[J].中华实验外科杂志,2003,20(10):874-876.
[27] Gritsko T,Williams A,Turkson J,et al.Persistent activation of Stat3 signaling induces survivin gene expression and confers resistance to apoptosis in human breast cancer cells[J].Clin Cancer Res,2006,12(1):11-19.
[28] Robertson KD,Ait-Si-Ali S,Yokochi T,et al.DNMT1 forms a complex with Rb,E2F1 and HDAC1 and represses transcription from E2F-responsive promoters[J].Nat Ge-net,2000,25(3):338-342.
[29] Zhang Q,Wang HY,Marzec M,et al.STAT3-and DNA methyltransferase 1 -mediated epigenetic silencing of SHP-1 tyrosine phosphatase tumor suppressor gene in malignant T lymphocytes[J].Proc Natl Acad Sci USA,2005,102(19):6948-6953.
[30] Zhang T,Li S,Li J,et al.Natural product pectolinarigenin inhibits osteosarcoma growth and metastasis via SHP-1-mediated STAT3 signaling inhibition[J].Cell Death Dis,2016,7(10):e2421.

