镁合金浸提液对肠上皮细胞Bcl-2及Caspase-3的影响
王战会,孙高斌,孙宗斌,张兵兵,郑秋霞,刘少朋
金属材料如不锈钢和镍钛合金常被用作外科吻合钉和外科缝合材料。然而,这些金属在人体内会释放一些有毒元素,比如镍离子对周围组织有致癌作用[1]。因此,寻找不含有毒元素的金属或合金就显得非常必要。可降解镁合金在胃肠吻合中用作外科吻合钉和外科缝合材料似乎比较合适[2]。Witte等[3]发现可降解镁合金在体内有很好的生物相容性,并且和宿主有温和的炎症反应。然而,Feyerabend等[4]报道镁合金对不同的细胞有不同的影响。因此,为了研究镁合金是否可用作外科吻合钉和外科缝合材料,了解镁合金对肠上皮细胞的影响就显得非常重要。将不同的植入材料植入兔的胫骨,与常用的植入材料镍钛合金和聚乳酸相比,术后3个月和6个月,LAE442和MgCa0.8没有导致输出淋巴结的形态出现改变[5]。和细胞坏死不同,凋亡需要某些基因的表达,某些受体和信号通路的介导[6]。为探讨不同浓度Mg-Ca合金浸提液对人结肠黏膜上皮NCM460细胞Bcl-2及Caspase-3表达的影响,报道如下。
1 材料与方法
1.1材料医疗级纯度的镁钙合金由北京大学工学院提供,该合金主要由高纯度的镁和高纯度的钙构成。镁钙合金材料被加工成直径11.3 mm、厚2 mm的圆片状,在SiC砂纸上磨平并抛光后,用无水乙醇超声清洗,最后用环氧乙烷消毒后待用。根据ISO 10993 制备镁钙合金浸提液[7]。直径11.3 mm、厚2 mm的镁钙合金圆片浸没在含有10%胎牛血清的高糖DMEM培养液中,使每1.25 cm×1.25 cm的镁钙合金表面积有1 mL的高糖DMEM培养液。浸泡有镁钙合金的高糖DMEM培养液在37 ℃含有5%CO2的培养箱中放置24 h,然后收集浸提液,并离心浸提液。浸提液用高糖DMEM培养液稀释成100%、50%和10%的镁钙合金浸提液。将其保存在4 ℃冰箱中,3 d内进行相关实验。
1.2mRNA的提取NCM460细胞在不同浓度的镁钙合金浸提液中分别培养1、3、5 d。用TRIzol试剂从NCM460细胞中提取总RNA。匀浆:在培养瓶中加入1 mL TRIzol试剂裂解细胞,匀浆后样品30 ℃孵育5 min。每1 mL的TRIzol试剂匀浆样品中加入0.2 mL氯仿。手动剧烈振荡管体15 s后,30 ℃孵育3 min。4 ℃下12 000 r·min-1离心15 min。取上层水相与异丙醇混合以沉淀其中的RNA,混匀后30 ℃孵育10 min后,于4 ℃ 12 000 r·min-1离心10 min。移去上清液,加入75%乙醇,振荡后,4 ℃ 7 500 r·min-1离心5 min。分光光度计测定RNA浓度,A260/280比值位于1.8~2.0之间。提取的总RNA用双蒸水洗涤并储存在-80 ℃冰箱中备用。
1.3逆转录聚合酶链反应利用Prime-Script®RT试剂盒行反转录。在PTC-200 Peltier Thermal Cycler PCR反应仪上行反转录反应,400 ng总RNA,2 μL 5× PrimeScriptTM缓冲液,0.5 μL PrimeScriptTMRT Enzyme Mix I,0.5 μL Oligod T Primer(50 M),0.5 μL Random 6 mers primer (100 μM)和RNase-free 双蒸水共计10 μL,37 ℃孵育15 min,然后在85 ℃持续5 s反转录反应即停止。将得到的反转录反应液储存在-20 ℃备用。引物由大连Takara生物有限公司设计与合成。在LightCycler仪器上利用SYBR®Premix Ex Taq TM试剂盒进行real-time定量PCR试验。PCR反应液由如下组分配置而成:10 μL 2×SYBR®Premix Ex Taq TM buffer,0.5 μL的10 M引物,2 μL cDNA 和7.2 μL灭菌蒸馏水共计20 μL。PCR扩增程序如下:第一个循环在95 ℃持续30 s进行预变性,接着40个PCR循环:95 ℃持续5 s,62 ℃持续20 s。随后在95 ℃和65 ℃之间进行融解曲线分析,目的基因的引物序列见表1。
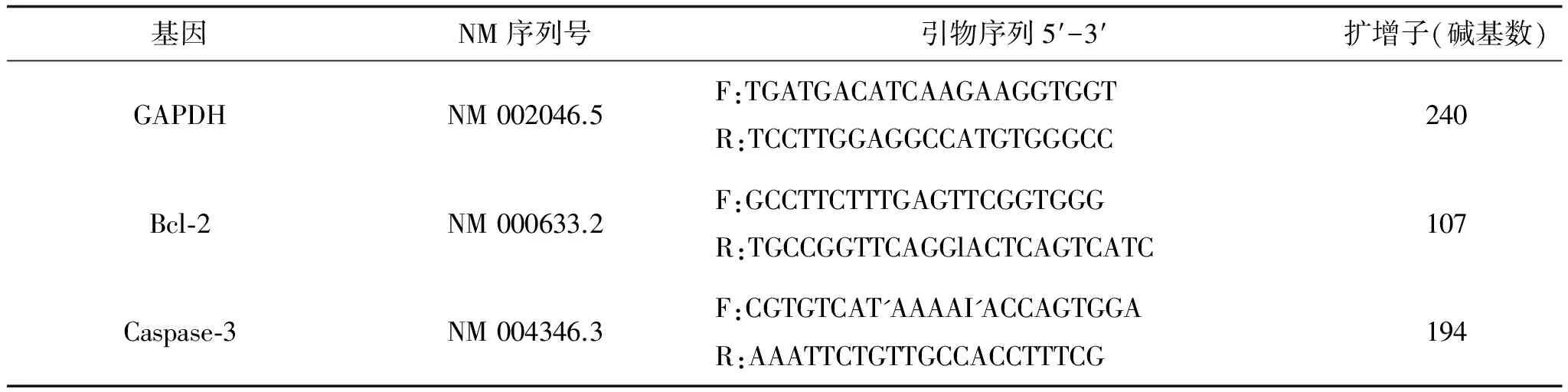
表1 Real-time RT-PCR目的基因的引物序列
1.4Westernblot实验在六孔板上种植NCM460细胞培养到细胞基本融合。然后,NCM460细胞在不同浓度的镁钙合金浸提液中分别培养1、3或5 d。接着用冷PBS洗两次。融解Western细胞裂解液[20 mM Tris pH7.5,150 mM NaCl,1% Triton X-100,2.5 mM sodium pyrophosphate,1 mM EDTA,1%Na3VO4,0.5 μg· mL-1leupeptin,1 mM 苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)],混匀在使用前数分钟内加入PMSF,使PMSF的最终浓度为1 mM。按照六孔板每孔加入100 μL裂解液的比例加入裂解液。充分裂解后,14 000 r·min-1离心5 min,取上清液备用。蛋白定量:以50份BCA试剂A加1份BCA试剂B(50∶1,试剂A:试剂B)的比例混合以配置BCA工作液(WR)。分别吸25 μL 标准品到微孔板的对应孔中(浓度为0~1 000 μg· mL-1)。分别吸取2.5 μL待测样品至微孔板对应孔中,并加入22.5 μL稀释液。每孔加入200 μL的WR,震板30 s以彻底混合均匀。盖好微孔板,37 ℃孵育30 min,冷却至室温。测量570 nm的各孔吸收值,测得的每个标准孔和待测样品孔的吸收值分别减去空白孔平均光吸收值。以校正过的BSA标准蛋白562 nm 测量值对其浓度绘制标准曲线。使用标准曲线定量待测样品蛋白浓度。按照每4 μL蛋白样品加入1 μL蛋白上样缓冲液(5×)的比例,混合蛋白样品和蛋白上样缓冲液。沸水浴5 min,以充分蛋白变性。冷却到室温后,SDS-PAGE加样孔内上样电泳,然后转移到0.45 μm厚的PVDF膜。在室温用封闭液封闭1 h,在4 ℃用一抗[兔抗-Bcl-2,1 μL 300(Santa Cruz,美国);兔抗-Caspase-3,1 μL 200(Santa Cruz,美国);兔抗-GAPDH,1∶300 (Boster,武汉,中国)]孵育过夜,再用TBST冲洗3次,每次10 min,然后再用二抗(HRP标记的羊抗兔IgG)室温孵育PVDF膜1 h。再行化学发光,显影,定影,最后将胶片进行扫描,用凝胶图像处理系统分析目标带的分子量和净光密度值。

2 结果
2.1Bcl-2和Caspase-3基因表达NCM460细胞分别在100%、50%、10%浸提液和对照组处理1、3和5 d后用real-time PCR 检测Bcl-2 and Caspase-3基因的表达。在不同浓度的浸提液处理NCM460细胞后,MMP9基因在细胞中的表达变化。在NCM460细胞分别经100%、50%、10%浸提液处理1 d后,Bcl-2基因在10%或50%浸提液处理的细胞中的表达与对照组比较差异无统计学意义(P<0.05)。处理3 d后,Bcl-2基因在50%或100%浸提液处理过的细胞中的表达与对照组比较差异无统计学意义(P<0.05)。处理5 d后,Bcl-2基因在50%或100%浸提液处理过的细胞中的表达显著低于对照组 (P<0.05),见图1。NCM460细胞分别在100%、50%、10%浸提液和对照组处理1 d后,Caspase-3基因在细胞中的表达差异无统计学意义(P>0.05)。处理3 d后,Caspase-3基因在50%浸提液处理过的细胞中的表达显著高于对照组(P<0.05)。而且,在处理5 d后,Caspase-3基因在100%、50%和10%浸提液处理过的细胞中的表达显著高于对照组的表达 (P<0.05),见图2。
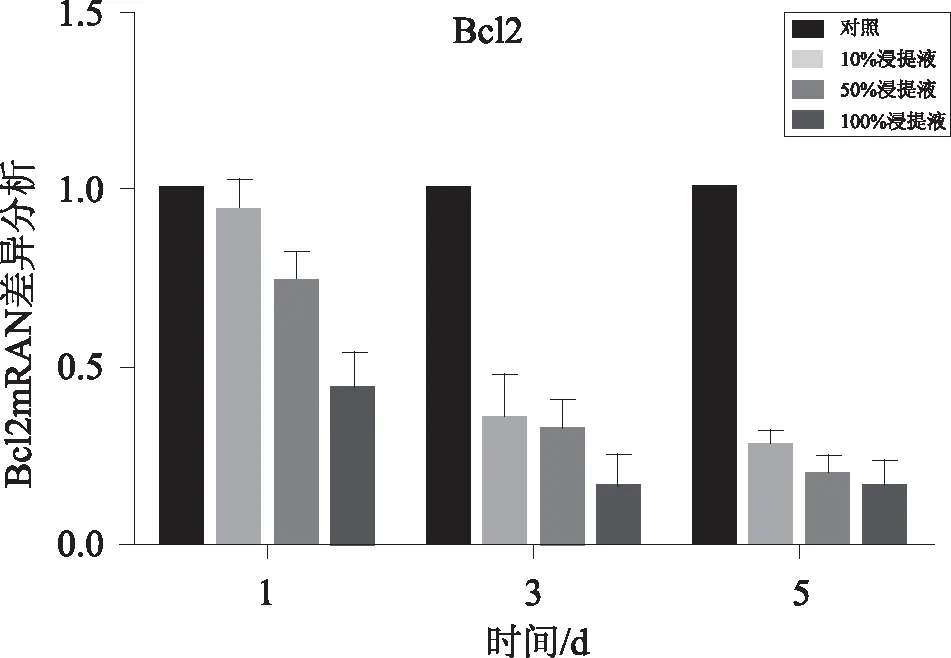
图1 不同浓度Mg-Ca合金浸提液中NCM460细胞Bcl-2基因表达
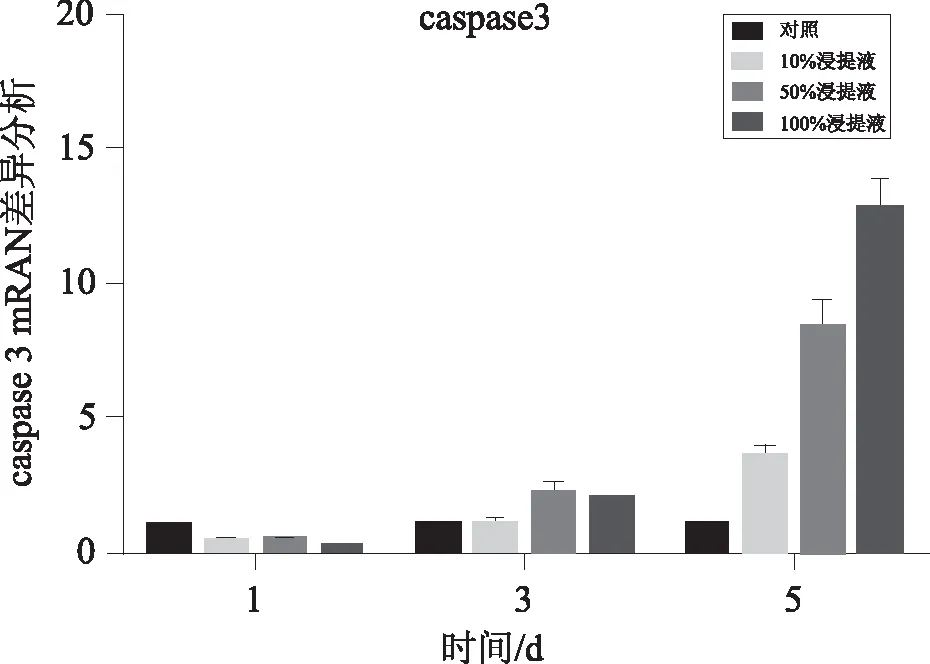
图2 不同浓度Mg-Ca合金浸提液中NCM460细胞Caspase-3基因表达
2.2Bcl-2和Caspase-3蛋白表达NCM460细胞在不同浓度浸提液处理1、3和5 d后用Western blotting 检测Bcl-2和Caspase-3蛋白的表达。处理5 d后,Bcl-2基因在50%或100%浸提液处理细胞中的表达显著低于对照组的表达(P<0.05),见图3。而处理5 d后,Caspase-3在100%、50%和10%浸提液细胞中的表达显著高于对照组的表达 (P<0.05),见图4。
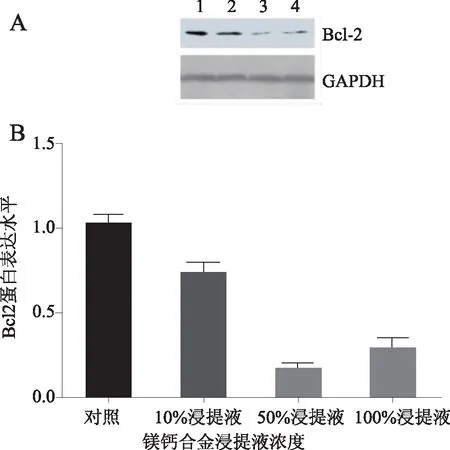
A:Western blotting检测;B:Bcl-2/GAPDH蛋白比值。1:对照;2:10%浸提液;3:50%浸提液;4:100%浸提液。图3 不同浓度Mg-Ca合金浸提液中培养5 d NCM460细胞Bcl-2蛋白表达
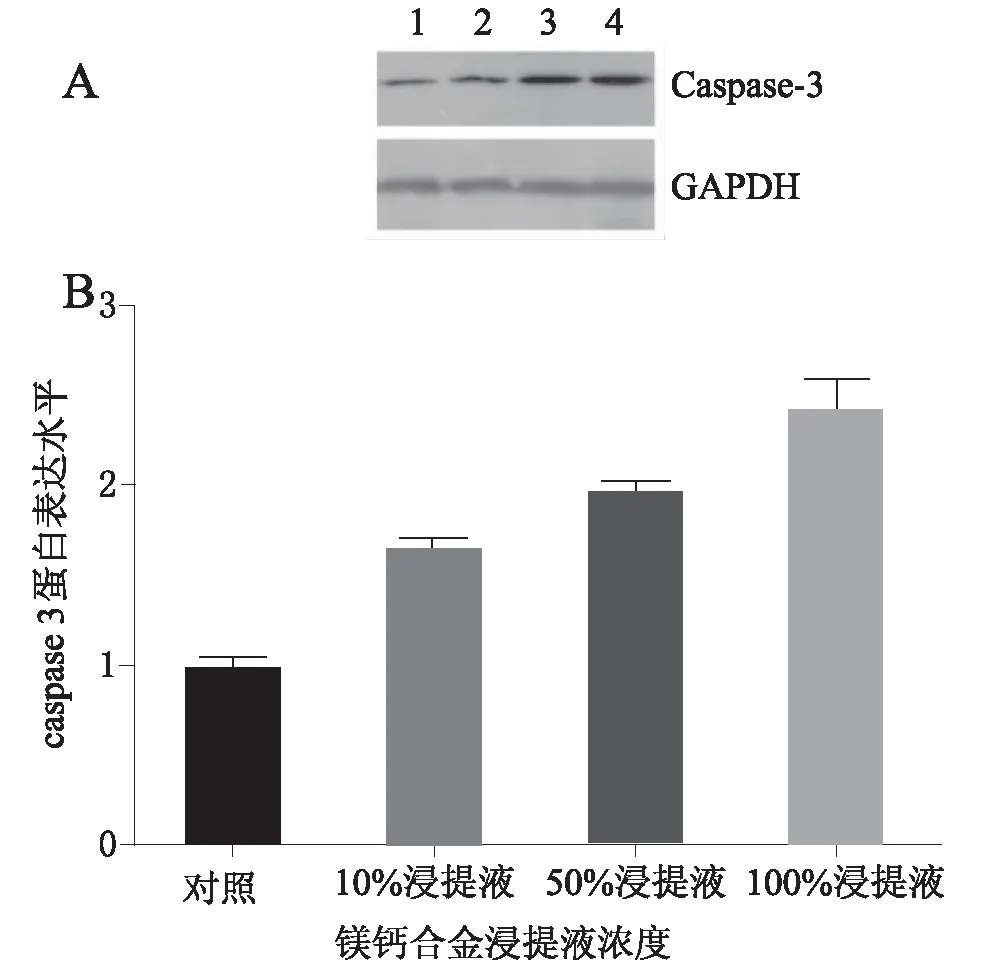
A:Western blotting检测;B:Caspase-3 /GAPDH蛋白比值。1:对照;2:10%浸提液;3:50%浸提液;4:100%浸提液。图4 不同浓度Mg-Ca合金浸提液中培养5 d NCM460细胞Caspase-3蛋白表达
3 讨论
Bcl-2是细胞凋亡的细胞内的一个关键调节点[8]。Bcl-2的功能不是促进细胞增殖而是抑制细胞程序性死亡[9]。而Caspases是由能促进凋亡的至少14个成员构成的大家族[10]。Caspase-3是大家族的成员之一,处于凋亡有序“瀑布式”级联反应的下游,是最重要也是最终的效应执行者。多数诱导凋亡因素依靠Caspase蛋白的级联激活反应来实现细胞凋亡,Caspase-3是细胞凋亡过程中的最关键执行蛋白酶,Caspase-3蛋白介导的信号传导途径是多数凋亡刺激因素导致细胞凋亡。通过评价Bcl-2和Caspase-3的表达,以更深入地了解可降解镁合金对肠上皮细胞的影响。NCM460细胞系被广泛应用于体外实验,评价肠道植入材料的生物相容性。
3.1镁合金的降解产物对NCM460细胞Bcl-2表达的影响研究发现,低浓度的Mg-6Zn合金浸提液即可导致细胞凋亡,Bcl-2基因的表达也降低[11]。本研究发现,在NCM460细胞经100%、50%、10%浸提液和对照组处理5 d后,Bcl-2基因在50%或100%浸提液处理细胞的表达显著低于对照组,与上述文献结果相一致。导致Bcl-2在不同浓度浸提液处理的细胞中表达不一致的机制仍不清楚,可能与浸提液中的钙离子浓度有关。胞内Ca2+浓度超载可以导致线粒体损伤,释放细胞色素C,活化Caspases,诱导细胞凋亡[12]。Caspase-3与其他凋亡蛋白家族成员发挥作用,通过降解凋亡抑制蛋白Bcl-2,使Caspase家族成员激活并被水解后形成级联反应,最后在核小体连接处切割DNA链接片段,使细胞凋亡[13]。
3.2镁合金的降解产物对NCM460细胞Caspase-3表达的影响有研究发现,Mg-6Zn合金浸提液在一定范围内处于较高浓度时易诱导IEC-6细胞凋亡及Caspase-3的表达,且随浓度升高影响增大[14]。本研究发现,在NCM460细胞经100%、50%、10%浸提液和对照组处理5 d后,Caspase-3基因在100%、50%和10%浸提液处理细胞中的表达显著高于对照组的表达,与相关文献结果相一致[15]。同样,导致Caspase-3在不同浓度浸提液处理的细胞中的表达不一致的机制仍不清楚,可能与浸提液中的镁离子及钙离子浓度有关[16]。此外,有研究发现,一些稀有元素对细胞凋亡也有影响[17-18]。同时,也有研究报道氟化物修饰的镁合金对细胞凋亡没有明显影响[19]。许多研究认为,植入的镁合金对植入物附近的细胞凋亡无明显影响,这可能与植入物降解较慢,同时降解的离子会扩散到血液及远处组织有关[11]。
总之,Mg-Ca合金浸提液在一定范围内处于较高浓度时易诱导NCM460细胞Caspase-3的表达,而抑制Bcl-2的表达,可能与镁离子及钙离子浓度有关。通过对Bcl-2和Caspase-3联合活性测定,可以进一步了解Mg-Ca合金浸提液对细胞凋亡的影响,对进一步研究Mg-Ca合金的生物相容性提供有利帮助。
参考文献:
[1]Denkhaus E,Salnikow K.Nickel essentiality,toxicity,and carcinogenicity[J]. Crit Rev Oncol Hematol,2002,42(1):35-56.
[2]Hausmann U,Feussner H,Ahrens P,et al.Endoluminal endosurgery:rivet application in flexible endoscopy[J].Gastroint Endosc,2006,64(1):101-103.
[3]Witte F,Ulrich H,Rudert M,et al.Biodegradable magnesium scaffolds:Part 1:appropriate inflammatory response[J].J Biomed Mater Res A,2007,81(3):748-756.
[4]Feyerabend F,Fischer J,Holtz J,et al.Evaluation of short-term effects of rare earth and other elements used in magnesium alloys on primary cells and cell lines[J].Acta Biomater,2010,6(5):1834-1842.
[5]Bondarenko A,Hewicker-Trautwein M,Erdmann N,et al.Comparison of morphological changes in efferent lymph nodes after implantation of resorbable and non-resorbable implants in rabbits[J]. Biomed Eng Online,2011,10(1):32.
[6]Brodbeck WG,Shive MS,Colton E,et al.Influence of biomaterial surface chemistry on the apoptosis of adherent cells[J].J Biomed Mater Res,2001,55(4):661-668.
[7]Mani G,Feldman MD,Patel D,et al.Coronary stents:A materials perspective.Biomaterials[J].Biomaterials,2007,28(9):1689-1710.
[8]Feng L,Precht P,Balakir R,et al.Evidence of a direct role for Bcl-2 in the regulation of articular chondrocyte apoptosis under the conditions of serum withdrawal and retinoic acid treatment[J].J Cell Biochem,2015,71(2):302-309.
[9]Hong-Duck U.Bcl-2 family proteins as regulators of cancer cell invasion and metastasis:a review focusing on mitochondrial respiration and reactive oxygen species[J].Oncotarget,2016,7(5):5193.
[10]Julien O,Wells JA.Caspases and their substrates[J].Cell Death Differ,2017,24(8):1380-1389.
[11]Chen Y,Yan J,Wang X,et al.In vivo and in vitro evaluation of effects of Mg-6Zn alloy on apoptosis of common bile duct epithelial cell[J].Biometals,2014,27(6):1217-1230.
[12]Mathai JP,Germain M,Shore GC.BH3-only BIK regulates BAX,BAK-dependent release of Ca2+from endoplasmic reticulum stores and mitochondrial apoptosis during stress-induced cell death[J].J Biol Chem,2005,280(25):23829-23836.
[13]Fan TJ,Han LH,Cong RS,et al.Caspase family proteases and apoptosis[J].Acta Biochim Biophys Sin,2005,37(11):719-727.
[14]王啸虎,陈义钢,于嵩,等.不同浓度Mg-6Zn合金浸提液对肠上皮细胞凋亡及其相关基因Caspase-3表达的影响[J].材料导报,2015,29(8):47-51.
[15]Wang Z,Yan J,Li J,et al.Effects of biodegradable Mg-6Zn alloy extracts on apoptosis of intestinal epithelial cells[J].Mat Sci Eng B,2012,177 (4):388-393.
[16]郭莉莎,何永辉,王娟,等.生物可降解Mg-2Zn-0.2Mn合金的体外生物相容性[J].材料科学与工程学报,2013,31(5):703-707.
[17]Feyerabend F,Fischer J,Holtz J,et al.Evaluation of short-term effects of rare earth and other elements used in magnesium alloys on primary cells and cell lines[J].Acta Biomater,2010,6(5):1834-1842.
[18]Ding Y,Wen C,Hodgson P,et al.Effects of alloying elements on the corrosion behavior and biocompatibility of biodegradable magnesium alloys: a review[J].J Mater Chem B,2014,2(14):1912-1933.
[19]Lozano RM,Pérez-Maceda BT,Carboneras M,et al.Response of MC3T3-E1 osteoblasts, L929 fibroblasts,and J774 macrophages to fluoride surface-modified AZ31 magnesium alloy[J].J Biomed Mater Res A,2013,101(10):2753-2762.

