miR-181-5p通过下调AKT3抑制肝癌细胞侵袭和转移
赵延兵,张 玮,赵巧云,秦 雯,苏瑜恒,牛馨苗
肝细胞癌(hepatocellular carcinoma,HCC)是我国最常见的原发性癌和最常见的实性肿瘤[1]。由于肝细胞癌的侵袭而造成的肿瘤细胞转移显著降低了相当一部分肝癌患者的治疗效果[2]。最新的研究结果表明,大量的miRNA在HCC中被释放,miRNA直接或间接地通过靶向转移相关蛋白来调节肿瘤转移。miR-181-5p已经被证明在几种癌症中下调[3]。然而,对于miR-181-5p在人肝癌中的作用机制和潜在的分子机制知之甚少。本研究通过人肝癌标本的免疫组化染色、qRT-PCR和体外培养肝癌细胞并进行细胞转染、免疫荧光染色、蛋白印迹实验、平板克隆、Transwell和细胞活力检测等,研究了miR-181-5p靶基因通过调控AKT3,进而影响肝癌细胞侵袭转移、增殖,现报道如下。
1 材料和方法
1.1材料人肝癌细胞株SMMC-7721,购于天津百塞斯生物科技公司;人肝癌组织收集于焦作市人民医院病理科;1640培养基购于Gbico公司;小牛血清购于美国Gbico公司;兔抗鼠AKT3、N-cadherin、E-cadherin抗体以及羊抗兔辣根过氧化物酶标记二抗购于美国CST公司;反转录试剂盒和qRT-PCR试剂盒均购于全式金生物科技公司。免疫组化试剂盒购于天津麦兰伯生物科技公司;免疫荧光二抗,购于美国abcam公司。Transwell小室和Matrigel基底胶购于美国BD公司;AKT3 siRNA、miR-181-5p mimic或inhibitor购于广州锐博生物科技公司。
1.2miR-181-5p和AKT3含量检测Trizol法提取总RNA, miRNA专用提取试剂盒提取肝组织miRNA,然后进行反转录反应。按照荧光定量PCR试剂盒说明书配置PCR体系,然后上机。PCR 结果计算方法是:目的基因定量=2-△△CT,而△CT =CT目的基因-CT内参,△△CT=△CT实验组-△CT对照组。
1.3AKT3、E-cadherin和N-cadherin表达人肝癌组织用4%中性甲醛溶液固定,常规经过梯度酒精、二甲苯脱水制作组织蜡块、切片。两组分别经过免疫组化染色,显微镜下观察AKT3、E-cadherin和N-cadherin表达量。
1.4细胞转染将SMMC-7721肝癌细胞接种至六孔板,培养至细胞密度50%~70%。NC组每孔加入10 μL miRNA-NC转染细胞;mimic组每孔加入10 μL miRNA-mimic;inhibitor组每孔加入10 μL miRNA-inhibitor;inhibitor+siRNA AKT3组在转染inhibitor的同时加入siRNA AKT3转染细胞。将转染后的肝癌细胞置于37 ℃、5%CO2培养箱中继续培养。
1.5肝癌细胞增殖能力检测待siRNA NC组、inhibitor+siRNA NC组和inhibitor+siRNA AKT3组细胞密度至80%~90%时,分别胰酶消化、重悬,细胞计数后调整细胞浓度,于六孔板中培养,每组做3个复孔。放入37 ℃、5%CO2培养箱中培养2周,弃去培养基,PBS洗3遍,0.5%结晶紫染色后肉眼直接计数每孔的克隆数[4]。
1.6肝癌细胞侵袭、转移能力待siRNA NC组、inhibitor+siRNA NC组和inhibitor+siRNA AKT3组SMMC-7721细胞密度至80%~90%时,分别胰酶消化、1%培养基重悬,细胞计数后调整细胞浓度至105·mL-1。在24孔板中加入10%培养基,每孔600 μL。将Transwell小室(加Matrigel胶小室用于观察SMMC-7721细胞侵袭能力,不加Matrigel胶小室用于观察肿瘤细胞转移能力)放入24孔板中,每组吸取100 μL细胞悬液分别加入加胶和不加胶的小室中,每组做3个复孔。放入37 ℃、5%CO2培养箱中继续培养24~48 h。弃去培养基,取出小室,用0.1%结晶紫染液室温染色3 h[5]。在显微镜下观察并计数。
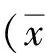
2 结果
2.1miR-181-5p、AKT3表达量和相关性qRT-PCR结果显示,与对照组((miR-181-5p (16.6±3.7),AKT3 (10.6±3.9))相比较,miR-181-5p在人肝癌组织中呈低表达(8.7±3.6),而AKT3高表达(17.3±3.5),组间差异有统计学意义(P<0.05),miR-181-5p与AKT3在肝癌组织中相关性较高(r2=0.636 5,P<0.05);免疫组化结果显示在miR-181-5p高表达的肝癌组织中AKT3、E-cadherin、N-cadherin阳性染色较miR-181-5p低表达的肝癌组织减弱,见图1。
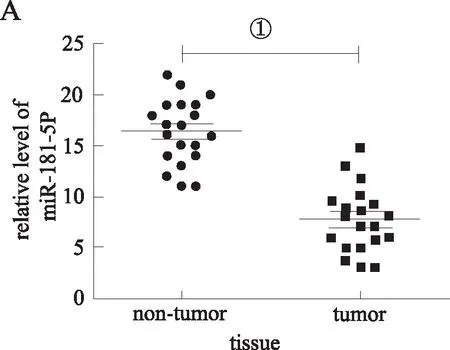
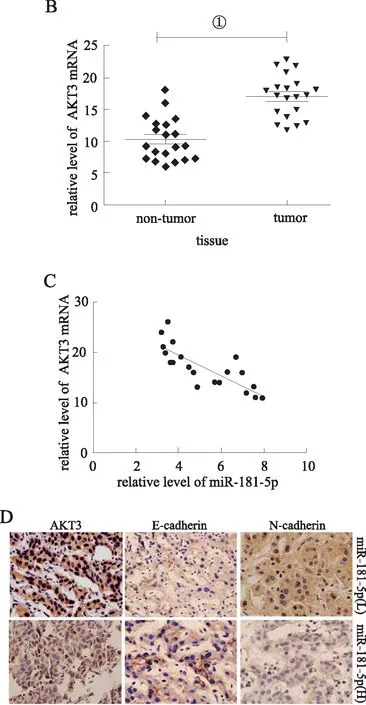
A、B:PCR测定miR-181-5p和AKT3在人肝癌组织与正常肝组织表达水平(①P<0.05);C:miR-181-5p和AKT3在肝癌组织中的相关性;D:免疫组化显示miR-181-5p高表达肝癌组织和miR-181-5p低表达的肝癌组织中AKT3、E-cadherin和N-cadherin表达分布情况。图1 各组肝组织miR-181-5p、AKT3表达及miR-181-5p与AKT3相关性
2.2miR-181-5p靶向抑制AKT3Transwell结果显示:与NC组细胞侵袭数目96.7±11.4相比较,抑制miR-181-5p活性,细胞侵袭数目为246.7±27.7,肝癌细胞的侵袭转移能力增强;敲除AKT3后,细胞侵袭数目为128.9±10.8,肝癌细胞的侵袭转移能力降低(P<0.05);平板克隆结果显示:NC组细胞数目为106.2±8.3,抑制miR-181-5p活性,细胞数目为391.2±12.3,肝癌细胞的增殖能力增强,而敲除AKT3后,细胞数目为124.5±10.1,肝癌细胞的增殖能力降低(P<0.05)。
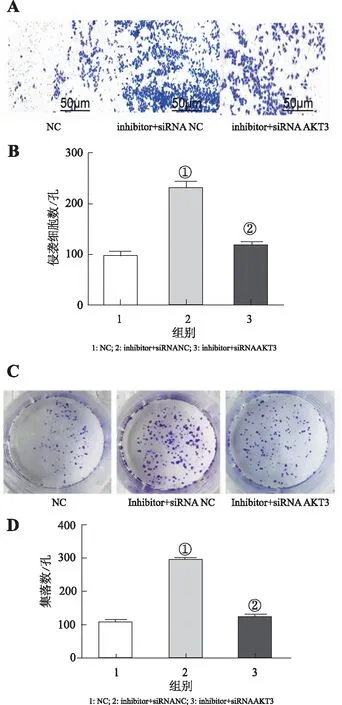
A:Transwell显示肝癌细胞侵袭转移能力;B:计数各组细胞数(①与NC组比较,P<0.05)。C:平板克隆实验结果显示肝癌细胞增殖能力;D:计数各组细胞集落数(②与inhibitor+siRNA NC组比较,P<0.05)。图2 miR-181-5p靶向抑制AKT3对肝癌细胞侵袭转移和增殖能力的影响
3 讨论
miR-181家族的成员miR-181-5p已被证明在多种肿瘤中低表达,包括乳腺癌[6]、结直肠癌[7]、肺癌、胃癌和口腔鳞状细胞癌[8],但其确切的分子机制仍然未知。作者采用qRT-PCR检测人肝癌标本中miR-181-5p表达量,发现miR-181-5p在人肝癌组织中表达量明显减少。同时,通过免疫组化染色发现在miR-181-5p高表达组肝癌组织中AKT3、E-cadherin和N-cadherin表达量较miR-181-5p低表达组的肝癌组织中低,说明在肝癌细胞模型中miR-181-5p高表达能显著降低肝癌细胞的侵袭、转移和增殖的能力,反之能增强肝癌细胞的侵袭、转移和增殖的能力。
上述的研究中发现了miR-181-5p能抑制肝癌细胞的侵袭转移,但是其作用机制仍然未知。作者通过TargetScan预测了miR-181-5p与自噬相关调节蛋白AKT3高度相关,于是设想,miR-181-5p是否通过AKT3调节肝癌细胞EMT,进一步影响肝癌细胞的侵袭转移?有证据表明,miR-181家族成员通过EMT途径发挥作用。EMT触发上皮细胞表达间充质标记物,并下调上皮标志物表达[9]。E-钙黏蛋白(E-cadherin)是一种上皮分子标记物,其负责建立黏附连接处,在顶面下方形成连续的黏合带[10-12]。由EMT引起的E-钙黏蛋白的损失导致细胞间的接合脱落,并降低黏附力[13-15]。Transwell结果显示:抑制miR-181-5p活性,肝癌细胞的侵袭转移能力增强,敲除AKT3后肝癌细胞的侵袭转移能力降低;平板克隆结果显示:抑制miR-181-5p活性,肝癌细胞的增殖能力增强,敲除AKT3后肝癌细胞的增殖能力降低。
以上结果表明miR-181-5p靶基因通过靶向调控AKT3,进而影响肝癌细胞侵袭转移、增殖和生存能力。因此,miR-181-5p靶向调控AKT3抑制自噬有望成为干预肝癌细胞侵袭转移的新策略。
参考文献:
[1]孙燕,屠红,陆培新,等.肝癌家族史与肝癌关系的20年前瞻性队列研究[J].中华肝脏病杂志, 2014,22(10):752-756.
[2]Hanahan D,Weinberg RA.The hallmarks of cancer[J].Cell,2000,100(1):57-70.
[3]Ouyang Y,Lu Y,Yue S,et al.miR-181 targets multiple Bcl-2 family members and influences apoptosis and mitochondrial function in astrocytes[J].2012,12(2):213-219.
[4]Lv J,Fan HX,Zhao XP,et al.Long non-coding RNAUnigene 56159 promotes epithelial-mesenchymal transition by acting as a ceRNA of miR-140-5p in hepatocellular carcinoma cells[J].Cancer Lett, 2016,382(2):166-175.
[5]Xia H,Ooi LL,Hui KM.MicroRNA-216a/217-induced epithelial-mesenchymal transition targets PTEN and SMAD7 to promote drug resistance and recurrence of liver cancer[J].Hepatology,2013,58(2):629-641.
[6]林姝,焦旭阳,赵琳,等.miR-181 a对乳腺癌耐药蛋白表达调控作用的研究[J].中国药理学通报,2014(8):1073-1078.
[7]SHI L,程子昊,ZHANG JX,等. miR-181家族的表达与人脑胶质瘤恶性程度的关系[J].中国肿瘤临床,2008,35(15):877-880.
[8]Yang CC,Huang PS,Wang PW,et al.miR-181 as a putative biomarker for lymph-node metastasis of oral squamous cell carcinoma[J].2011,40(5):397-404.
[9]李裕明,韩克强,郑璐,等.上皮间质转化标志物E-cadherin和Vimentin在原发性肝癌中的表达及其临床意义[J].中华肝脏病杂志,2013,21(4):279-284.
[10]马平川,何宏月,王芳,等.上皮间质转化相关蛋白E-cadherin、N-cadherin及Snail在子宫内膜异位症相关卵巢癌的表达及意义[J].实用妇产科杂志,2016,32(3):211-215.
[11]Yao X,Ireland SK,Pham T,et al.TLE1 promotes EMT in A549 lung cancer cells through suppression of E-cadherin[J].Biochem Biophys Res Commun,2014,455(3-4):277-284.
[12]Zhai X,Zhu H,Wang W,et al.Abnormal expression of EMT-related proteins, S100A4, vimentin and E-cadherin, is correlated with clinicopathological features and prognosis in HCC[J].Med Oncol,2014,31(6):970.
[13]Yu JM,Sun W,Hua F,et al.BCL6 induces EMT by promoting the ZEB1-mediated transcription repression of E-cadherin in breast cancer cells[J].Cancer Lett,2015,365(2):190-200.
[14]Asakura T,Yamaguchi N,Ohkawa K,et al.Proteasome inhibitor-resistant cells cause EMT-induction via suppression of E-cadherin by miR-200 and ZEB1[J].Int J Oncol,2015,46(5):2251-2260.
[15]Canesin G,Cuevas EP,Santos V,et al.Lysyl oxidase-like 2 (LOXL2) and E47 EMT factor: novel partners in E-cadherin repression and early metastasis colonization[J].Oncogene, 2015,34(8):951-964.

