沼液回流对棉花秸秆产甲烷效率及微生物群的影响
张 晗, 王文政, 袁旭峰, 李秋芝, 杨中旭
(1.中国农业大学生物质工程中心, 北京 100193; 2.聊城市农业科学研究院, 山东 聊城 252000)
我国是世界秸秆产量第一大国[1]。厌氧发酵技术是将农业废弃物转化为沼气的有效手段之一[2],是秸秆资源化的重要途径[3]。然而,在生产沼气的同时也会均衡地产生大量的副产品—沼液沼渣,同时秸秆中的纤维素、半纤维素和木质素的含量直接影响到秸秆厌氧发酵产气的效果,不同种类秸秆厌氧发酵产沼气的效果差别较大。沼液回流技术可以从源头上减少沼液排放,预防农田消纳时潜在的环境风险,对大中型沼气工程沼液的减排和节约淡水资源具有重要的理论和现实意义。沼液回流可以减少氨氮损失,实现单秸秆发酵,同时减少功能微生物损失[4],实现菌群水解和产甲烷过程的平衡。但过高的回流比会导致氨氮积累[5-6],粘度增加[7],导致发酵产气量下降。有关沼液回流能够提高发酵效率、反应器运行稳定性和增加原料利用率的研究大多是建立在批次发酵的基础上,或者将用于回流的沼液进行稀释,而对于在低含固率发酵条件下,沼液过筛后全部回流对单秸秆特别是木质化程度较高的秸秆发酵效果的影响较少有相关报道[8]。实验以棉花秸秆为原料,在固定进水负荷4 gTS·L-1d-1及HRT(15 d)下,通过沼液回流再利用,研究回流对产甲烷效率及微生物群的影响。
1 材料与方法
1.1 棉花秸秆及污泥特性
实验启动的活性污泥取自笔者实验室在中温条件50 L CSTR发酵罐长期培养的种泥,活性污泥的TS和VS分别为6%,4.1%,pH值为7.2,在有效体积为6 L的发酵罐内接种污泥3.2 L。棉花秸秆粉碎成秸秆粉,过40目筛备用,其理化性质见表1。
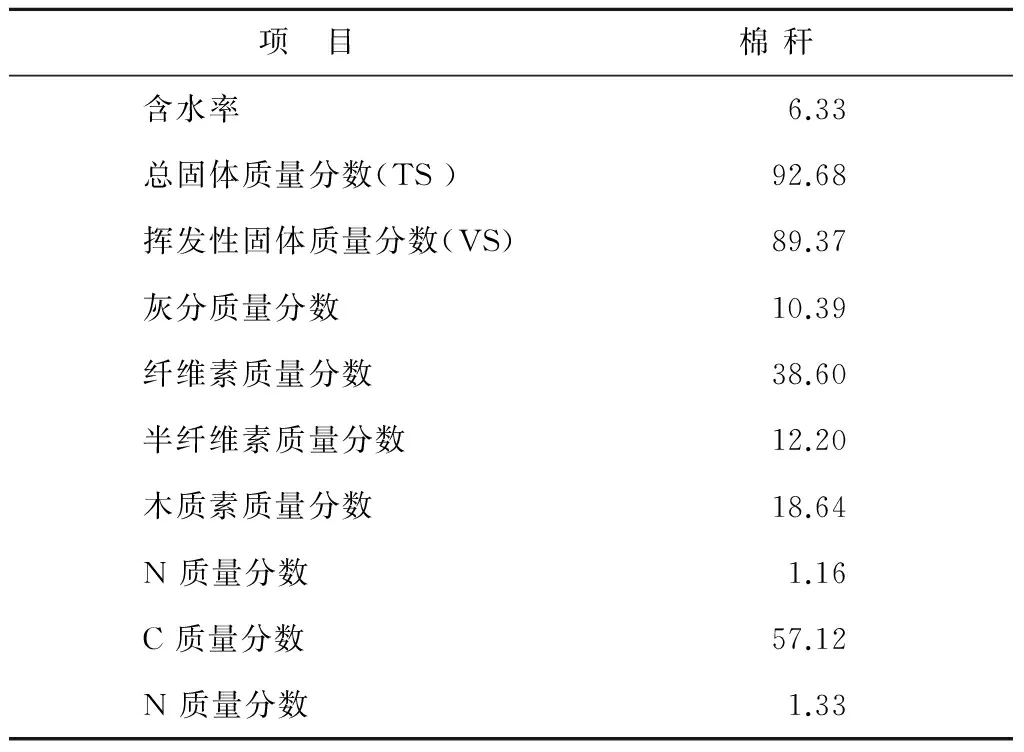
表1 原料的理化性质 (%)
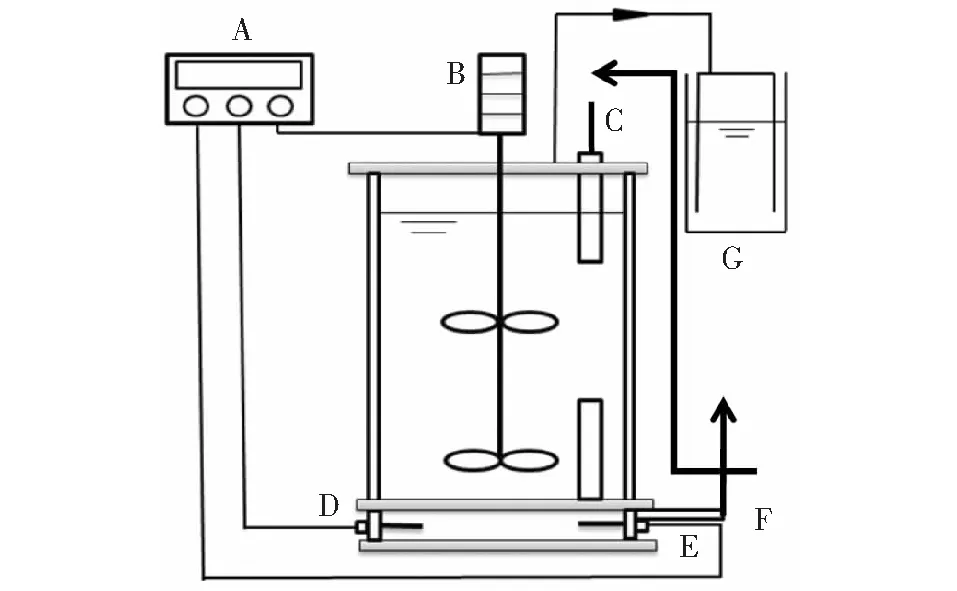
A.自动控制装置; B.搅拌器; C.进水口; D.温度探头; E.加热杆; F.出水口; G.气体收集装置图1 CSTR反应器模拟结构简图
1.2 实验装置与操作
厌氧发酵装置为2个相同的CSTR反应器(见图1),总体积7.2 L有效体积为6 L。每天搅拌2次,每次10 min,搅拌速度为200 r·min-1。沼液经350目尼龙纱网过滤后用于进料稀释,回流到发酵罐中重新利用,而未回流组使用清水代替。
1.3 实验监测方法
总固体(TS),挥发固体(VS)采用干重法[9];进出料的pH值采用SANXIN牌SX-TSL610型笔式pH计测量;沼气采用SY-TSL20L氧气袋收集;甲烷体积分数采用便携式沼气分析仪 (Geotech Biogas 5000型,英国);纤维素含量用ANKOM220纤维分析仪测量;SCOD采用标准重铬酸钾氧化法[10];氨氮采用水杨酸-TSL次氯酸盐光度法测定[10];出料挥发性脂肪酸VFAs采用岛津LC-TSL20A高效液相色谱仪测定,色谱柱为BIO-TSLRAD HPX-TSL87H Lon Exclusion Column; 微生物群结构分析采用16S rDNA基因克隆文库法[11]。
2 结果与讨论
2.1 回流对甲烷产率的影响
甲烷产率是衡量厌氧消化系统运行效率的重要指标。在固定进水负荷4 gTS·L-1d-1条件下,从第31天开始回流,从图2可知,回流初始阶段不会对产气有影响,但随着回流时间延长,甲烷产率会下降,当运行到153天时,两组甲烷产率开始出现差异,沼液回流开始对厌氧发酵产生抑制作用,回流组的甲烷产率由332.4 mL·L-1d-1降低到255.7 mL·L-1d-1,下降了23.1%。有文献表明[12],回流使沼液中未降解掉的有机物及携带的产甲烷菌群重新进入发酵罐中,能够在一定程度上提高沼气含量。笔者研究显示前152天回流并未增加产气,可能因为在相对较低的有机负荷4 gTS·L-1d-1下,初期体系粘度及挥发性脂肪酸含量相对较低,对产甲烷体系无明显抑制作用,厌氧过程完全且有机物利用较为充分,使得回流液中可降解物质较少,对体系产气增加不明显。徐霄[13]通过渗滤液回流技术对麦秸干式厌氧消化反应进行研究,利用合适的回流比,提高纤维素和半纤维素的降解率,从而提高了厌氧发酵产气量。王星[14]研究了消化液回流比对餐厨垃圾厌氧消化的影响,发现在低负荷条件下,提高回流比可以使系统的产气量明显提高,但在高负荷条件下,较高的消化液回流比会造成挥发性有机酸积累,从而对厌氧消化反应有抑制作用。回流比及负荷高低是影响回流效果的两个重要因素,而本实验在固定回流比及有机负荷的条件下,以棉花秸秆为原料进行单发酵,沼液未经调节直接回流,结果显示到第9个HRT时,回流开始会对沼气发酵产生抑制作用,与长期沼液回流造成的粘度增加以及难降解物质积累有关,因此回流时间长短是一项重要的工艺参数。整个实验过程中,每天进料量为24 gTS,回流组单位TS产甲烷量为77.3 mL·L-1d-1,未回流组单位TS产甲烷量为82.9 mL·L-1d-1,回流使产甲烷量降低了6.8%。实验中观测到回流并未影响甲烷含量,回流组和未回流组均维持在52%~55%。
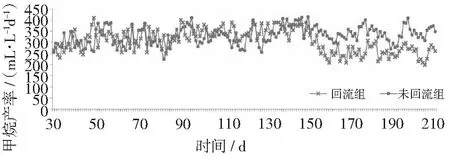
图2 甲烷产率的变化
2.2 回流对pH值和氨氮浓度的影响

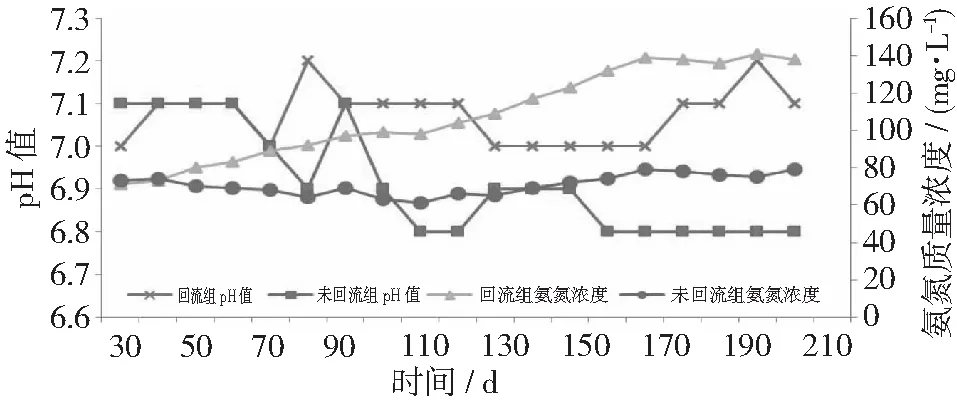
图3 反应器pH值和氨氮质量浓度的变化
2.3 回流对粘度的影响
回流开始后,回流组沼液粘度由54 mPa·s增至139 mPa·s,而未回流组粘度处于57~79 mPa·s之间(见图4)。粘度反映了液体流动时的内摩擦程度,是发酵液流变性的重要指标,能够影响厌氧反应器的整体混合行为、物质传质和热传递过程,即微生物与有机物之间的传质过程,从而影响厌氧发酵的水解和产甲烷效率。实验以棉花秸秆为原料,其具有较难降解的纤维素、木质素、半纤维素等成分,随着沼液的回流,难以充分降解的大分子物质不断积累,沼液中悬浮颗粒及胶体物质增长明显,因而使粘度增加,在一定程度上抑制了产气。
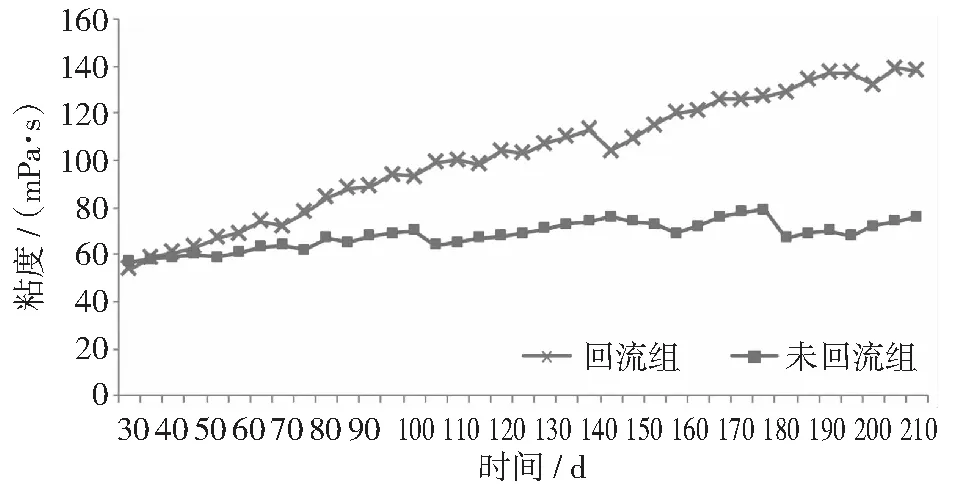
图4 反应器粘度的变化
2.4 回流对挥发性脂肪酸含量的影响
VFAs的质量浓度反映出体系中酸化和产甲烷之间的平衡,回流会导致VFAs的积累[12]。乙酸质量浓度超过1.5 g·L-1就会抑制纤维素酶的活性,从而抑制水解反应[15]。当乙酸质量浓度降到0.3 g·L-1时,嗜乙酸型甲烷菌有更高的亲和性,乙酸发酵产甲烷成为主要途径[18]。由图5~图7可知,回流组乙酸由0.1 g·L-1增长到1.6 g·L-1,而未回流组维持在0.1~0.3 g·L-1之间,说明未回流组以乙酸发酵产甲烷为主,而回流组乙酸积累到一定程度已经开始抑制纤维素的水解。丙酸氧化生成乙酸、氢和二氧化碳是吸能反应,热力学上不能自发进行[19],丙酸的积累是厌氧消化甲烷产出率低的主要原因[20],当丙酸浓度达到15 g·L-1时,会抑制50%的产甲烷活性[21]。在实验中,丙酸在回流的初始阶段浓度为0.2 g·L-1,回流一段时间后增至0.5 g·L-1,而未回流组在0.2 g·L-1左右波动,回流组虽有丙酸积累但并未到抑制产甲烷的程度,可能与较合理的进水负荷有关。乳酸在短时间乙酸化过程中,会释放较高浓度的二氧化碳和氢气,这会降低嗜氢产甲烷菌的代谢效率,降低甲烷产率[22]。实验未回流组乳酸的浓度一直维持在0.3 g·L-1左右,而回流组有明显的上升,浓度大约在1.3 g·L-1,是回流组甲烷产率较低的原因之一。

图5 乙酸质量浓度变化
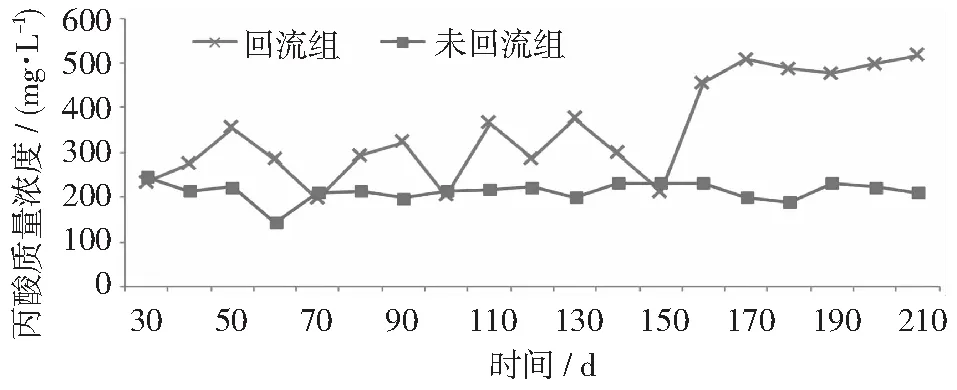
图6 丙酸质量浓度变化
2.5 回流对产甲烷体系细菌的影响
细菌16S rDNA基因克隆文库分析取样点为190天,即回流组产气受抑制阶段。通过限制酶切技术对16S rDNA基因克隆文库归类后测序。如图8所示,Ruminofilibacterxylanolyticum能够利用木聚糖,曾在以玉米、小麦秸秆为原料的沼气发酵罐中检测出来[23];Acetivibriocellulolyticus为厌氧的纤维素分解菌,主要发酵产物是乙酸、氢气和二氧化碳[24];Thermoanaerobacter能够利用包括木糖、纤维二糖、淀粉、葡萄糖和麦芽糖在内的多种碳水化合物,并且能够还原硫代硫酸盐产生硫化氢[25];Prevotellaruminicola在利用多糖、多肽及蛋白质代谢中中起着重要的作用[26],均在未回流组中发现,反映了其纤维素降解菌群的种类多样性,有利于其水解产酸,继而获得较高的产甲烷率。回流使反应器有毒物质积累,可能影响了纤维素降解菌群落多样性。
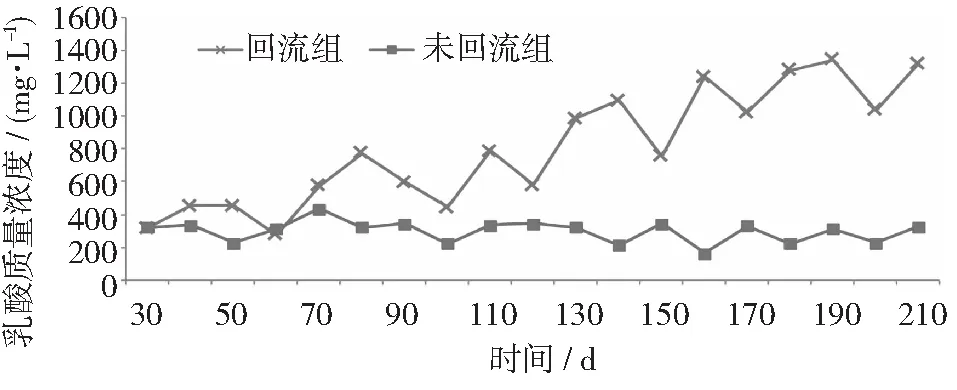
图7 乳酸质量浓度变化

注:D.第190天未回流组污泥;E.第190天回流组污泥图8 反应器16S rDNA 细菌系统发育树
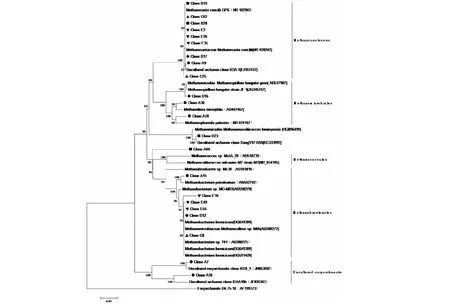
注:A.原始污泥; B.第70天未回流组的污泥; C.第70天回流组的污泥; D.第190天未回流组的污泥; E.第190天回流组的污泥图9 反应器16S rDNA 古菌系统发育树
2.6 回流对产甲烷体系古菌的影响
对原始污泥及反应器内颗粒污泥进行取样,基于16S rDNA基因序列构建的系统树如图9中所示。其中B和C为回流尚未影响产气时的取样点,D和E为回流明显抑制产气时的取样点。如表2所示,原始污泥中古菌种类丰富,经过以单一棉花秸秆为原料的驯化阶段后,嗜乙酸产甲烷菌Methanosaeta占有绝对的优势,而嗜氢产甲烷菌Methanomicrobiales和Methanobacterium丰度比较低。5个样品克隆子序列分析结果见表2。

表2 古细菌16S rDNA克隆子序列分析结果
Methanosaeta独有的丝状纤维形成特定网格结构将其他细菌联结到一起,在颗粒污泥形成过程中起到骨架、细胞联合和支配作用[27],研究表明在活性较好的颗粒污泥中Methanosaeta是主导的产甲烷菌[28]。实验以单一棉花秸秆为原料,回流组中Methanosaeta的比例不断增加,有利于污泥的颗粒化过程及难降解物质积累下系统的稳定。在回流尚未抑制产气阶段,通过分析两组在第70天的颗粒污泥中古菌比例,发现主要产甲烷菌Methanosaeta的比例相近,此时两组产甲烷率差异不大;未回流组中仍检测出Unculturedeuryarchaeote,而回流组未能检出,可能因为回流沼液中积累的有毒物质抑制了该种微生物的生长,其分类地位和代谢功能还需进一步研究。回流组中嗜氢产甲烷菌为Methanobacterium,可利用H2/CO2及甲酸生成甲烷;到了回流抑制产气阶段,回流组中Methanosaeta比例增加,与回流组乙酸浓度较高有关,在稳定厌氧发酵系统中起到重要作用。
3 结论
(1)在进水有机负荷为4 gTS·L-1d-1的条件下,沼液回流并没有增加产气,回流到第9个HRT时,回流组产气受到抑制。以棉花秸秆为原料,回流组单位TS产甲烷量为77.3 mL·L-1d-1,未回流组单位TS产甲烷量为82.9 mL·L-1d-1,回流使产甲烷量降低了6.8%。
(2)回流对pH值影响显著,回流组的pH值要高于未回流组,这主要由于回流组的氨态氮浓度高于未回流组,氨态氮作为致碱物质增强了回流组的缓冲能力;沼液粘度的增加,降低了厌氧发酵效率;回流组的VFAs要高于未回流组,其中乙酸和乳酸的积累是回流组甲烷产率较低的原因之一。
(3)未回流组纤维素分解菌种类更加丰富,是其能够有效水解纤维素,进而产甲烷率高的原因;经过长期单秸秆发酵,污泥中Methanosaeta的比例不断增加,随着回流组乙酸浓度的增加,Methanosaeta比例也在增长,对稳定沼液回流条件下的厌氧发酵体系起到重要作用。
[1] 毕于运,高春雨,王亚静,等.中国秸秆资源数量估算[J].农业工程学报,2009(12):221-227.
[2] Rubin E M.Genomics of cellulosic biofuels[J].Nature, 2008,454(726): 841-845.
[3] 杨 茜,鞠美庭,李维尊.秸秆厌氧消化产甲烷的研究进展[J].农业工程学报,2016,32(14):232-242.
[4] Shahriari H, Warith M, Hamoda M,et al. Effect of leachate recirculation on mesophilic anaerobic digestion of food waste[J].Waste Management,2012,32(3):400-403.
[5] 邓玉营,黄振兴,阮文权,等.沼液回流比与有机负荷对秸秆厌氧发酵特性的影响[J].农业机械学报,2016,47(11)198-206.
[6] Nordberg A,Jarvis A,Stenberg B,et al.Anaerobic digestion of alfalfa silage with recirculation of process liquid[J].Bioresource Technology,2007,98(1):104-111.
[7] 吴树彪,黎佳茜,李 伟,等.沼液回流对牛粪厌氧发酵产气特性及其动力学的影响[J].农业机械学报,2015, 46(10):241-246.
[8] Hu Y, Shen F, Yuan H,et al.Influence of recirculation of liquid fraction of the digestate (LFD) on maize stover anaerobic digestion[J].Biosystems Engineering,2014,127: 189-196.
[9] 贺延龄.废水厌氧生物处理[M].北京: 中国轻工业出版社,1998: 10-20.
[10] 国家环境保护总局.水和废水监测分析方法[M].北京:中国环境科学出版社,2002.
[11] 张 晗.物料更换对固定床反应器产甲烷效率及微生物群的影响[D].北京:中国农业大学:16.
[12] 卢艳娟,尤宇嘉.沼液回流对厌氧沼气工程的影响[J].中国沼气,2015,33(3): 66 -68.
[13] 徐 霄,叶小梅,常志州,等.秸秆干式厌氧发酵渗滤液回流技术研究[J].农业环境科学学报,2009,28(6):1273-1278.
[14] 王 星,王德汉,张玉帅,等.消化液回流比与有机负荷率对餐厨垃圾厌氧消化的影响[J].环境污染与防治,2006,28(10):748-752.
[15] Angsana R,Warinthom S,Annop N,et al.Combination effect of pH and acetate on enzymatic cellulose hydrolysis[J].Journal of Environmental Sciences,2009,21 (7): 965-970.
[16] Chen Y,Cheng J J,Creamer K S.Inhibition of anaerobic digestion process: a review[J].Bioresource Technology, 2008, 99(10): 4044-4064.
[17] 杜连柱, 杨继东, 张克强, 等.厌氧消化过程氨抑制研究进展[J].可再生能源, 2012(4): 75-79.
[18] Zinder S H,Koch M. Non-aceticlastic methanogenesis from acetate: acetate oxidation by a thermophilic syntrophic coculture[J].Archives of Microbiology,1984,138(3): 263-272.
[19] Schink B.Energetics of syntrophic cooperation in methanogenic degradation[J].Microbiology And Molecular Biology Reviews,1997,61 (2): 262-280.
[20] Pullammanappallil P C,Chynoweth D P,Lyberatos G,t al.Stable performance of anaerobic digestion in the presence of a high concentration of propionic acid[J].Bioresource Technology,2001,78(2): 165 -169.
[21] Dogan T,Ince O,Oz N A,et al.Inhibition of volatile fatty acid production in granular sludge from a UASB reactor[J].Journal of Environmental Science Health,Part A Toxic/hazardous Substances Environmental Engineering,2005,40 (3):633-644.
[22] Sakai S,Imachi H,Sekiguchi Y, et al.Isolation of key methanogens for global methane emission from rice paddy fields: A novel isolate affiliated with the clone cluster rice cluster[J].Appl Environ Microbiol,2007,73(13):4326-4331.
[23] Nissilä M E, Li Y, Wu S, et al. Hydrogenic and methanogenic fermentation of birch and conifer pulps[J].Applied Energy, 2012,100(4):58-65
[24] Khan A W, Meek E, Sowden L C, et al. Emendation of the genus Acetivibrio and description of Acetivibrio cellulosolvens sp. nov, a nonmotile cellulolytic mesophile[J].International journal of systematic bacteriology, 1984,34(4):419-422.
[25] Tomás A F, Karakashev D, Angelidaki I. Thermoanaerobacter pentosaceus sp. nov., an anaerobic, extreme thermophilic, high ethanol-yielding bacterium isolated from household waste[J].International journal of systematic and evolutionary microbiology, 2012.
[26] Avguštin G, Wallace R J, Flint H J. Phenotypic diversity among ruminal isolates of Prevotella ruminicola: proposal of Prevotella brevis sp. nov, Prevotella bryantii sp. nov, and Prevotella albensis sp. nov. and redefinition of Prevotella ruminicola[J].International journal of systematic bacteriology, 1997,47(2):284-288.
[27] Fernández N, Díaz E E, Amils R, et al. Analysis of microbial community during biofilm development in an anaerobic wastewater treatment reactor[J].Microbial Ecology, 2008, 56(1): 121-132.
[28] Kim W, Lee S, Shin S G, et al. Methanogenic community shift in anaerobic batch digesters treating swine wastewater[J].Water research, 2010,44(17):4900-4907.

