HSP27对Hcy诱导的血管内皮细胞损伤的保护作用及其机制研究
赵艳红,刘 涛
(商丘医学高等专科学校人体解剖学教研室,河南商丘 476100)
目前,内皮功能障碍是发生动脉粥样硬化的早期事件。经研究发现,它与动脉粥样斑块的进展有重要关系[1-2]。而内皮细胞受损时,会破坏血稳态,导致血栓形成、脂质积累,最终形成粥样斑块,因此早期控制内皮功能是防治冠心病的关键。目前已经公认,高同型半胱氨酸血症是动脉粥样硬化发生和发展的独立危险因素[3]。血浆中同型半胱氨酸(Hcy)升高会造成内皮细胞功能障碍,引起血管舒张功能异常,导致内皮细胞丧失抗血栓形成的作用,引起血小板黏附聚集,进而引发早期动脉粥样硬化。热休克蛋白27(HSP27)参与细胞凋亡、炎症和动脉壁的稳态维持等多种过程。有研究发现,HSP27在抗心肌缺血损伤、细胞凋亡及抗炎性反应中都有一定作用,还可调控平滑肌细胞的増殖迁移、稳定细胞骨架、抗凋亡[4]。LEE等[5]研究发现,HSP27在动脉粥样硬化有着不可忽视的作用,且血清中HSP27水平和动脉粥样硬化程度呈负相关。HSP27有可能作为预防和诊断动脉粥样硬化的新靶点。本研究通过实验探讨HSP27对Hcy诱导血管内皮细胞损伤的保护作用,并对HSP27相关保护机制进行分析。
1 资料与方法
1.1实验仪器及耗材
1.1.1主要仪器 二氧化碳培养箱Heracell150i(美国Thermo Scientific);超净工作台(中国苏净安泰);CH20-BIM倒置光学显微镜(日本Olympus);IX71荧光显微镜(日本Olympus);离心机(美国Thermo Scientific);流式细胞仪(美国Becton Dickinson);电热恒温水浴箱(中国上海精宏实验设备);电子分析天平(德国Sartorius);恒温磁力搅拌器(中国江苏荣华仪器制造)。
1.1.2主要试剂 细胞培养DMEM(美国Gibco);MTT细胞活性试剂(美国Invitrogen);细胞培养胎牛血清(FBS,美国Coning);AnnexinV/PI凋亡检测试剂盒(中国南京凯基);Lipofectamine 2000(美国Invitrogen);总一氧化氮检测试剂盒(碧云天公司);DCHP活性氧检测试剂盒(碧云天公司)。
1.2方法
1.2.1人脐静脉内皮细胞(HUVECs)培养及鉴定 无菌收集健康新生儿脐带,磷酸盐缓冲液(PBS)反复冲洗静脉腔后灌注0.1%胶原酶消化30 min,含10%血清的DMEM培养基终止消化,消化液1 500 r/min离心8 min后加入培养液重悬细胞,放入37 ℃ 5% CO2培养箱内培养。待细胞贴壁并85%融合后,用0.05%胰酶消化传代,继续培养。每2天进行一次细胞传代,同时更换培养液。取对数生长期的第3~5代用于实验。
1.2.2HUVECs存活率检测 培养后的HUVECs,经0.5%胰酶充分消化后接种于96孔板,10 000个/孔,放入37 ℃,5% CO2培养箱,培养24 h。按照实验分组在孔板上加入不同浓度药品,每个浓度设6个复孔,同时设立阴性对照孔。继续培养24 h后,每孔加入15 μL的5 g/L的MTT溶液,孵育4 h后,弃上清液,立即加入100 μL DMSO,充分振荡15 min,采用酶标仪波长490 nm测定各孔吸光度(A)值。HUVEC增殖率(%)=(实验组A值-对照组A值)/对照组A值×100%。Hcy组:分别加入Hcy使终浓度分别为0、0.2、0.4、0.6、0.8、1.0 mmol/L。Hcy+HSP27组:每孔分别加入Hcy使终浓度为0.8 mmol/L,并分别加入HSP27,使终浓度为0、2、4、6、8、10 μg/L。
1.2.3细胞凋亡检测 培养后的HUVECs,经0.5%胰酶充分消化后接种于96孔板,10 000个/孔,放入37 ℃,5% CO2培养箱。HSP27+Hcy组给予终浓度0.8 mmol/L的Hcy培养12 h后,将培养液更换为含有浓度为10 μg/L的HSP27,继续培养24 h。Hcy组给予终浓度0.8 mmol/L的Hcy后培养12 h后,将培养液更换为正常培养基,继续培养24 h。空白组使用正常培养基。收集各组细胞于EP管中,1 800 r/min离心5 min。用PBS对细胞清洗2次,再次1 800 r/min离心5 min。弃上清液,加入200 nL结合液重悬细胞;加入2.5 μL Annexin V-FITC,充分混匀后于室温下避光反应10 min。加入5 μL 碘化丙啶(PI)染色液,混匀后室温避光反应5 min,进行流式细胞仪检测。
1.2.4细胞培养液中NO水平检测 培养后的HUVECs,经0.5%胰酶充分消化后接种于96孔板,10 000个/孔,放入 37 ℃ 5% CO2培养箱,培养24 h。HSP27+Hcy组更换为含有浓度为0.8 mmol/L的Hcy及10 μg/L的HSP27的培养基后继续培养24 h。Hcy组更换为含有浓度为0.8 mmol/L的Hcy的培养基后继续培养24 h。空白组使用正常培养基,每组6个复孔。分别收集各组细胞培养液,离心取上清液备用。按照总一氧化氮检测试剂盒(硝酸还原酶法)说明书进行检测,计算样品中的NO浓度。
1.2.5细胞内活性氧(ROS)检测 培养后的HUVECs,经0.5%胰酶充分消化后接种于96孔板,10 000个/孔,放入37 ℃,5% CO2培养箱,培养12 h。HSP27+Hcy组更换为含有浓度为0.8 mmol/L的Hcy及10 μg/L HSP27的培养基后继续培养24 h。Hcy组更换为含有浓度为0.8 mmol/L Hcy的培养基后继续培养24 h。空白组使用正常培养基。每组6个复孔。按照试剂盒说明书进行如下操作:按照1∶1 000用DMEM培养液稀释2′,7′-二氯荧光黄双乙酸盐(DCFH-DA),终浓度为10 μmol/L。分别收集各组细胞于EP管中,1 800 r/min离心5 min;弃上清液,加入约1 mL DMEM培养液悬浮细胞,再次离心后吸除上清液;于37 ℃避光条件下加入500 μL的DCFH-DA染液,反应20 min后1 800 r/min离心5 min,采用无血清DMEM培养液洗涤2次;加入500 μL的DMEM培养液悬浮细胞,进行流式细胞仪检测。

2 结 果
2.1HUVECs生存率
2.1.1Hcy对HUVECs存活率的影响 HUVECs与不同浓度的Hcy作用后,0 mmol/L存活率均值为97.33%,Hcy 0.2 mmol/L组存活率均值为95.17%,Hcy 0.4 mmol/L组存活率均值为90.72%,Hcy 0.6 mmol/L组存活率均值为78.29%,Hcy 0.8 mmol/L组存活率均值为63.65%,Hcy 1.0 mmol/L组存活率均值为41.51%。0 mmol/L组与Hcy 0.2 mmol/L组比较,差异无统计学意义(P>0.05);Hcy 0.4、0.6、0.8、1.0 mmol/L组存活率均低于0 mmol/L,差异有统计学意义(均P<0.05),见图1。
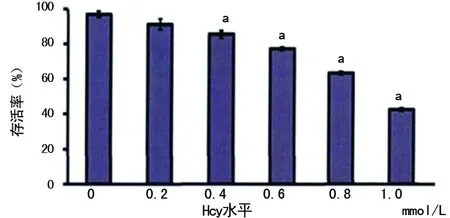
a:P<0.05,与Hcy 0 mmol/L比较
图1 Hcy对HUVECs存活率的影响
a:P<0.05,与HSP27 0 μg/L比较
图2 HSP27对HUVECs损伤的保护
2.1.2HSP27对HUVECs存活率的影响 取Hcy 0.8 mmol/L时不同浓度的HSP27与HUVECs相互作用,加入不同浓度HSP27组的内皮细胞存活率较0 μg/L组明显升高,差异有统计学意义(P<0.05),见图2。
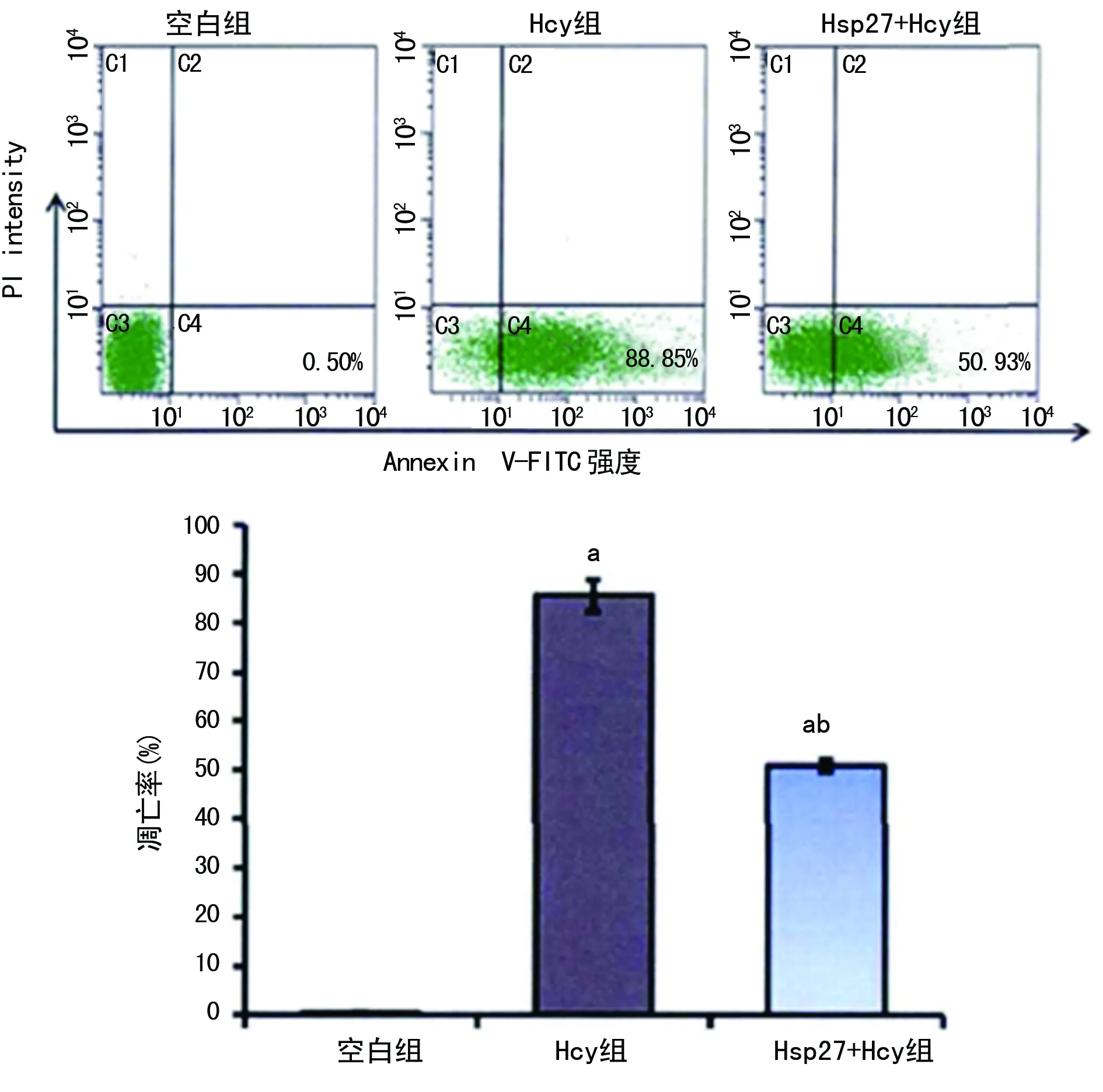
a:P<0.05,与空白组比较;b:P<0.05与Hcy组比较
图3 HSP27对Hcy诱导的HUVECs凋亡的影响
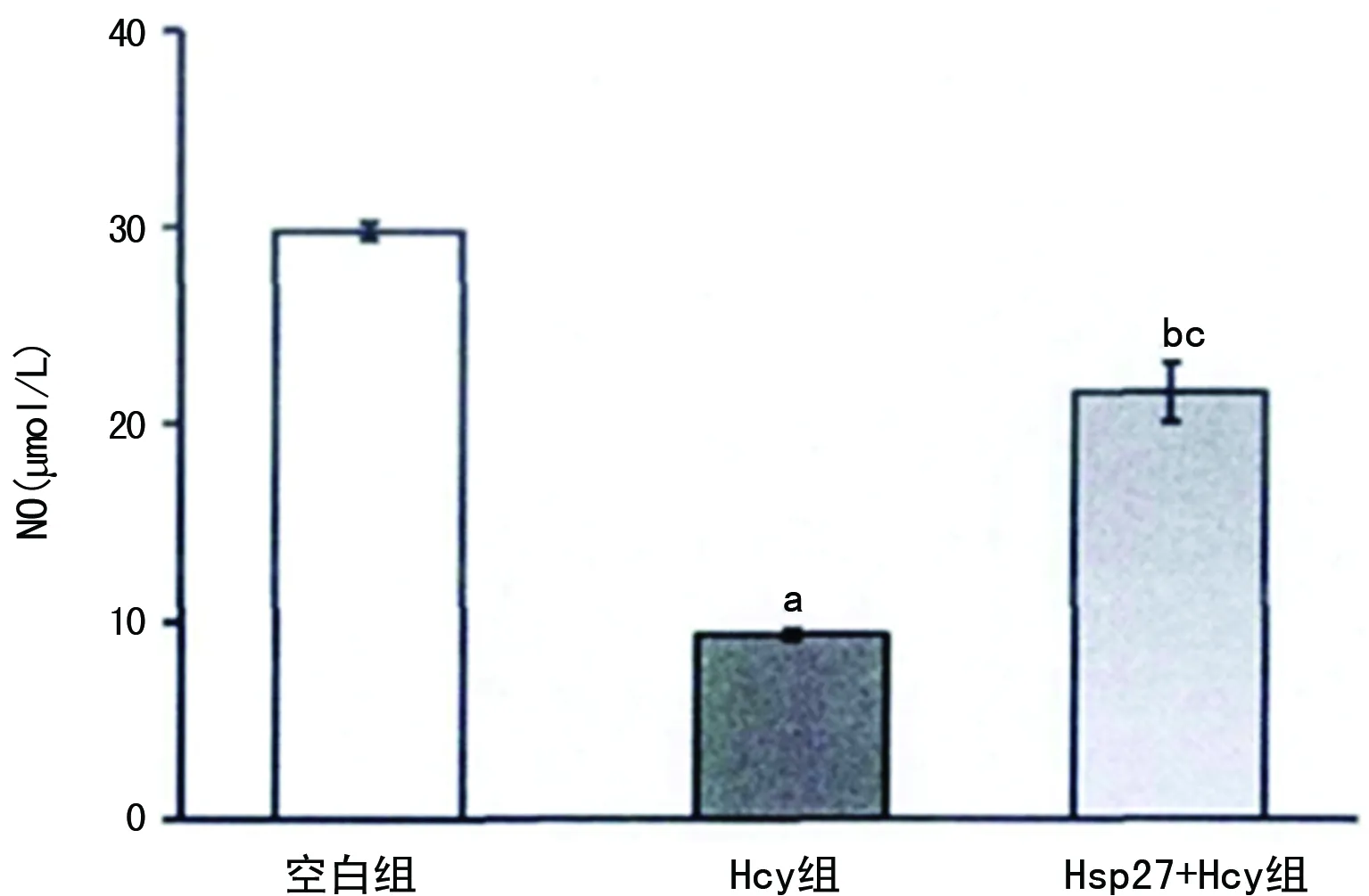
a:P<0.01,b:P<0.05,与空白组比较;c:P<0.05,与Hcy组比较
图4 HSP27对Hcy刺激HUVECs的NO水平的影响
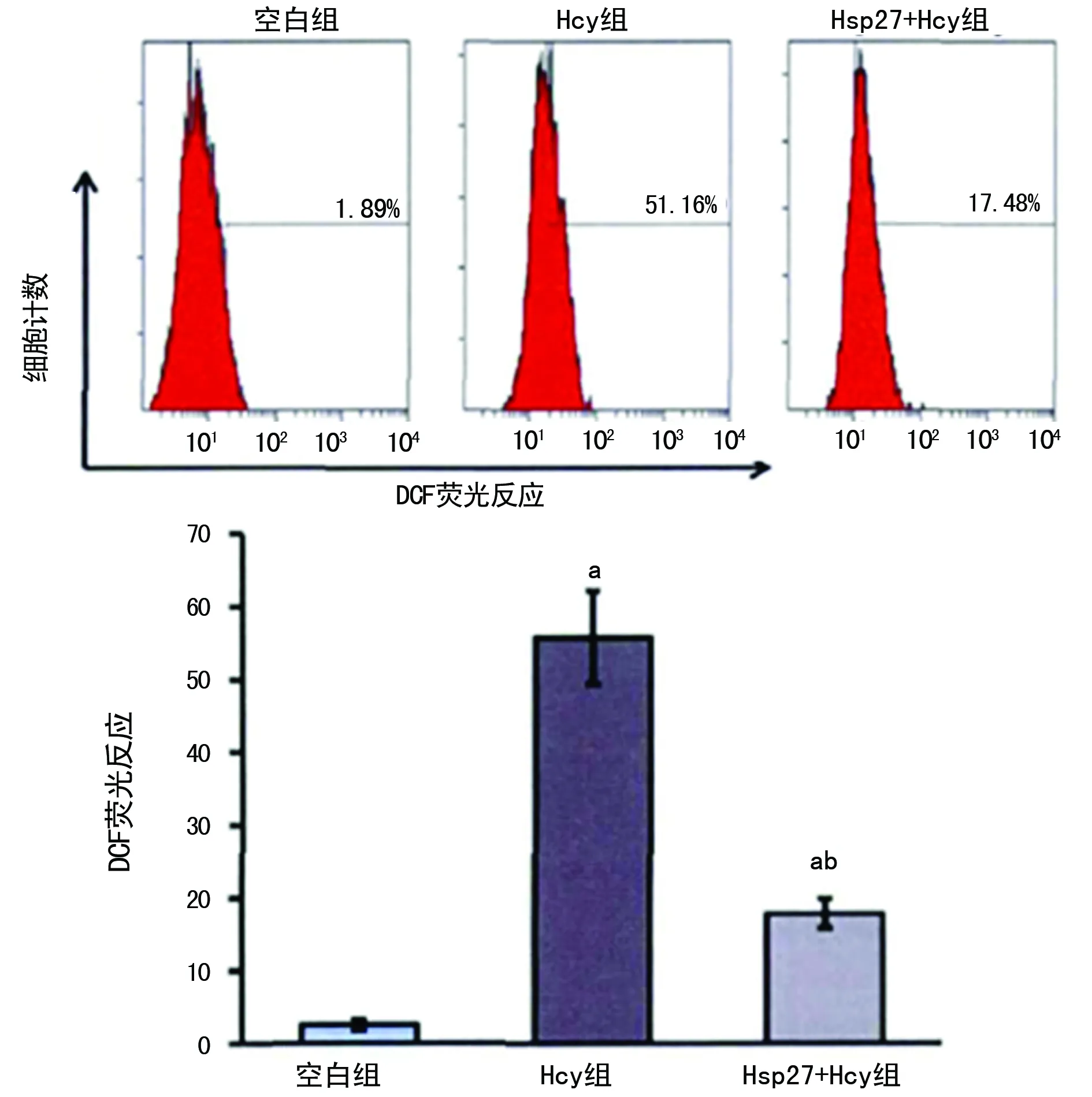
a:P<0.01,与空白组比较,b:P<0.01,与Hcy组比较
图5 HSP27对Hcy诱导的HUVECs产生ROS的影响
2.2HUVECs凋亡情况 空白组细胞凋亡率为0.5%,Hcy组细胞凋亡率为88.85%,明显高于空白组,差异有统计学意义(P<0.05);Hsp27+Hcy组细胞凋亡率为50.93%,低于Hcy组且高于空白组,差异有统计学意义(均P<0.05),见图3。
2.3NO水平 空白组NO水平29.37 μmol/L明显低于Hcy组NO水平8.94 μmol/L,差异有统计学意义(P<0.01);空白组NO水平29.37 μmol/L高于HSP27+Hcy组NO水平22.18 μmol/L,差异有统计学意义(P<0.05);Hcy组NO水平8.94 μmol/L低于HSP27+Hcy组NO水平22.18 μmol/L,差异有统计学意义(P<0.05),见图4。
2.4对Hcy诱导HUVECs产生ROS的影响 通过DCF的荧光反应程度来反映ROS的产生水平。空白组ROS水平最低,Hsp27+Hcy组次之,Hcy组ROS水平最高;Hcy组ROS水平明显高于空白组,差异有统计学意义(P<0.01);Hsp27+Hcy组高于空白组且低于Hcy组,差异具有统计学意义(均P<0.01),见图5。
3 讨 论
动脉粥样硬化是由于脂质代谢异常和慢性炎性反应所引起的动脉管壁病变。近年来,“内皮损伤反应学说”受到了广泛关注[6]。越来越多的证据显示,内皮细胞功能障碍是动脉粥样硬化与心血管疾病发展之间的一个重要病理生理环节[7]。在本研究中,联合应用Annexin V与PI可区分凋亡早期、晚期及坏死细胞的原理,发现Hcy能够减少内皮细胞的生存率,且随着Hcy浓度增高,内皮细胞的生存率越低,与Hcy浓度呈负相关。血浆Hcy水平升高是动脉粥样硬化发生与发展的独立危险因素。斑块中细胞持续凋亡会引起长期慢性炎性反应,加快斑块破裂及促进血栓形成。目前已有一些关于Hcy相关性的内皮细胞功能障碍的研究[3,8]。本研究结果显示,随着Hcy浓度的增加,细胞生存率逐渐降低,高浓度Hcy可有明显的内皮细胞生长抑制作用,Hcy能够抑制内皮细胞生存,呈剂量依赖。
目前多数研究认为Hcy导致的内皮功能障碍是动脉粥样硬化的重要机制[2,4,9]。本研究发现,Hcy能够导致内皮细胞产生NO减少,还能诱导ROS的产生。NO是内皮细胞维持血管扩张的主要调节因子,而血管内皮在成生NO过程中出现异常,使NO生成减少,导致内皮功能障碍,是动脉粥样硬化的前奏[10]。AJITH[11]研究发现,内皮细胞生成的减少及氧化应激反应增强导致的NO损失都会导致NO生物利用率下降。内皮功能障碍时,通过趋化因子、黏附分子及一系列的反应,影响NO生成。而有研究发现,动脉粥样硬化病变细胞中死亡相关蛋白激酶表达增加,会增加动脉壁不稳定性,更容易吸收低密度脂蛋白[12]。已有研究证实,死亡相关蛋白激酶参与Hcy诱导的内皮细胞凋亡过程[13]。而HSP27并不影响死亡相关蛋白激酶表达,考虑死亡相关蛋白激酶处于HSP27的调控上游。NO产生减少可作为内皮功能障碍的一个指标。本研究结果显示,HSP27浓度越高,细胞的存活率越高,呈浓度依赖性,HSP27对HUVECs损伤具有保护作用;同时采用总一氧化氮检测试剂盒对细胞培养液中NO水平进行检测,发现Hcy刺激HUVECs会抑制NO的合成或释放;加入HSP27后能减弱Hcy对内皮细胞的影响,从而改善内皮功能。还有研究发现,HSP27具有分子伴侣作用,它通过与转录因子作用,在转录水平进行调控,降低Hcy对内皮细胞功能的影响[14]。
ROS能够增强细胞氧化应激,促进炎症介质释放、低密度脂蛋白氧化,破坏凝血功能平衡等。据报道,氧化应激在内皮功能障碍发生机制中起着重要作用[15]。ROS的内源性衍生物主要由线粒体产生,当ROS过量时可造成广泛性氧化损伤,导致细胞功能丧失,甚至凋亡。ROS是细胞内信号传递者,在引起细胞凋亡中起重要作用。本研究采用DCFH-DA活性氧检测试剂盒进行细胞内ROS定量检测。通过流式细胞仪检测DCF的荧光强度就能知道细胞内ROS的水平。本研究证实,Hcy能够诱导ROS产生,引起内皮细胞功能障碍,是早期血管出现动脉粥样硬化的关键。HSP27被作为细胞保护者,已有研究证实它能够通过多个作用靶点发挥抗氧化应激和抗细胞凋亡的作用:(1)稳定线粒体膜功能;(2)改善细胞呼吸,减少ROS生成;(3)提高细胞内还原能力;(4)激活Mt,促进细胞生存。LIN等[16]为进一步研究HSP27在Hcy处理过的内皮细胞中的表达情况,通过质粒构建了HSP27高表达的内皮细胞系,证实了而HSP27表达增加能够抑制Hcy引起的内皮细胞损伤和凋亡。由此可见,减少内源性ROS产生,稳定线粒体膜电位,是HSP27对抗Hcy引起的内皮损伤的重要机制之一。
综上所述,HSP27通过影响NO表达和调节细胞内ROS水平保护Hcy诱导的受损伤的内皮细胞,这些作用提示HSP27可能是预防和治疗动脉粥样硬化的新靶点。
[1]孙永辉,位庚,贾振华,等.同型半胱氨酸对大鼠心肌微血管内皮细胞线粒体功能的影响及通心络的保护作用[J].中国老年学,2017,37(18):1-6.
[2]PELIKANT-MALECKA I,SIELICKA A,KANIEWSKA E,et al.Endothelial toxicity of unusual nucleotide metabolites[J].Pharmacol Rep,2015,67(4):818-822.
[3]朱琳,王彦军,俞天虹,等.红景天苷通过抑制内质网应激减少高同型半胱氨酸诱导的人脐静脉内皮细胞损伤[J].中国动脉硬化杂志,2015,23(1):5-10.
[4]俞天虹,朱琳,赵蓉,等.腺苷酸蛋白激酶活化在红景天苷抑制同型半胱氨酸诱导的人脐静脉内皮细胞内质网应激中的作用[J].中华中医药学刊,2017,16(10):2558-2562.
[5]LEE S W,CHO J M,CHO H J,et al.Expression levels of heat shock protein 27 and cellular FLICE-like inhibitory protein in prostate cancer correlate with Gleason score sum and pathologic stage[J].Korean J Urol,2015,56(7):505-514.
[7]纪昕,岳晓乐,赵丹丹,等.同型半胱氨酸与动脉粥样硬化患者血管内皮细胞损伤相关性[J].标记免疫分析与临床,2017,24(1):73-76.
[8]季政,郭航远,池菊芳,等.同型半胱氨酸对大鼠血管内皮细胞MMP-2表达的影响和黄酒,红葡萄酒的逆转效应及其机制[J].西安交通大学学报(医学版),2013,34(3):313-319.
[9]韩磊,王玮瑶,于洪泉,等.内质网应激途径介导同型半胱氨酸致血管内皮细胞凋亡的研究进展[J].中风与神经疾病杂志,2014,31(1):92-94.
[10]位庚,刘红利,李红蓉,等.通心络对同型半胱氨酸诱导大鼠心肌微血管内皮细胞损伤的干预作用及氧化应激机制研究[J].中国循环杂志,2016,31(9):908-912.
[11]AJITH T A.Homocysteine in ocular diseases[J].Clin Chim Acta,2015,450(2):316-321.
[12]郝宝顺,刘雪莲,刘勇,等.瑞舒伐他汀对同型半胱氨酸损伤人脐静脉内皮细胞血管细胞间黏附分子-1表达的影响[J].广东医学,2015,36(11):1646-1648.
[13]陈洪娜,唐文照,闫志晖,等.Diplacone对同型半胱氨酸致血管内皮细胞损伤的保护作用[J].中国动脉硬化杂志,2017,25(7):666-670.
[14]杨绍兵,蔡庆,王凯,等.不同浓度同型半胱氨酸对内皮细胞TRPV1蛋白表达的影响[J].宁夏医科大学学报,2017,39(4):399-402.
[15]庞柳英,陈英,王宁,等.芪参益气滴丸对原发性高血压并高同型半胱氨酸血症患者基质金属蛋白酶9及血管内皮细胞功能的影响[J].实用心脑肺血管病杂志,2017,16(5):153-155.
[16]LIN A C,LIAO C W,LIN S W,et al.Canine heat shock protein 27 promotes proliferation,migration,and doxorubicin resistance in the canine cell line DTK-F[J].Vet J,2015,205(2):254-262.

