低盐饮食对高果糖引起血管重构的保护作用*
张玲玉,李思琦,吴 东,陈浩佳,王丽京,郑凌云△
(广东药科大学:1.基础学院;2.公共卫生学院,广州 510006)
高血压是引发心血管疾病的主要危险因素之一,每年世界范围内因此死亡人数高达940万[1]。近年来研究显示,含糖甜味剂饮料摄入过多可导致高血压、肥胖及糖尿病等慢性疾病[2-3]。而蔗糖中的果糖及含糖甜味剂饮料中的高果糖浆被认为是引发上述相关疾病的主要因素[4-5]。部分动物实验已证实,饮食中的果糖可刺激钠和氯在小肠的重吸收而降低肾脏对盐的排泄从而导致盐过量而升高血压[6-9]。但到目前为止,对于果糖引起血压升高及血管重构的病理改变的机制还不十分清楚。因此,本研究目的旨在探讨低盐饮食是否能改善高果糖对血管重构的影响。
1 材料与方法
1.1动物来源 Wistar大鼠42只(雄性),6~8周龄,体质量180~200 g,无特殊病原体(SPF)级,购自广东省医学实验动物中心。
1.2主要设备和试剂 石蜡切片机(Leica,德国);全自动石蜡包埋机 (湖北亚光);全自动生物组织脱水机(TS-12N,湖北孝感宏业医用仪器公司);大鼠无创鼠尾血压测定仪(AD instruments,澳大利亚);光学显微镜(Olympus,日本);弹性纤维染色(EVG染色)试剂盒(珠海贝索生物公司);苏木素-伊红(HE)染色试剂盒(北京中杉金桥生物公司);天狼星红染色试剂盒(Sigma,美国);果糖(AMRESCO,美国);螺内酯 (每片12 mg,北京中新制药厂);APES(北京中杉金桥);兔抗大鼠α-平滑肌肌动蛋白(α-SMA,武汉博士德生物公司);兔抗大鼠纤维连接蛋白(FN,CST,美国);羊抗兔二抗(武汉博士德生物公司);DAB显色剂(赛默飞世尔科技公司)。
1.3方法
1.3.1动物模型构建 将大鼠随机分为6组,每组7只:(1)对照组给予常规标准大鼠饲料(含0.5% NaCl,w/w)及蒸馏水8周;(2)高盐组(HNa组)给予7%高盐饲料(含7% NaCl,w/w)及正常的蒸馏水;(3)高果糖组(HF组)按10%果糖水(w/v)作为饮用水,饲料同对照组;(4)高果糖联合高盐组(HFNa组)给予7%高盐饲料及10%果糖水(w/v)作为饮用水;(5)高果糖联合低盐组(HFLNa组)给予0.07%低盐饲料(含0.07%NaCl,w/w)及10%果糖水(w/v)作为饮用水;(6)高果糖联合螺内酯组(HFE组)同高果糖组,并在第4周开始给予螺内酯(HFE,50 mg·kg-1·d-1,管饲法),连续4周。
1.3.2大鼠动脉血压测定 用Powerlab血压仪测量大鼠尾根部血压。实验大鼠在正式实验前需至少进行3次血压测量训练,正式实验时分别在喂食不同饮食前1 d及喂食8周后测量记录大鼠血压值。
1.3.3血管壁组织学染色 大鼠经灌注固定后,收集各组血管,心脏组织,4%多聚甲醛固定过夜;脱水,浸蜡,包埋后,制备4 μm组织切片。常规脱蜡入水,按HE、EVG试剂盒说明书进行操作。
1.3.4血管壁组织免疫组化染色 取各组大鼠血管组织石蜡切片,脱蜡浸湿后,高压修复,室温用10%牛血清清蛋白(BSA)封闭切片2 h,于切片上滴加兔抗大鼠抗体(1∶100)湿盒内4 ℃孵育过夜,PBST洗涤两次后,滴加羊抗兔二抗(1∶200)室温孵育2 h,磷酸盐缓冲液(PBS)洗涤后显微镜下显色观察,直至出现棕黄色颗粒后即终止显色,脱水,透明后封片拍照。

2 结 果
2.1高盐饮食或高果糖水对大鼠动脉血压的影响 HF组血压(133.94±5.86)mm Hg、HNa组(128.09±7.56)mm Hg较对照组(111.03±9.17)mm Hg显著升高(P<0.05),HFNa组血压(140.97±9.75)mm Hg较HF组进一步升高(P<0.05);而HFLNa组(106.04±9.59)mm Hg及HFE组(103.99±7.12)mm Hg较HF组mm Hg降低(P<0.05)。
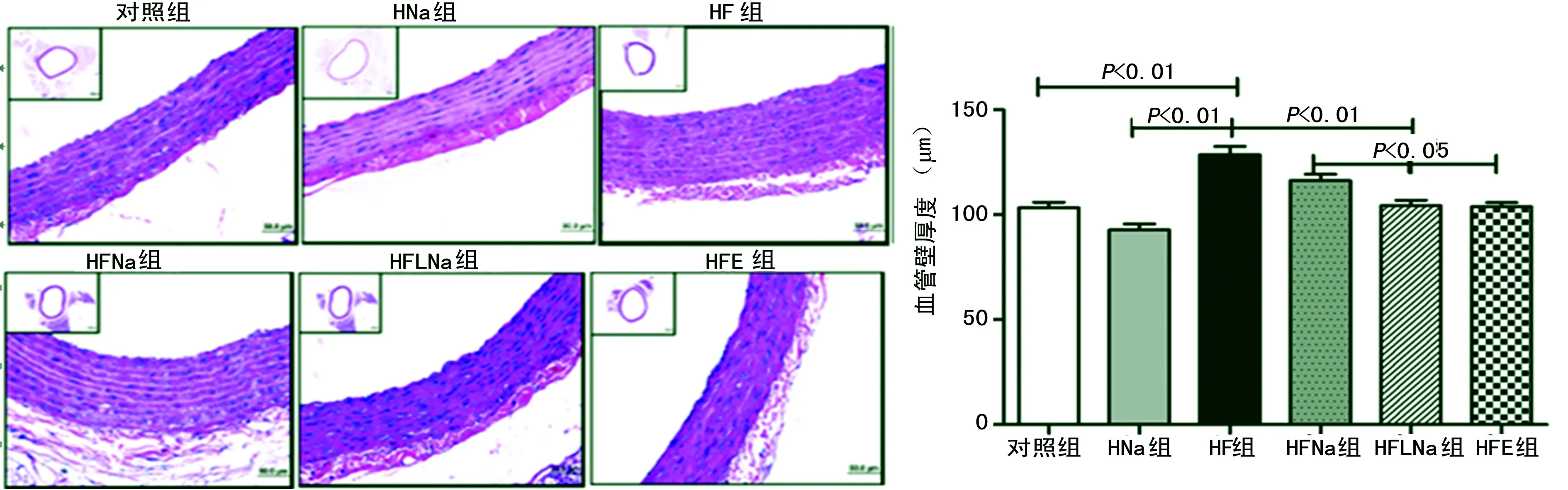
图1 血管壁组织学分析结果(HE,×40)
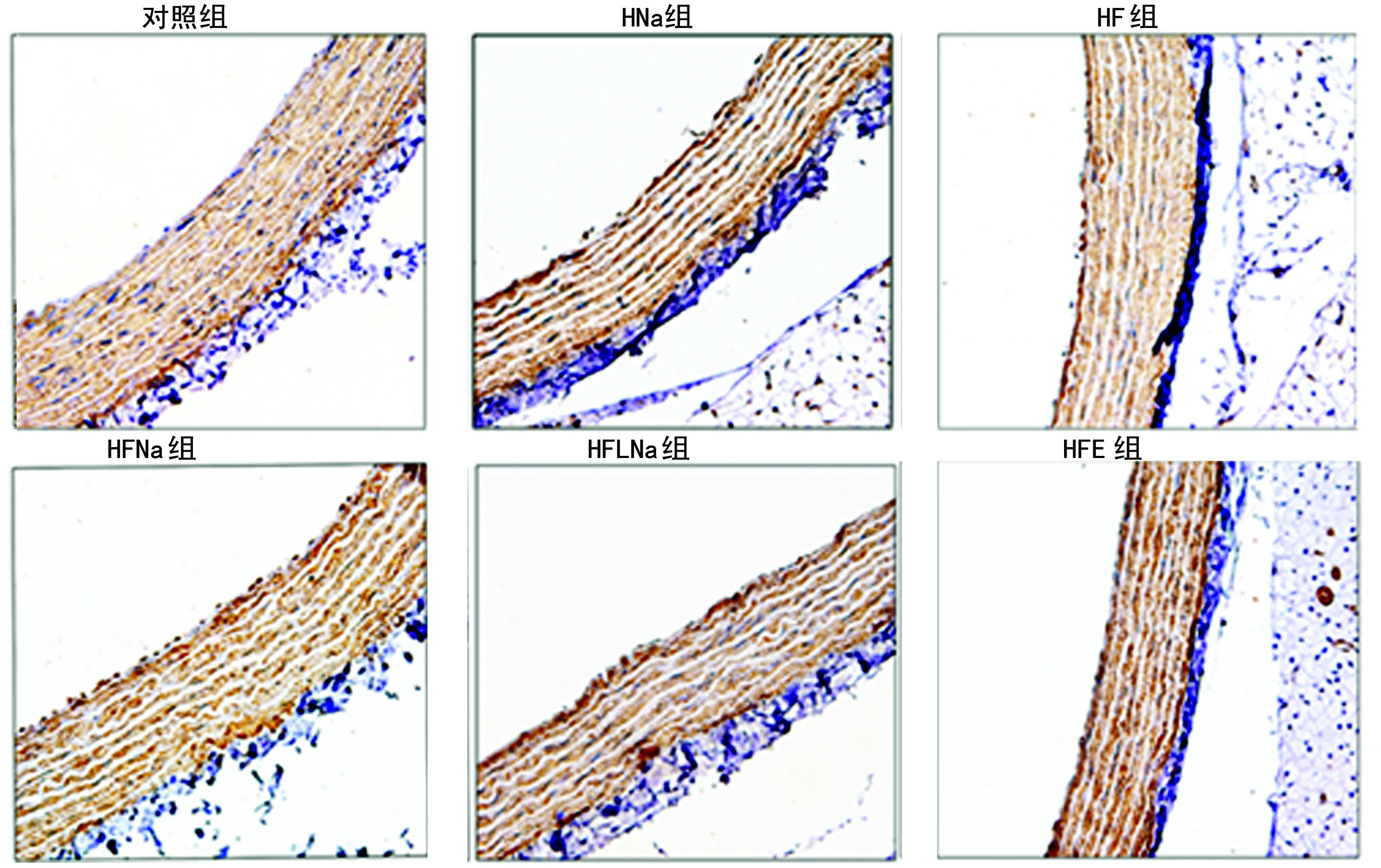
图2 血管壁α-SMA的表达变化(免疫组化×40)

图3 血管壁细胞外基质纤连蛋白表达变化(免疫组化,×40)

图4 血管壁弹力纤维结构变化(EVG,×40)
2.2血管壁HE染色 与对照组和HNa组相比,高果糖水可明显引起血管壁增厚(P<0.01);而HNa组与对照组相比,管壁厚度未见明显差异(P>0.05)。进一步分析可见高果糖联合高血也可使得血管壁增厚(P<0.01),但与HF组相比差异无统计学意义(P>0.05)。给予低盐饮食和HFE后均可显著改善高果糖诱导的血管壁增厚(P<0.01)。见图1。
2.3血管壁α-SMA免疫组化结果 HNa组阳性表达面积(0.006 1±0.000 3)或HF组阳性表达面积(0.006 3±0.000 2)较对照组阳性表达面积(0.004 6±0.000 3)明显增多(P<0.05)。而HFNa组阳性表达面积(0.008 6±0.000 3)较HF组阳性面积明显增多(P<0.05)。而HFLNa组(0.006 8±0.000 2)和HFE组(0.004 2±0.000 4)与HF组相比,可有效逆转血管壁平滑肌增生(P<0.05)。见图2。
2.4细胞外基质纤连蛋白免疫组化染色结果 与对照组相比(0.001 3±0.000 1),HNa组(0.002 6±0.000 2)和HF组(0.004 7±0.000 2)纤连蛋白表达均升高(P<0.001),且HF组和HNa组比较,高果糖促进纤连蛋白表达的作用比高盐的作用更明显(P<0.001)。见图3。
2.5血管壁弹力纤维EVG染色结果 HNa组可刺激弹力纤维增粗而HF组可刺激内膜下弹力纤维增生,而HNa组合并HF组可进一步刺激弹力纤维层数增加,低盐饮食只能部分改善弹力纤维增生的变化,相比而言,HFE则可以更好地逆转高果糖引起的弹力纤维增生。见图4。
3 讨 论
研究已证实,高果糖饮食可促进肝脏脂肪合成并诱发胰岛素抵抗[10]。胰岛素抵抗又可通过增加肾脏对钠盐重吸收促进高血压形成。CATENA等[11]的研究显示,给予高果糖饮食同时增加高盐(7.5%)饮食或正常盐(0.5%)饮食均可引起收缩压显著升高,低盐饮食(0.07%)则不会刺激血压升高。而本研究发现,利用醛固酮受体阻断剂HFE可有效降低高果糖引起的血压升高。HFE本身可通过阻止肾远曲小管上皮细胞对钠离子的重吸收而达到促尿钠排泄和阻止水分重吸收的目的。且笔者前期研究结果显示,HFE还可明显改善高果糖引起的肾损伤[12]。因此,进一步提示高果糖饮食与刺激钠盐重吸收有关。
有研究还显示,单纯高盐可通过降低肾组织中胰岛素受体表达而减少胰岛素本身对尿钠排泄的抑制作用,可能部分地解释了HNa组引起血压的升高值不及单纯高果糖饮食(HF组)的原因。而另一方面,高果糖对钠盐潴留有促进作用,且因伴随胰岛素抵抗,增加了肾脏对钠的重吸收而加重高血压形成。另外本研究结果还显示,给予高盐饲料合并高果糖水则可进一步升高血压,提示高盐和高果糖引起的血压升高机制可能并不完全一致。
血管重构是指在生理如妊娠、衰老或病理如高血压、动脉粥样硬化等状态下血管壁通过改变其结构以满足正常的组织血流供应[13]。而血管重构涉及至少4个细胞过程:血管平滑肌细胞增殖,细胞死亡,细胞迁移及细胞外基质合成或降解。血管重构发生依赖于血流动力学、局部生长因子及缩血管活性物质等多方面因素共同作用于血管壁而产生[14]。本研究结果显示,高盐虽然引起血压明显升高但血管壁厚度与对照组相比并无显著差别,但细胞外基质沉积明显增多,EVG染色显示弹力纤维较对照组有增粗的改变。研究证实血管壁内弹力纤维和细胞外基质可促使血管壁硬化,进而可引起动脉血压升高,特别是收缩压,因此这也部分解释了HNa组引起血压升高的原因。进一步分析HF组血管壁结构可以发现,高果糖可明显促进血管壁中层平滑肌细胞增生。与对照组和HNa组相比,管壁明显增厚,血管平滑肌α-SMA染色和细胞外基质染色增强,弹力纤维与对照组和HNa组相比,内膜下弹力纤维增多增粗。以上的结果表明,虽然HNa组和HF组均出现促使血压升高,但两组大鼠的血管壁结构的病理改变却有明显差异。因此提示高盐和高果糖对血管壁结构的影响不完全是由于血压升高所引起。
HFNa组大鼠的血管壁较HF组进一步增厚,且中层血管平滑肌增生明显,EVG染色显示弹力纤维增粗且层数增加,更说明高果糖与高盐对血管重构的作用机制不完全相同。而给予低盐饮食却能有效逆转由于单纯高果糖引发的血管重构。进一步分析与HFE组的比较发现,低盐饮食与HFE相似的效果是均可抑制细胞外基质沉积。但低盐饮食并不能有效减少血管壁中层平滑肌增殖和弹力纤维的变化,而HFE则可抑制高果糖引起的血管平滑肌增生和弹力纤维的改变,提示高果糖引起的血管重构不仅与促进盐的吸收导致水钠潴留有关,而且可能还与激活肾素血管紧张素醛固酮系统有关。
研究显示,高果糖饮食可引起代谢综合征,表现为大鼠动脉血压升高,胰岛素抵抗,血浆三酰甘油水平升高,高密度脂蛋白水平降低及炎症因子表达升高[15]。且研究结果还显示,给予高果糖饮食1周后主动脉内氧化应激水平即开始上升[16]。超氧阴离子通过与血管内皮释放的NO生成硝基过氧化物而减少NO的生物可利用率,加速血管内皮损伤和刺激血管平滑肌增殖[17-18],改变内皮细胞功能[19]、激活缩血管物质如内皮素-1释放[20];还可刺激交感神经系统进而加速胰岛素抵抗及高血压形成[21]。此外,高果糖饮食可造成血管炎症,增加黏附分子表达刺激单核和巨噬细胞在血管壁沉积,从而引起血管壁损伤,刺激细胞外基质沉积[22]。
本研究显示,高果糖可引起显著的血管重构,其特征以中层血管平滑肌增殖及细胞外基质沉积为主。这与以往研究所显示的高果糖引起血管壁低水平慢性炎症及血管内皮损伤等因素有密切关系。但HFE对血管重构的减轻作用也说明高果糖饮食对血管的损伤可能部分通过阻断血管壁内醛固酮受体。有研究已证实,醛固酮可促进血管重构和内皮功能损伤[23]。且有研究也显示,高盐对血管的损伤与激活醛固酮受体有密切关系[24]。尽管本研究初步证实,低盐可有效逆转高果糖引起的血压升高与血管重构,但究竟低盐通过上述何种途径改善血管重构目前还少有明确的相关报道,很可能与调控肾素-血管紧张素-醛固酮系统活性及降低血管炎症病变有关。因此,将进一步研究HFLNa组的血管组织中参与血管重构的各炎症因子和信号分子的表达变化及血管壁功能,以期找到低盐改善高果糖引起血管重构的分子机制,并在体外细胞水平进行验证。
[1]LIM S S,VOS T,FLAXMAN A D,et al.A comparative risk assessment of burden of disease and injury attributable to 67 risk factors and risk factor clusters in 21 regions,1990-2010:a systematic analysis for the Global Burden of Disease Study 2010[J].Lancet,2012,380(9859):2224-2260.
[2]JAYALATH V H,SIEVENPIPER J L,DE SOUZA R J,et al.Total fructose intake and risk of hypertension:a systematic review and meta-analysis of prospective cohorts[J].J Am Coll Nutr,2014,33(4):328-339.
[3]HU F B.Resolved:there is sufficient scientific evidence that decreasing sugar-sweetened beverage consumption will reduce the prevalence of obesity and obesity-related diseases[J].Obes Rev,2013,14(8):606-619.
[4]LUSTIG R H,SCHMIDT L A,BRINDIS C D.Public health:The toxic truth about sugar[J].Nature,2012,482(7383):27-29.
[5]JOHNSON R J,SANCHEZ-LOZADA L G,NAKAGAWA T.The effect of fructose on renal biology and disease[J].J Am Soc Nephrol,2010,21(12):2036-2039.
[6]SOLEIMANI M.Dietary fructose,salt absorption and hypertension in metabolic syndrome:towards a new paradigm[J].Acta Physiol(Oxf),2011,201(1):55-62.
[7]SOLEIMANI M,ALBORZI P.The role of salt in the pathogenesis of fructose-induced hypertension[J].Int J Nephrol,2011:392708.
[8]QUEIROZ-LEITE G D,CRAJOINAS R O,NERI E A,et al.Fructose acutely stimulates NHE3 activity in kidney proximal tubule[J].Kidney Blood Press R,2012,36(1):320-334.
[9]CABRAL P D,HONG N J,HYE KHAN M A,et al.Fructose stimulates Na/H exchange activity and sensitizes the proximal tubule to angiotensin Ⅱ[J].Hypertension,2014,63(3):e68-73.
[10]DORNAS W C,DE LIMA W G,PEDROSA M L,et al.Health implications of high-fructose intake and current research[J].Adv Nutr,2015,6(6):729-737.
[11]CATENA C,CAVARAPE A,NOVELLO M,et al.Insulin receptors and renal sodium handling in hypertensive fructose-fed rats[J].Kidney Int,2003,64(6):2163-2171.
[12]李香莉,张玲玉,郑凌云,等.螺内酯对高果糖诱发肾损伤的保护作用[J].广东医学,2016,37(24):3667-3670.
[13]GARCIA-REDONDO A B,AGUADO A,BRIONES A M,et al.NADPH oxidases and vascular remodeling in cardiovascular diseases[J].Pharmacol Res,2016,114:110-120.
[14]RENNA N F,DE LAS HERAS N,MIATELLO R M.Pathophysiology of vascular remodeling in hypertension[J].Int J Hypertens,2013:808353.
[15]ORON-HERMAN M,KAMARI Y,GROSSMAN E,et al.Metabolic syndrome:comparison of the two commonly used animal models[J].Am J Hypertens,2008,21(9):1018-1022.
[16]DELBOSC S,PAIZANIS E,MAGOUS R,et al.Involvement of oxidative stress and NADPH oxidase activation in the development of cardiovascular complications in a model of insulin resistance,the fructose-fed rat[J].Atherosclerosis,2005,179(1):43-49.
[17]PALANISAMY N,VENKATARAMAN A C.Beneficial effect of genistein on lowering blood pressure and kidney toxicity in fructose-fed hypertensive rats [J].Br J Nutr,2013,109(10):1806-1812.
[18]OKAMURA T,TAWA M,GEDDAWY A,et al.Effects of atorvastatin,amlodipine,and their combination on vascular dysfunction in insulin-resistant rats[J].J Pharmacol Sci,2014,124(1):76-85.
[19]KATAKAM P V,UJHELYI M R,HOENIG M E,et al.Endothelial dysfunction precedes hypertension in diet-induced insulin resistance[J].Am J Physiol,1998,275(3 Pt 2):R788-792.
[20]TRAN L T,MACLEOD K M,MCNEILL J H.Endothelin-1 modulates angiotensin II in the development of hypertension in fructose-fed rats[J].Mol Cell Biochem,2009,325(1/2):89-97.
[21]TRAN L T,YUEN V G,MCNEILL J H.The fructose-fed rat:a review on the mechanisms of fructose-induced insulin resistance and hypertension[J].Mol Cell Biochem,2009,332(1/2):145-159.
[22]TAN H W,XING S S,BI X P,et al.Felodipine attenuates vascular inflammation in a fructose-induced rat model of metabolic syndrome via the inhibition of NF-kappaB activation[J].Acta Pharmacol Sin,2008,29(9):1051-1059.
[23]BRIET M,BARHOUMI T,MIAN M O,et al.Aldosterone-induced vascular remodeling and endothelial dysfunction require functional angiotensin type 1a receptors[J].Hypertension,2016,67(5):897-905.
[24]CATENA C,COLUSSI G,SECHI L A.Aldosterone,organ damage and dietary salt[J].Clin Exp Pharmacol,2013,40(12):922-928.

