巨噬细胞叶酸受体β表达对博莱霉素诱导小鼠肺纤维化的影响*
姚梓平,秦慧娟,何春辉
(新疆医科大学第一附属医院中医内科,乌鲁木齐 830054)
特发性肺纤维化(IPF)是特发性间质性肺炎的常见形式,该病的病理学特点表现为肺泡上皮损伤和增生、炎性细胞浸润、成纤维细胞增生、细胞外基质沉积和瘢痕形成[1]。我国IPF患者人数为50万左右,患病人数还在持续增加。该病的治疗效果不好,预后差,5年生存率只有30%~50%。目前IPF的发病机制尚不明确。巨噬细胞浸润与多种类型的肺纤维化(PF)有关[2]。巨噬细胞能够产生趋化因子CCL2和CCL12,巨噬细胞集落刺激因子(M-CSF)和纤维化的转化生长因子(TGF-β1),间质巨噬细胞产生的促炎症或促纤维化细胞因子在IPF患者的肺中升高[3],说明巨噬细胞在IPF的发病机制中可能起到一定的作用。在动物实验中,博莱霉素常用于诱导肺损伤和纤维化来模拟研究IPF[4]。叶酸受体(FR)归为糖基磷脂酰肌醇锚定糖蛋白家族,其对叶酸和5-甲基四氢叶酸具有高亲和力,由于FRα在癌细胞中的高表达和FRβ在活化的巨噬细胞中的高表达,叶酸受体靶向药物常应用于癌症和自身免疫疾病的诊断和治疗[5]。
为了研究巨噬细胞中FRβ的表达在IPF发病中的作用机制,检测了其在常规特发性肺纤维化(UIP)患者和博莱霉素诱导PF的小鼠中肺组织内的分布,并且求证减少巨噬细胞中FRβ表达是否可以抑制博莱霉素诱导小鼠的肺纤维化,现将结果报道如下。
1 材料与方法
1.1患者肺组织标本与实验动物 UIP患者的肺组织从新疆医科大学第一附属医院的7例UIP患者的肺部中获得,UIP患者的诊断参照美国胸科学会关于IPF标准诊断[6]。对照的肺组织从5例肺癌的切除手术中获得。所有患者均签署知情同意书,此项研究也获得本院伦理委员会的批准。选取18只健康雄性C57BL/6小鼠,6~8周龄,平均(19.32±2.30)g,购于新疆医科大学动物实验中心(动物合格证号编号:XJYKDX-20160317001)。
1.2主要试剂与仪器 博莱霉素(Nihon Kayaku Co,日本),小鼠抗人FRβ单克隆抗体(mAb)(Serotec,英国),大鼠抗小鼠FRβmAb(克隆5)(Serotec,英国),抗原修复液(博士德生物,中国),小鼠抗人CD68mAb(Dako Japan Co.Kyo,日本),大鼠抗小鼠CD68mAb(Serotec,英国),兔抗小鼠TGF-β1抗体(Santa Cruz Biotechnology,美国),山羊抗小鼠CCL2抗体(Santa Cruz Biotechnology,美国),山羊抗小鼠CCL12抗体(Santa Cruz Biotechnology,美国),山羊抗小鼠肿瘤坏死因子α(TNF-α)抗体(R&D Systems,美国),dsFv抗FRβ-PE38(免疫毒素)(博士德生物,中国),VH-PE38(博士德生物,中国),MAX-PO二抗(博士德生物,中国),NovaRED试剂盒(Santa Cruz Biotechnology,美国)。CCD照相机(Nikon,日本),计算机辅助图像分析仪(Nikon,日本)。
1.3方法 将小鼠分为正常组、对照组和实验组,每组各6只,小鼠中的PF诱导参考GHARAEE-KERMANI等[7]的实验方法,使用异氟烷对6~8周龄的雄性C57BL/6J小鼠进行麻醉,然后将100 mL溶于盐水中的博来霉素(4 U/kg)滴入小鼠的气管。博来霉素滴注第3天,经鼻给予小鼠dsFv抗FRβ-PE38(免疫毒素)(实验组)或VH-PE38(对照蛋白)(对照组)。每只小鼠每隔1 d给予浓度为0.1 mg/mL的免疫毒素或对照蛋白30 μL,直到博来霉素滴注后第19天,并持续监测21 d。在第21天,依然存活的小鼠被处死。正常组的小鼠不做任何处理。小鼠的左肺用于组织学分析,右肺用于羟脯氨酸分析。所有动物程序均符合本院动物实验伦理准则,并经本院委员会批准。
1.3.1肺部纤维化评分 将小鼠左肺进行冰冻,切片,冷丙酮固定处理,然后依循Masson三色法步骤染色。每只小鼠制备至少4个切片,每个切片中随机选择20个区域,遵循盲法原则,由经验丰富的病理学家阅片评定。根据Ashcroft法对肺纤维化程度进行评分[8]。
1.3.2肺部羟脯氨酸分析 将小鼠右肺经空气干燥、称重后,在110 ℃条件下,将其置于6 mol/L的HCl溶液中进行酸水解,时间为16 h。将水解产物悬浮在等量的6 mol/L NaOH中,然后过滤,测定羟脯氨酸的浓度。
1.3.3免疫组化染色 经过甲醛固定、石蜡包埋、脱蜡及再水化过程,制备得到人肺组织切片(5 μm)。根据厂家的说明书,使用区分自然感染动物和接种免疫动物(DIVA)的试剂对抗原进行修复。在用3%脱脂乳和10%正常山羊血清封闭抗原后,再利用鼠抗人CD68单抗,或鼠抗人FRβ单抗,或同型匹配但并不相关的单抗对切片进行免疫染色。然后用MAX-PO二抗和NovaRED试剂盒进一步染色处理。使用0.3% H2O2消除内源性过氧化物酶活性。最后经数字视像CCD照相机拍摄和计算机辅助图像分析仪分析后,获得图像。
利用鼠抗CD68、鼠抗FRβ、抗TGF-β1、抗TNF-α、CCL2、CCL12或同型匹配的无关抗体,对经博来霉素滴注处理或未处理小鼠的肺组织所制备的丙酮冰冻切片进行染色。然后速行双色免疫组化染色。切片用一代mAb染色后,继而用NovaRED显色。将切片置入0.1 mol/L的Gly-HCl缓冲液孵育1 min后,以此洗脱一抗,然后使用TBST(20 mmol/L Tris-HCl,pH 7.4,0.15 mol/L NaCl,0.1% Tween-20)洗涤。随后,依次先将切片与另一原代mAb孵育1 h,然后与生物素化的二抗(Nichirei)孵育30 min,最后与碱性磷酸酶缀合的链霉亲和素(Nichirei)孵育。二抗染色后利用Vector Blue显色处理。每块肺组织选取4个切片,应用计算机辅助图像分析仪对每个切片进行半定量分析。每个切片随机选定10个区域进行观察分析。通过取样界定免疫染色的颜色阈值,以此检测区分红色和蓝色,并将该阈值应用于所有的样本。
1.4统计学处理 绘制Kaplan-Meier曲线,并进行广义Wilcoxon检验,以此评估生存率的显著性。方差分析(ANOVA)用于检验组间其他数据的差异。以P<0.05为差异有统计学意义。
2 结 果
2.1巨噬细胞中FRβ表达在UPF患者和博来霉素诱导PF小鼠肺组织中的分布 检测UPF患者肺组织内的巨噬细胞时,发现其相对正常肺组织有更多能够表达FRβ的间质巨噬细胞(图1)。博来霉素气管内滴注后3 d的小鼠肺部可见表达FRβ的肺泡巨噬细胞和间质巨噬细胞,而在14 d后两种细胞数量达到顶峰(图2)。在博来霉素滴注后的每个观测时间点,都可以看到巨噬细胞中FRβ表达主要集中于肺的纤维化病灶处。
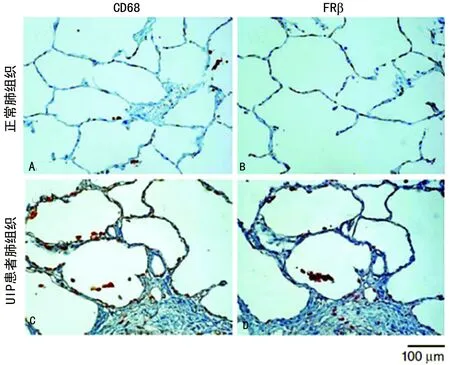
A:正常肺组织表达CD68巨噬细胞;B:UIP患者肺组织表达CD68巨噬细胞;C:正常肺组织表达FRβ的巨噬细胞;D:UIP患者肺组织表达FRβ的巨噬细胞
图1巨噬细胞中FRβ表达在UPF患者肺部的分布情况(×200)
2.2TGF-β1在巨噬细胞FRβ表达中的表达 采用博莱霉素滴注后第7天的小鼠肺部切片来检测巨噬细胞中FRβ表达是否会释放TGF-β1,发现大多数巨噬细胞中FRβ表达都属于表达CD68的巨噬细胞,许多巨噬细胞中表达CD68或FRβ的同时也能表达TGF-β1,TGF-β1的表达比例在巨噬细胞的FRβ表达中显著高于CD68的巨噬细胞表达(图3)。TGF-β1表达多聚集于博来霉素诱导形成PF的小鼠肺组织的巨噬细胞的FRβ表达中。

图2博来霉素诱导PF小鼠肺部巨噬细胞中FRβ表达随时间的变化(×200)
2.3免疫毒素作用于 FRβ时对博来霉素诱导形成PF病理过程的干预 滴注博来霉素的第3天到第19天,通过小鼠鼻内途径给予免疫毒素,与给予蛋白的对照组相比,实验组的免疫毒素能明显增加小鼠的存活率(P=0.003)(图4),同时也能降低小鼠肺组织的纤维化程度(P=0.014);实验组肺组织巨噬细胞的FRβ表达也减少(P=0.000),实验组肺组织羟脯氨酸的整体水平显著低于对照组(P=0.009)(图5)。在第21天,与给予蛋白的对照组相比免疫毒素能降低博莱霉素诱导的PF小鼠肺部TNF-α,趋化因子CCL2和CCL12细胞的数量(均P=0.000)(图6、7)。
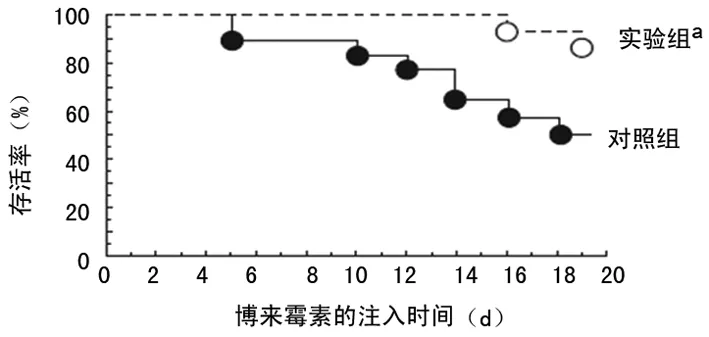
a:P<0.05,与对照组相比
图4免疫毒素对博来霉素诱导PF小鼠的存活率的影响
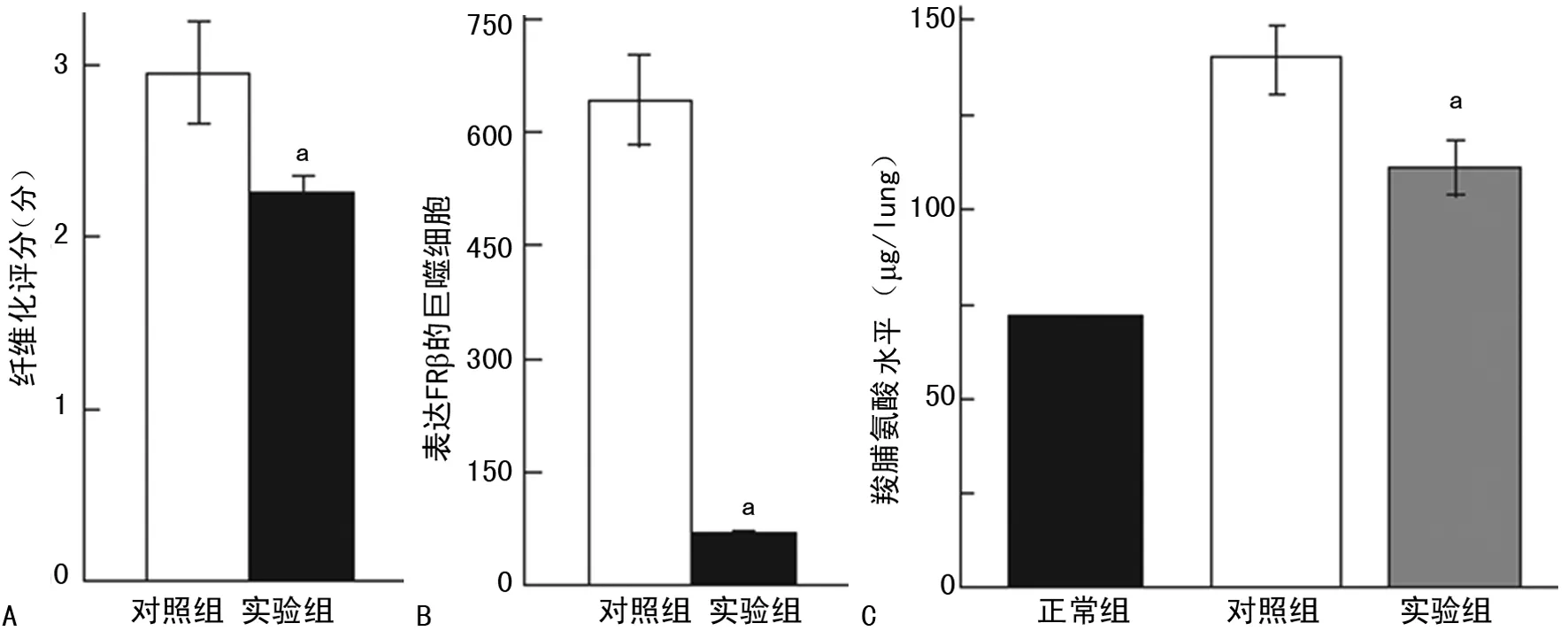
A:免疫毒素对博来霉素诱导PF小鼠的纤维化程度的影响;B:免疫毒素对博来霉素诱导PF小鼠巨噬细胞的FRβ表达影响(相对表达量);C:免疫毒素对博来霉素诱导PF小鼠羟脯氨酸水平的影响;a:P<0.05,与对照组相比
图5免疫毒素对博来霉素诱导PF小鼠的纤维化程度、巨噬细胞的FRβ表达及羟脯氨酸水平的影响
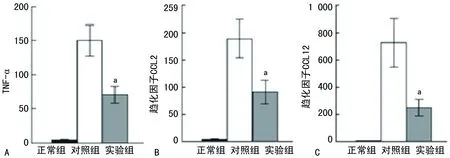
A:TNF-α的细胞数量;B:趋化因子CCL2的细胞数量;C:趋化因子CCL12的细胞数量;a:P<0.05,与对照组相比
图7免疫毒素对博莱霉素诱导的PF小鼠肺部TNF-α、趋化因子CCL2和CCL12细胞数量的影响(相对表达量)
3 讨 论
本研究中发现,与正常肺组织相比,UIP患者的肺组织中可以观察到大量能表达FRβ的间质巨噬细胞和肺泡巨噬细胞。正常组织的巨噬细胞中FRβ表达很有限,巨噬细胞的FRβ表达主要存在于博来霉素诱导形成PF的纤维化病灶中。随着PF的进展,博来霉素诱导小鼠肺组织中巨噬细胞的FRβ表达数目逐渐增加。表达FRβ的巨噬细胞在PF肺部中首次出现,小鼠经鼻内滴注免疫毒素,能够减少肺内羟脯氨酸的含量以及减轻肺纤维化的程度,从而增加了博来霉素诱导实验鼠的存活率。
由巨噬细胞释放的TGF-β1被认为可作用于局部的成纤维细胞[9]。本研究中发现,在博来霉素诱导形成PF的早期,巨噬细胞的FRβ表达会释放TGF-β1,这表明这些细胞可能直接参与小鼠PF的发病过程。在第14天用免疫毒素也未能提高PF小鼠的存活率,这可能与其他细胞产生TGF-β1相关。研究结果表明,表达FRβ的巨噬细胞产生的TGF-β1可能主要作用于博来霉素诱导PF发病过程的初始阶段。
由巨噬细胞和上皮细胞产生的CCL2、CCL12和CCL3趋化因子已确定为促纤维化介质[10]。CCR2(CCL2和CCL12的受体)或CCR5(CCL3的受体)的缺乏能抑制纤维化的发展[11]。白细胞介素(IL)-13已被证明有助于PF的发展,其可能通过诱导CCL2、CCL3而实现[12-13]。本研究发现,经鼻给予免疫毒素可减少促纤维化细胞因子TNF-α、CCL2和CCL12的细胞数量,降低博来霉素诱导PF中巨噬细胞的FRβ表达,可减少由炎症巨噬细胞所释放的各种促纤维化细胞因子。因此,靶向消除巨噬细胞的FRβ表达将比靶向消除个体巨噬细胞所释放的促纤维化细胞因子更有效。
有研究表明,使用抗CD11b 或抗CD11a的mAb能够对博来霉素诱导小鼠形成的PF起到抑制作用[14]。然而,这些治疗可能会抑制先天免疫,因为CD11a、CD11b位于单核细胞和驻留型巨噬细胞。有研究表明,使用CD11b的单克隆抗体治疗,会加重大肠杆菌肺炎小鼠的病情[15]。与表达CD11b或 CD11a的细胞相反,正常组织的巨噬细胞中FRβ表达是很有限的。因此,通过FRβ靶向清除炎症巨噬细胞对于治疗IPF患者是非常理想的治疗办法,同时该治疗方式也不会影响单核细胞和驻留型巨噬细胞的正常功能。随着免疫核糖核酸酶(immuneRNase)的发现,且其中的毒素部分和免疫球蛋白片段分别被人类核糖核酸酶和人源化免疫球蛋白替代后[16],作用于FRβ的免疫毒素的毒性和免疫原性这一缺陷也将被克服。一旦免疫RNA酶中的RNase部分被内化,其将发挥RNA降解活性,从而导致靶细胞的死亡。由于正常组织不表达或低水平表达叶酸受体,而大多数叶酸受体对FRα比对FRβ具有更高的结合亲和力,因此也可使用叶酸拮抗剂[17]。IPF具有异质性特征,其表现为在正常表观的肺部中交替出现外周纤维化、间质炎症和蜂窝状态改变的区域。这些炎症成分主要由巨噬细胞、淋巴细胞、浆细胞、嗜中性粒细胞和嗜酸性粒细胞组成[18]。在诊断IPF时,若不行肺部穿刺活检,则很难确定激活的巨噬细胞的分布。由于放射性叶酸靶向药物与叶酸受体结合其主要集中于激活的巨噬细胞[19]。因此通过FolateScan对表达FR细胞的图像化[20],将有助于预测最佳治疗时机和监测靶向治疗巨噬细胞的FRβ表达对IPF患者的疗效。
综上所述,人和PF实验动物肺部的炎性巨噬细胞均可表达FRβ。选择性降低巨噬细胞的FRβ表达能显著抑制博来霉素诱导PF的病理过程,因此也意味着靶向治疗表达FRβ的巨噬细胞可能会为IPF的治疗带来希望。
[1]WILSON M S,WYNN T A.Pulmonary fibrosis:pathogenesis,etiology and regulation[J].Mucosal Immunol,2009,2(2):103-121.
[2]QU Y,ZHANG G,JI Y,et al.Protective role of gambogic acid in experimental pulmonary fibrosis in vitro and in vivo[J].Phytomedicine,2016,23(4):350-358.
[3]HOMOLKA J,ZIEGENHAGEN M W,GAEDE K I,et al.Systemic immune cell activation in a subgroup of patients with idiopathic pulmonary fibrosis[J].Respiration,2003,70(3):262-269.
[4]LI X W,LI X H,DU J,et al.Calcitonin gene-related peptide down-regulates bleomycin-induced pulmonary fibrosis[J].Can J Physiol Pharmacol,2016,94(12):1315-1324.
[5]DELLA-LONGA S,ARCOVITO A.Intermediate states in the binding process of folic acid to folate receptor α:insights by molecular dynamics and metadynamics[J].J Comput Aided Mol Des,2015,29(1):23-35.
[6] American Thoracic Society.Idiopathic pulmonary fibrosis:diagnosis and treatment.International consensus statement.American Thoracic Society(ATS),and the European Respiratory Society(ERS)[J].Am J Respir Crit Care Med,2000,161(2 Pt 1):646-664.
[7]GHARAEE-KERMANI M,ULLENBRUCH M,PHAN S H.Animal models of pulmonary fibrosis[J].Methods Mol Med,2005,117:251-259.
[8]ASHCROFT T,SIMPSON J M,TIMBRELL V.Simple method of estimating severity of pulmonary fibrosis on a numerical scale[J].J Clin Pathol,1988,41(4):467-470.
[9]ZHANG Y,WANG J,LI H,et al.Hydrogen sulfide suppresses transforming growth factor-β1-induced differentiation of human cardiac fibroblasts into myofibroblasts[J].Sci China Life Sci,2015,58(11):1126-1134.
[10]WU X,GUAN Y,YAN J,et al.ShenKang injection suppresses kidney fibrosis and oxidative stress via transforming growth factor-β/Smad3 signalling pathway in vivo and in vitro[J].J Pharm Pharmacol,2015,67(8):1054-1065.
[11]MOORE B B,KOLODSICK J E,THANNICKAL V J,et al.CCR2-mediated recruitment of fibrocytes to the alveolar space after fibrotic injury[J].Am J Pathol,2005,166(3):675-684.
[12]MURRAY L A,ZHANG H,OAK S R,et al.Targeting interleukin-13 with tralokinumab attenuates lung fibrosis and epithelial damage in a humanized SCID idiopathic pulmonary fibrosis model[J].Am J Respir Cell Mol Biol,2014,50(5):985-994.
[13]DING M,SHENG H,SHEN W,et al.Association of the SNP rs1800925(C/T)in the interleukin-13 gene promoter with pulmonary function in Chinese Han patients with idiopathic pulmonary fibrosis[J].Cell Biochem Biophys,2013,67(3):905-909.
[14]SKURIKHIN E G,KHMELEVSKAYA E S,ERMAKOVA N N,et al.Effect of spiperone on mesenchymal multipotent stromal and hemopoietic stem cells under conditions of pulmonary fibrosis[J].Bull Exp Biol Med,2014,157(1):132-137.
[15]BELPERIO J A,DY M,BURDICK M D,et al.Interaction of IL-13 and C10 in the pathogenesis of bleomycin-induced pulmonary fibrosis[J].Am J Respir Cell Mol Biol,2002,27(4):419-427.
[16]PULIDO D,MOUSSAOUI M,NOGUES M V,et al.Towards the rational design of antimicrobial proteins:single point mutations can Switch on bactericidal and agglutinating activities on the RNase A superfamily lineage[J].FEBS J,2013,280(22):5841-5852.
[17]YANG T Y,CHANG G C,HSU S L,et al.Effect of folic acid and vitamin B12 on pemetrexed antifolate chemotherapy in nutrient lung cancer cells[J].Biomed Res Int,2013(2013):389046.
[18]FARBER S.FARBER S.Some observations on the effect of folic acid antagonists on acute leukemia and other forms of incurable cancer.Blood.1949;4(2):160-167[J].Blood,2016,127(3):271.
[19]GUARIENTO A H,FURTADO K S,DE CONTI A,et al.Transcriptomic responses provide a new mechanistic basis for the chemopreventive effects of folic acid and tributyrin in rat liver carcinogenesis[J].Int J Cancer,2014,135(1):7-18.
[20]MATTESON E L,LOWE V J,PRENDERGAST F G,et al.Assessment of disease activity in rheumatoid arthritis using a novel folate targeted radiopharmaceutical Folatescan[J].Clin Exp Rheumatol,2009,27(2):253-259.

