VEGF、TNF-α、miR-18a和MCM7在子宫肌瘤组织中的表达及临床意义
张冬红,刘恩令
(河北省唐山市工人医院妇产科 063000)
子宫肌瘤为女性生殖系统常见的一种良性肿瘤,可导致患者出现疼痛、盆腔压迫症状以及子宫异常出血等,对患者生育能力造成一定影响,且部分患者如不及时治疗可能会发生恶性病变[1]。了解子宫肌瘤发病原因及机制有助于更好地治疗本病,不过目前尚未完全清楚子宫肌瘤的发病机制。微小染色体维持蛋白(MCM)已被证实为机体的一种DNA复制管制复合物,MCM7为MCM家族重要成员,在多种疾病中呈高表达[2]。微小核糖核酸(miRNA)为广泛存在于真核生物细胞中非编码单链性的小分子RNA,在激素依赖性疾病、肿瘤以及自身免疫性疾病发生和发展中起到了重要作用[3]。血管内皮生长因子(VEGF)是促血管生成因子的一种,在子宫肌瘤患者中其血清水平明显升高[4]。同时,子宫肌瘤与炎症有密切关系,炎症细胞浸润可能在子宫肌瘤发病中起到了重要促进作用[5]。本研究分析了VEGF、肿瘤坏死因子-α(TNF-α)、微小核糖核酸-18a(miR-18a)和MCM7在子宫肌瘤组织中的表达及临床意义,旨在为子宫肌瘤防治提供新的线索与依据。现报道如下。
1 资料与方法
1.1一般资料 选取本院2015年1月至2017年6月收治的43例行子宫肌瘤切除术患者的手术切除标本作为子宫肌瘤组织,距离子宫肌瘤至少1 cm处取子宫肌层组织作为正常子宫肌层组织。患者入选标准:(1)均行子宫肌瘤切除术;(2)均经病理学诊断为子宫肌瘤;(3)年龄在50岁以上;(4)绝经至少1年。排除标准:(1)入组前3个月使用过激素类药物者;(2)伴有恶性肿瘤者;(3)合并甲状腺疾病、糖尿病者;(4)合并子宫其他器质性病变者;(5)合并免疫系统疾病、感染性疾病者。43例患者年龄52~78岁,平均(67.32±5.29)岁;肌瘤直径3~14 cm,平均(7.89±2.06)cm;肌瘤数目1~5个,平均(1.83±0.45)个;肌瘤分型:浆膜下肌瘤11例,肌壁间肌瘤23例,混合型肌瘤9例。
1.2主要试剂 VEGF、TNF-α、MCM7抗体均购自英国Abcam公司,Has-miR-18a miRCURY LNA Detection probe以及地高辛标记LNA miR-18a均购自丹麦Exiqon公司,抗原修复液、二氨基联苯胺酶底物显色试剂盒、SP免疫组织化学染色试剂盒、Tris-HCl缓冲盐溶液、二氨基联苯胺、磷酸盐缓冲液均购自大连宝生物公司。
1.3方法
1.3.1标本采集及处理 以子宫肌瘤中心和肌瘤边缘连线的中间处选取直径2~10 cm的子宫肌瘤组织,距离子宫肌瘤至少1 cm处取子宫肌层组织,大小为1.0 cm×1.0 cm×0.5 cm;标本采集完成之后,立即放置于10%中性甲醛溶液中内固定12~24 h,采取石蜡包埋法并连续切片,切片厚度为3~4 μm。
1.3.2miR-18a表达测定 通过原位杂交法测定miR-18a表达情况,将石蜡包埋组织石蜡并水化,取柠檬酸盐抗原进行修复,温度为49.5 ℃,取杂交缓冲液进行预杂交,时间为2 h,然后加入地高辛标记的miRCURY probes过夜。加入辣根过氧化物酶标记的抗地高辛抗体,水平为1∶200,孵育过夜,温度为4 ℃。取Tris-HCl缓冲盐溶液进行冲洗,在暗室中加入染色溶液,然后孵育24 h。达到预期亮度后将载玻片转移至终止液终止反应,进行苏木复染。
1.3.3VEGF、TNF-α、MCM7、孕激素受体(PR)、雌激素受体(ER)测定 取二甲苯将石蜡包埋、切片、脱蜡至去离子化,取乙二胺四乙酸修复缓冲液进行修复,然后打孔剂洗涤,采用3%过氧化氢进行室温孵育,时间为10 min,取磷酸盐缓冲液洗涤,再分别滴加一抗,孵育过夜,温度为4 ℃。再次取磷酸盐缓冲液进行洗涤,滴加二抗,孵育30 min,温度37 ℃。磷酸盐缓冲液洗涤后采用二氨基联苯胺进行显色,然后冲洗,取苏木素进行复染,采用洗洁精、梯度乙醇及中性树胶分别进行洗片、脱水及封片。
1.3.4表达结果评价 按照阳性细胞的比例进行结果判定,不染色或者阳性细胞比例在5%以下为阴性(-);阳性细胞比例在10%~25%为弱阳性(+);阳性细胞比例在>25%~50%为中等阳性(++);阳性细胞比例在>50%,且染色分布呈弥散表现为强阳性(+++)。

2 结 果
2.1不同子宫组织各指标阳性表达结果比较 子宫肌瘤组织VEGF、TNF-α、MCM7、PR、ER阳性率分别为74.42%、62.79%、67.44%、79.07%和72.09%,均明显高于正常子宫肌层组织(P<0.05);miR-18a阳性率为30.23%,明显低于正常子宫肌层组织(P<0.05)。见表1。
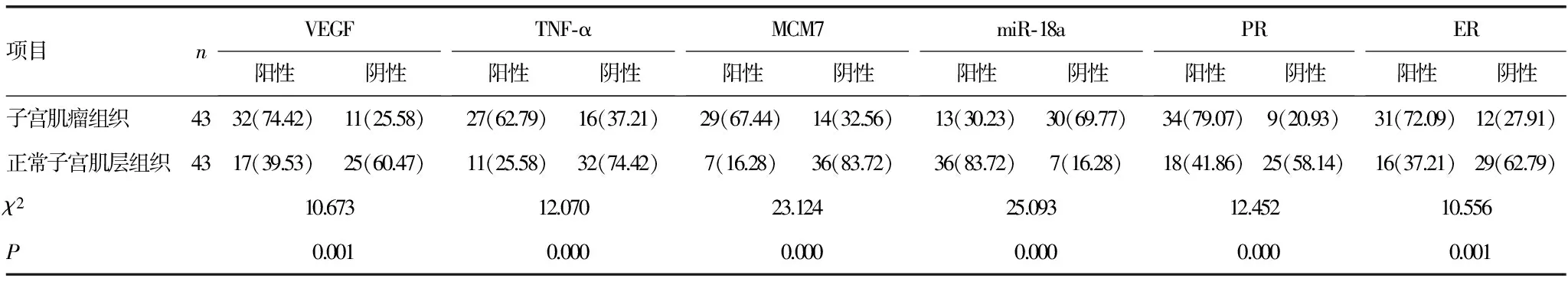
表1 不同子宫组织各指标阳性表达结果比较[n(%)]
2.2PR水平与VEGF、TNF-α、MCM7、miR-18a在子宫肌瘤组织中的相关性 Spearman相关分析结果显示,PR水平与VEGF、TNF-α、MCM7均呈正相关(P<0.05),与miR-18a呈负相关(P<0.05)。见表2。
2.3ER水平与VEGF、TNF-α、MCM7、miR-18a在子宫肌瘤组织中的相关性 Spearman相关分析结果显示,ER水平与VEGF、TNF-α、MCM7均呈正相关(P<0.05),与miR-18a呈负相关(P<0.05)。见表3。
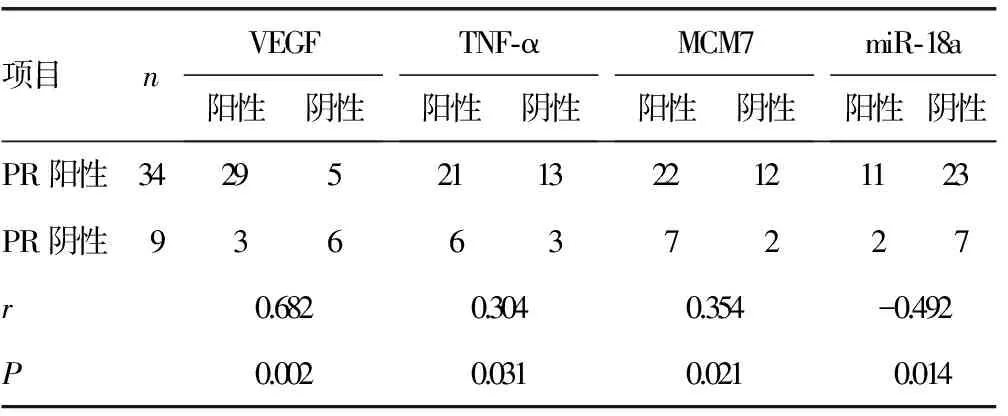
表2 PR水平与VEGF、TNF-α、MCM7、miR-18a在子宫肌瘤组织中的相关性(n)
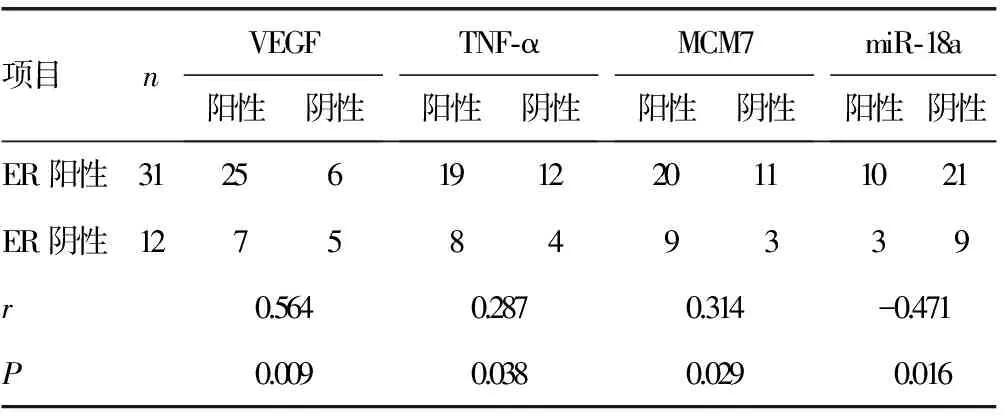
表3 ER水平与VEGF、TNF-α、MCM7、miR-18a在子宫肌瘤组织中的相关性(n)
2.4不同病例特征间VEGF、TNF-α、MCM7、PR、ER阳性率比较 肌瘤直径>8 cm、肌瘤数目>3个的VEGF、TNF-α、MCM7阳性率明显高于肌瘤直径≤8 cm、肌瘤数目≤3个的阳性率;肌瘤直径>8 cm、肌瘤数目>3个的miR-18a阳性率明显低于肌瘤直径≤8 cm、肌瘤数目≤3个的阳性率,差异均有统计学意义(P<0.05);不同年龄、肌瘤分型的VEGF、TNF-α、MCM7、PR、ER阳性率比较,差异均无统计学意义(P>0.05)。见表4。
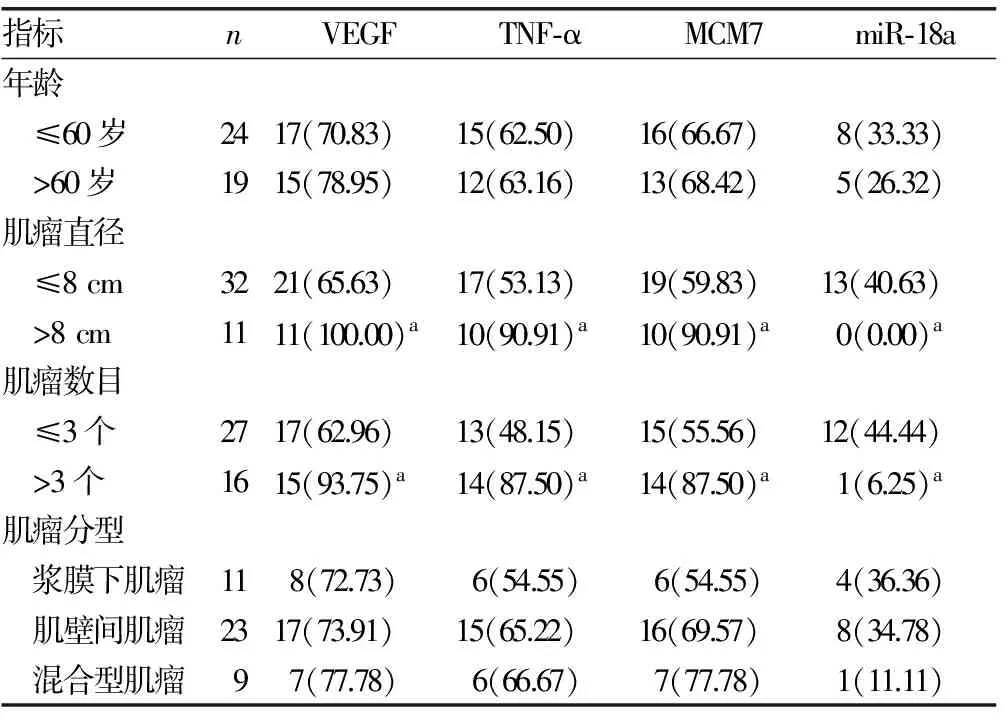
表4 不同病例特征间VEGF、TNF-α、MCM7、PR、ER阳性率比较[n(%)]
注:组内指标比较,aP<0.05
3 讨 论
子宫肌瘤发生及发展是多因素共同作用的结果,病因尚未完全明确。目前临床相关研究显示,该病属于甾体激素依赖性疾病,与细胞因子、基因、遗传、细胞信号传导途径异常,以及细胞增殖和凋亡等多种因素相关[6-7]。文献[8]报道,孕激素可以促进子宫肌瘤生长。孕激素和雌激素分别通过PR、ER发挥作用,由于PR、ER与孕激素和雌激素亲和力较高,能够选择性保留高水平的孕激素和雌激素,进而增强了生物学作用。本研究结果显示,子宫肌瘤组织PR、ER阳性率分别为79.07%和72.09%,明显高于正常子宫肌层组织,这与临床研究结果一致[9],提示在子宫肌瘤的发展当中PR、ER发挥了重要作用。
VEGF属于糖基化多肽分泌因子的一种,由2个相同亚基以二硫键交联结合的形式组成。VEGF能够促进内皮细胞进行有丝分裂,增加机体血管的通透性,促进血管生成,在多种良恶性肿瘤新血管生成、血管重塑等过程中起到了重要作用[10]。本研究结果显示,在子宫肌瘤组织中VEGF阳性率为74.42%,明显高于正常子宫肌层组织的39.53%,这与高英芳等[11]的研究结果一致。本研究亦发现,在子宫肌瘤组织中VEGF表达水平与PR、ER表达呈正相关。孕激素与雌激素可以通过VEGF受体对多种和细胞增殖有关的基因表达进行调节,在子宫肌瘤新生血管以及内皮增生局部因子当中,VEGF的表达较强,而且VEGF提高了血管的通透性,这为多种细胞迁移提供了有利的纤维网络,进而促进了肌瘤的发展[12]。
TNF-α属于促炎因子的一种,能够促进T细胞产生多种炎症因子,进而诱发炎性反应。吞噬细胞在活化之后可以分泌大量的TNF-α,从而加剧了局部平滑肌组织的损伤,进而形成了炎症病理损伤。同时,TNF-α还能够通过对VEGF表达进行调节,从而间接发挥促进血管形成的作用[13]。唐恩燕等[5]的研究指出,在子宫肌瘤组织中TNF-α表达量明显高于正常子宫肌层组织,这可能与炎症产物对单核吞噬细胞进行刺激,进而导致TNF-α分泌量增加,以及子宫肌瘤细胞自身分泌TNF-α等有关。本研究结果与以上研究一致,子宫肌瘤组织中TNF-α阳性率为62.79%,明显高于子宫肌层组织的25.58%,同时TNF-α表达水平与PR、ER亦呈显著正相关。
miRNA被包裹在凋亡小体、微小体或者外泌体之中,它们与血浆中小分子物质在化学修饰作用下形成囊泡及蛋白复合体,而膜性结构可避免miRNA在机体内被降解,形成的复合物进入机体后被转运至受体细胞,然后通过内吞、膜融合、受体结合等方式发挥生物学效应[14]。近年来,随着临床基因组学研究逐步深入,人们对于miRNA与肌瘤的关系有了全新的认识,越来越多的学者发现,子宫肌瘤与miRNA有着密切关系,多种miRNA如miR-21、miR-197、miR-29b以及let-7等在子宫肌瘤组织中出现明显的异常表达现象,它们通过作用于不同的靶基因,进而在子宫肌瘤发生及发展中发挥重要作用[15]。ER包括两种亚型,分别为ERα和ERβ。在廖治等[16]的研究中指出,miR-18a表达降低,而ERα表达升高,二者呈负相关,并指出miR-18a的靶基因可能为ERα。本研究结果显示,子宫肌瘤组织中miR-18a阳性率为30.23%,明显低于子宫肌层组织的83.72%,且与PR、ER表达均呈明显负相关。其表达失调可能促进了子宫肌瘤细胞增殖,进而促进了子宫肌瘤进展。
肿瘤与细胞周期之间有着密切关系,细胞周期和DNA复制调控有关。MCM为一组与细胞增殖和DNA复制有关的蛋白家族,在基因组、染色体重构及DNA复制中起到了重要作用。在细胞中MCM蛋白表达量呈现周期性的表现,当处于G1/S转换时MCM蛋白表达量达到峰值,而当细胞G0期或者分化期时,MCM蛋白表达量明显降低,甚至不表达。因此,MCM蛋白可以作为细胞增生状态评估的一个重要特异性标志物[17]。MCM7是MCM家族重要成员,在确保DNA复制起始过程稳定中起重要作用,能够保证在一个周期之中DNA复制仅有1次,因此MCM7表达水平提高说明细胞增生、增殖明显进展[18]。本研究中,子宫肌瘤组织MCM7阳性率为67.44%,明显高于的瘤旁组织的16.28%,而且与PR、ER高表达相关。进一步分析发现,在子宫肌瘤组织中,肌瘤直径>8 cm、肌瘤数目>3个的VEGF、TNF-α、MCM7阳性率明显高于肌瘤直径≤8 cm、肌瘤数目≤3个的阳性率,而miR-18a阳性率明显低于肌瘤直径≤8 cm、肌瘤数目≤3个的阳性率,可见不同肌瘤大小、数目之间VEGF、TNF-α、MCM7、miR-18a阳性率存在明显差异。随着肿瘤大小增加,以及肿瘤数目增多,VEGF、TNF-α、MCM7阳性率逐渐升高,而miR-18a阳性率逐渐降低,提示VEGF、TNF-α、MCM7高表达及miR-18a低表达与子宫肌瘤发生及发展可能存在密切关系。
综上所述,在子宫肌瘤组织中VEGF、TNF-α、MCM7均呈高表达,miR-18a呈低表达,其异常表达与子宫肌瘤发生及发展密切相关。VEGF、TNF-α、MCM7、miR-18a异常表达可以筛检子宫肌瘤的高危人群。不过本研究的样本量偏少,应扩大样本量进一步证实。
[1]FROELING V,MECKELBURG K,SCHREITER N F,et al.Outcome of uterine artery embolization versus MR-guided high-intensity focused ultrasound treatment for uterine fibroids:long-term results[J].Eur J Radiol,2013,82(12):2265-2269.
[2]蔡明霞,邓再兴.子宫颈鳞状细胞癌中Aurora-A、MCM7和HPV16 E7的表达及病理学分析[J].中国医药导报,2016,13(4):20-24.
[3]刘冰,张智晓,刘钢.微小RNA作为感染性疾病标志物的研究进展[J].中国感染与化疗杂志,2015,15(4):391-394.
[4]杨会娟,程玲.子宫肌瘤患者血清Ang-2和VEGF水平变化及其意义[J].中国妇幼保健,2016,31(10):2049-2051.
[5]唐恩燕,徐克,唐少华.MMP-2以及TNF-α在子宫肌瘤中的意义[J].中国妇幼保健,2014,29(32):5305-5307.
[6]GAO M,GUO K M,WEI Y M,et al.Aspirin inhibits the proliferation of human uterine leiomyoma cells by downregulation of K-Ras-p110α interaction[J].Oncol Rep,2017,38(4):2507-2517.
[7]封全灵,张倩,刘弘扬,等.子宫肌瘤发病孕激素相关危险因素病例对照研究[J].中国妇幼保健,2016,31(2):241-243.
[8]HOEKSTRA A V,SEFTON E C,BERRY E,et al.Progestins activate the AKT pathway in leiomyoma cells and promote survival[J].J Clin Endocrinol Metab,2009,94(5):1768-7174.
[9]马荣,高丽娜.IGF-I、ER及PR在绝经后子宫肌瘤中的表达及其临床意义[J].标记免疫分析与临床,2016,23(8):903-905.
[10]冯静,陈小兵,赵明耀.合并肝转移的结直肠癌组织中VEGF和Survivin蛋白的表达[J].郑州大学学报(医学版),2010,45(2):207-209.
[11]高英芳,李利,王建平,等.Ang-2、VEGF在子宫肌瘤组织中的表达及相互作用[J].医学临床研究2008,25(12):2216-2219.
[12]DI TOMMASO S,MASSARI S,MALVASI A,et al.Gene expression analysis reveals an angiogenic profile in uterine leiomyoma pseudocapsule[J].Mol Hum Reprod,2013,19(6):380-387.
[14]VICKERS K C,REMALEY A T.Lipid-based carriers of microRNAs and intercellular communication[J].Curr Opin Lipidol,2012,23(2):91-97.
[15]MARSH E E,LIN Z,YIN P,et al.Differential expression of microRNA species in human uterine leiomyoma versus normal myometrium[J].Fertil Steril,2008,89(6):1771-1776.
[16]廖治,肖洪涛.MicroRNA-18a及雌激素受体α在子宫肌瘤中的表达[J].中国临床药理学杂志,2015,31(21):2128-2130.
[17]张丽莉,刘晓丽.微小染色体维持蛋白7在子宫内膜癌中的表达[J].中国妇幼健康研究,2010,21(6):758-760.
[18]CHUANG T D,LUO X,PANDA H,et al.miR-93/106b and their host gene,MCM7,are differentially expressed in leiomyomas and functionally target F3 and IL-8[J].Mol Endocrinol,2012,26(6):1028-1042.

