产ESBLs大肠埃希菌的耐药性与TEM型耐药基因的关系探讨
涂胡柳,黄永茂,林 雁,罗永鸿,孙长峰,赵东霞,邹永胜,钟 利,陈 庄
大肠埃希菌是目前临床最为常见的病原菌,临床分离率居革兰氏阴性菌首位[1],随着抗菌药物的广泛使用,该病原菌的耐药率也逐年升高,越来越多的临床致病菌株表现为多重耐药性,给临床治疗带来了巨大的挑战。产ESBLs是大肠埃希菌耐β-内酰胺类抗菌药物的主要机制,近年来TEM型ESBLs在我国的报道越来越多,本实验的目的是对我院大肠埃希菌临床分离株的耐药性、耐药模式、TEM基因的检出进行分析,了解本院大肠埃希菌的耐药变迁及TEM型ESBLs流行情况,从而指导临床用药,报道如下:
1材料与方法
1.1材料
1.1.1菌株来源 来自西南医科大学附属医院2014年7月-2014年11月临床科室住院患者体液标本共93株,为非同一患者重复菌株,其中痰液12株,尿液26株,血液17株,胸腹水5株,分泌物33株,所有实验菌株均经过VITEK系统(BioMerieux,法国)进行菌种鉴定确认。实验所用质控菌株为大肠埃希菌ATCC25922。
1.1.2主要试剂及仪器 质粒小提取试剂盒、药敏纸片、电泳琼脂糖、50×TAE缓冲液、DNA MarkerⅢ、GoldviewⅠ型核酸染色剂、双蒸水、2×Taq PCR MasterMix、Bio-Rad自动成像系统、Bio-RadPCR仪器等。
1.2方 法
1.2.1药敏实验及产ESBLs菌株的检测 采用K-B法按照CLSI2012标准,对93株大肠埃希菌进行药物敏感性实验并统计耐药性,双纸片法确证ESBLs表型。
1.2.2临床分离株质粒DNA提取及TEM基因扩增 按照质粒小试剂提取盒提取细菌质粒DNA的步骤进行,引物参照文献设计并由上海生工生物工程有限公司合成,如表1。PCR反应体系为25μl,包括10μl DNA模板、12.5μl 2×MasterMix、上下游TEM基因公共引物各1μl,加ddH2O至25μl。PCR扩增条件如下:94℃预变性5min,经过32个循环反应(94℃变性30sec, 55℃复性30sec,72℃延伸30sec),然后72℃延伸10min,1%琼脂糖凝胶电泳法分析。
将PCR扩增出的携带TEM基因的菌株进行特异性PCR扩增,引物见表1,PCR反应体系为50μl,包括10μ l DNA模板、上下游TEM基因特异性引物各2μl、25μl 2×MasterMix,加ddH2O至50μl。PCR扩增条件如下:95℃预变性5min,经过35个循环反应(95℃变性30sec, 57℃复性30sec,72℃延伸80sec),然后72℃延伸10min,获得的PCR产物采取上述相同的方法分析,将PCR产物送至成都擎科梓熙生物技术有限公司测序,通过MEGA7.0(http://www.megasoftware.net/)、BioEdit(http://www.softpedia.com/get/Science-CAD/BioEdit.shtml)软件比对分析确定基因型。

表1 实验所用PCR引物

表2 93株大肠埃希菌药敏实验结果
2结 果
2.1药敏实验结果 93株临床分离株分别来源于痰液12株、尿液26株、血液17株、胸腹水5株,分泌物33株,分别占分离株的12.9%、27.96%、18.28%、5.38%和35.48%。总实验数据显示大肠埃希菌对青霉素类、第二代头孢菌素、部分三代头孢菌素、氨基糖苷类、喹诺酮类、耐药率菌较高,但对β-内酰胺酶类/酶抑制剂复方制剂耐药率较低,对头霉素类、阿米卡星耐药率低,对亚胺培南、莫西沙星敏感。不同来源标本的具体耐药数据见表2。
临床分离株共检出全敏菌株4株、单耐菌株5株、双耐菌株18株、多耐菌株66株,分别占分离株的4.3%、5.38%、19.35%和70.97%,未检出全耐菌株,耐药模式以多重耐药为主,其次为双耐、单耐、全敏。
2.2ESBLs表型检测结果 93株大肠埃希菌共检出ESBLs阳性菌株55株,检出率为59.14%,主要来源于分泌物38.18%和尿液29.09%;ESBLs阴性菌株38株,检出率为40.86%,主要来源于血液31.58%、分泌物31.58%和尿液26.32%。具体数据见表3。
55株ESBLs阳性大肠埃希菌菌株中检出双耐药菌株2株,检出率为3.64%;检出多耐药菌株53株,检出率为96.36%;未检出全敏及单耐菌株。38株ESBLs阴性大肠埃希菌菌株中检出全敏菌株4株、单耐药菌株5株、双耐药菌株16株、多耐药菌株13株,分别占ESBLs阴性菌株的10.53%、13.16%、42.11%和34.21%。具体数据见表4。
本实验检出的66株多重耐药大肠埃希菌菌株,ESBLs阳性者53株,其中30株多重耐药菌株携带TEM基因,占TEM阳性基因的比例高达93.75%(30/32);23株多重耐药菌株未携带TEM基因。具体数据见表5。
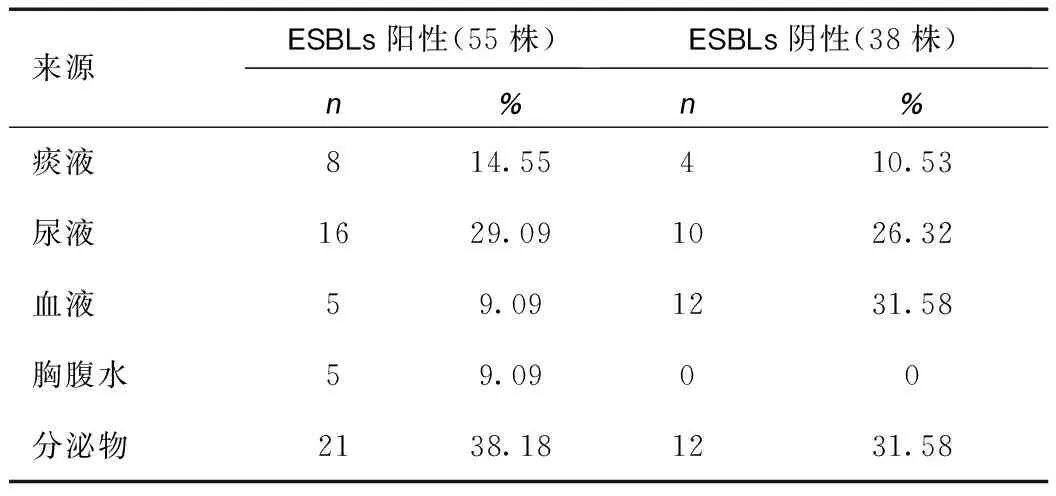
表3 ESBLs表型检测结果
2.3PCR检测及序列分析结果 对临床分离的55株ESBLs阳性大肠埃希菌菌株进行TEM基因PCR扩增,电泳图见图1,阳性菌株32株,阳性率为58.2%,经过特异性TEM基因PCR扩增后送成都擎科梓熙生物技术有限公司测序。通过EGA7.0和BioEdit软件比对分析,表明本地区只检出TEM-1型一种基因型,未检出其他亚型。
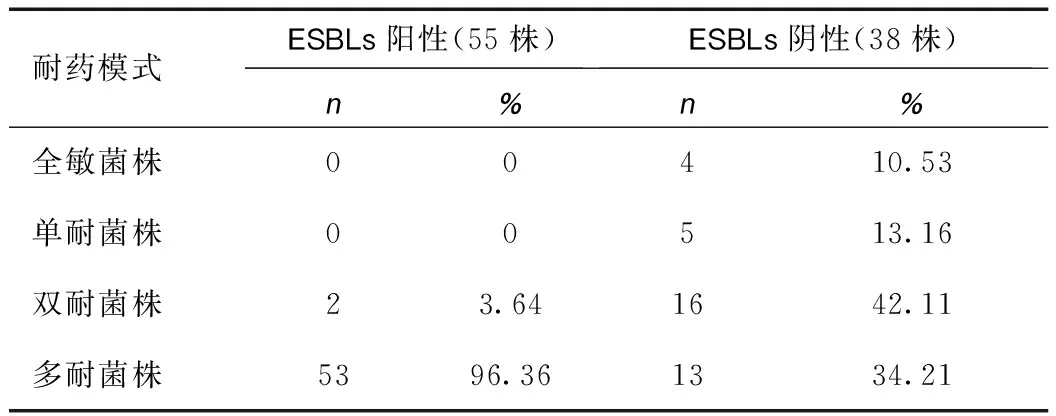
表4 ESBLs表型耐药模式结果

图5:TEM基因电泳结果图

耐药模式TEM阳性(32株)TEM阴性(23株)n%n%全敏菌株0000单耐菌株0000双耐菌株26.2500多耐菌株3093.7523100
3讨 论
本次实验93株临床分离的大肠埃希菌株主要来自分泌物标本,分离率为35.48%,其次为尿液和痰液标本,分离率分别为27.96%和12.9%,这与胡付品[1]报道的标本分布有所不同,这可能与本次实验标本量少、临床使用抗菌药物的种类、剂量、频率、联用情况等因素有关。耐药数据表明大肠埃希菌对哌拉西林、第二代头孢菌素、头孢噻肟、大部分氨基糖苷类的耐药率高(46.24%-78.49%),对酶抑制剂、阿米卡星耐药率低(1.08%-4.3%),耐药特点与2005-2014年CHINT大肠埃希菌耐药性监测结果[2]一致。实验数据表明β-内酰胺酶类/酶抑制剂复方制剂、头霉素类、阿米卡星、莫西沙星、碳青霉烯类抗菌药物均可作为首选药物,但仍需严格掌握指征,根据药敏结果选用,并注意其毒副作用。碳青霉烯类虽然是敏感性最高的抗菌药物,但截至目前已有耐碳青霉烯类大肠埃希菌的报道[3]。对于第三代头孢菌素的使用,尤其应注意该菌株的ESBLs表型,以免造成耐药基因的水平传播而引起耐药率升高。
本实验共分离ESBLs阳性菌株55株,分离率为59.14%,以分泌物及尿液标本为主,主要分布于普外科、泌尿外科、妇产科。产ESBLs大肠埃希菌对临床常用抗菌药物的耐药率显著高于ESBLs阴性菌株,经统计分析,该差异具有统计学意义(P﹤0.05),说明ESBLs是导致大肠埃希菌产生多重耐药的重要因素。TEM型ESBLs是一类经质粒介导的β-内酰胺酶,能够水解青霉素类、头孢菌素类、头霉素类、β-内酰胺类抗生素,但能够被β-内酰胺酶类/酶抑制剂复方制剂所抑制。在我国的流行也是呈逐年上升的趋势,我国流行的TEM型主要是TEM-1型[4],虽然TEM-2型[5]、TEM-166型[6]等亚型在我国也有过相关报道,但均为散发,未见流行报道。本实验显示在产ESBLs菌株中,经PCR筛选出32株TEM基因阳性菌株,检出率为58.2%,与大多数国内报道的处于同等水平[7] [8],TEM基因分型只发现一种亚型,即TEM-1型,暂未发现其他亚型,提示本地区流行的TEM型ESBLs为TEM-1型,这与廖经忠[9]报道的一致。
本实验结果显示多重耐药菌株66株,分离率70.97%,这明显高于本地区2012年(33.80%)[10]、2013年(42.86%)[11]的多重耐药菌株检出率;66株多重耐药菌株中ESBLs阳性菌株53株;ESBLs阴性菌株13株;双耐药菌株18株,其中ESBLs阴性菌株16株,ESBLs阳性菌株2株;单耐药及全敏菌株9株,均为ESBLs阴性菌株;检出ESBLs阳性同时携带TEM基因32株,32株中表现为多重耐药性的有30株,2株表现为双重耐药;ESBLs阳性但TEM基因阴性的23株大肠埃希菌菌株全部表现为多重耐药性,这可能是多重耐药菌株还携带其他的ESBLs类型[12]如SHV型、CTX-M型、OXA型等有关。由此可见,ESBLs阳性菌株更容易产生多重耐药性,这高于CHINET2005-2014年中国大肠埃希菌耐药性监测[2]结果,这可能与滥用抗菌药物有关,需注意ESBLs阴性菌株也以双耐及多耐为主,除本实验样本量偏小以外,是否存在其他的耐药基因导致大肠埃希菌的耐药谱增宽还有待进一步研究证实。治疗多重耐药菌株应严格遵药敏结果,以免导致全耐药菌株的产生。
综上所述,本地区的大肠埃希菌耐药率较高,多重耐药菌株的逐渐增多是对临床治疗的巨大挑战,大肠埃希菌的耐药性与产ESBLs关系密切[13] [14],尤其是多重耐药的特征更是与ESBLs有密切的关系。ESBLs有五种类型,同时携带其他ESBLs类型耐药基因可能是导致产生多重耐药性的关键因素,故动态监测本院大肠埃希菌的耐药率、耐药性的变迁及进一步研究本院大肠埃希菌的ESBLs其他类型是很有必要的,了解本院的大肠埃希菌耐药率及流行的耐药基因类型对指导临床用药有重要的指导意义。
[1]胡付品, 朱德妹, 汪复, 等. 2014年CHINET中国细菌耐药性监测[J].中国感染与化疗杂志, 2015, 15(05):401-410.
[2]沈继录, 潘亚萍, 徐元宏, 等. 2005—2014年CHINET大肠埃希菌耐药性监测[J]. 中国感染与化疗杂志,2016,16(02):129-140.
[3]GIANIT,ANTONELLIA,CALTAGIRONEM,etal.Evolvingbeta-lactamaseepidemiologyinEnterobacteriaceaefromItaliannationwidesurveillance,October2013:KPC-carbapenemasespreadingamongoutpatients[J].EuroSurveill, 2017, 22(31):30583.
[4]姚建平,黄永茂.TEM型β内酰胺酶的研究进展[J]. 中国感染与化疗杂志,2014,14(06):550-555.
[5]陈灿峰,钟六珍,陈秀红. 产超广谱β内酰胺酶大肠埃希菌中TEM基因型特征研究[J]. 黑龙江医学,2013,37(12):1197-1198.
[6]王慧,熊自忠,李睿.TEM型β内酰胺酶新亚型TEM-166编码基因的克隆表达[J]. 中国感染与化疗杂志,2010,10(02):120-122.
[7]张长虹,孟存仁,晓英. 产ESBLs大肠埃希菌和肺炎克雷伯菌耐药性分析及TEM、SHV基因检测[J]. 国际检验医学杂志,2015,36(5):583-585.
[8]岳欣,田文君,王鹏,等. 产超广谱β-内酰胺酶大肠埃希菌和肺炎克雷伯菌的耐药及TEM与SHV基因型分析[J]. 中华医院感染学杂志,2016,26(14):3125-3128.
[9]廖经忠, 刘文恩, 李虹玲,等. 革兰阴性杆菌TEM型βE内酰胺酶耐药基因研究[J]. 中国现代医学杂志, 2010, 20(13):1957-1961, 1966.
[10]龚强. 耐多药大肠埃希菌产质粒介导AmpC酶基因型研究及耐药性分析[D].泸州医学院,2012.
[11]张正琼. 耐多药大肠埃希菌质粒介导的耐药基因探讨[D].泸州医学院,2013.
[12]HAMDYMOHAMMEDELS,ELSADEKFAKHRA,MOHAMMEDE,etal.SpreadofTEM,VIM,SHV,andCTX-Mβ-LactamasesinImipenem-ResistantGram-NegativeBacilliIsolatedfromEgyptianHospitals[J].IntJMicrobiol, 2016Mar31. [Epubaheadofprint]
[13]RAHMANH,NAEEMM,KHANI,etal.MolecularprevalenceandantibioticsresistancepatternofclassAblaCTX-M-1andblaTEM-1betalactamasesinuropathogenicEscherichiacoliisolatesfromPakistan[J].TurkJMedSci,2016, 46(3):897-902.
[14]HAGHIGHATPANAHM,MOZAFFARINEJADAS,MOJTAHEDIA,etal.Detectionofextended-spectrumβ-lactamase(ESBL)andplasmid-borneblaCTX-MandblaTEMgenesamongclinicalstrainsofEscherichiacoliisolatedfrompatientsinthenorthofIran[J].JournalofGlobalAntimicrobialResistance, 2016, 7:110-113.

