不同处理方式对乳中β-内酰胺酶稳定性的影响
范美婧,陈媛,蔡兴航,臧小丹,岳崇慧,孙琦,于广吉,于国萍
(1.东北农业大学食品学院,哈尔滨150030;2.陕西中医药大学陕西省中药资源产业化协同创新中心,陕西咸阳712046)
不同处理方式对乳中β-内酰胺酶稳定性的影响
范美婧1,陈媛1,蔡兴航2,臧小丹1,岳崇慧1,孙琦1,于广吉1,于国萍1
(1.东北农业大学食品学院,哈尔滨150030;2.陕西中医药大学陕西省中药资源产业化协同创新中心,陕西咸阳712046)
利用青霉素酶活性检测试剂盒对乳中β-内酰胺酶的稳定性进行检测,分别对乳中β-内酰胺酶的保存时间、灭菌方法和酸碱处理对其稳定性影响进行了研究,从而对乳中β-内酰胺酶的稳定性进行全面的评估。结果表明,青霉素酶活性检测试剂盒检测乳中的β-内酰胺酶的最低检测限为2 U/m L。样品储存时间越长β-内酰胺酶的活性越小,并且减小程度与温度正相关。常规灭菌方法均不能使β-内酰胺酶彻底失活,酸碱处理对β-内酰胺酶有不同程度的抑制,其中碱性条件下比酸性条件下抑制作用强。
快速检测;β-内酰胺酶;乳;稳定性
0 引言
随着物质生活的极大提高,牛奶的质量安全受到人们的关注,有不法生产者在牛奶中加入生物解抗剂,为了掩盖抗生素的残留,这种解抗剂就是从微生物中提取的β-内酰胺酶[1-4],它能对青霉素产生破坏或抑制作用。,这可使消费者对抗生素类药物耐药性增高,抵抗传染病的能力降低,给消费者的身体健康带来危害[5-7]。
现已有许多针对于β-内酰胺酶的检测方法[8-10]。而少有针对β-内酰胺酶的稳定性的相关研究,本文采用快速检测试剂盒[11]对其稳定性进行测定,根据市售牛奶制品的加工工艺及贮存方式,本实验选取保存时间、灭菌方法和酸碱处理[12-14]三个条件进行研究,根据结果对β-内酰胺酶的潜在危害性进行风险评估,为我国乳品行业卫生质量管理提供安全保障和理论支持。
1 实验
1.1材料与设备
β-内酰胺酶标准品(P0389-1 KU),青霉素G标准品(25 g),青霉素酶活性检测试剂盒,pH计。
1.2方法
1.2.1 检测方法
北京优尼赛斯科技有限公司提供的青霉素酶活性检测试剂盒,具体操作步骤:将孵育器温度调节至40℃,取5个玻璃试剂瓶,用移液器吸取400μL样品加入到玻璃试剂瓶中,将加入样品的玻璃试剂瓶放置于孵育器上温育45 min。待温育结束后,从玻璃试剂瓶中吸取200μL待检样品置于微孔中,反复抽吸几次,使混合液均匀变成粉色。将微孔放入孵育器中温育3 min,温育结束后,将试剂条插入微孔中,继续温育3 min,温育结束后,取出试剂条,观察结果。判定方式如表1所示。

表1 判读标准
1.2.2 最低检测限的确定
将β-内酰胺酶标准品加入到牛奶样品中,配制含量分别为0.5,1,1.5,2,2.5,3,4 U/mL的样品,然后用青霉素酶活性检测试剂盒分别对其检测,确定试剂盒最低检测限。
1.2.3 贮存温度和时间对牛奶中β-内酰胺酶稳定性的影响
步骤同1.2.1,配制β-内酰胺酶终浓度分别达到2,2.5,3和4 U/mL。然后将其分别置于-18~-20,4,25和37℃无菌条件下贮藏1周,期间每1天用青霉素酶活性检测试剂盒进行检测。
1.2.4 灭菌方法对牛奶中β-内酰胺酶稳定性的影响
步骤同1.2.1,配置浓度为2,4,6,8,10,20,30,40 U/mL的β-内酰胺酶标准品的牛奶样品,分装到10 mL的试管中,如表2所示的灭菌方法[15]进行处理,再通过青霉素酶活性检测试剂盒进行检测。

表2 灭菌方法对牛奶中β-内酰胺酶稳定性的影响
1.2.5 酸碱处理对牛奶中β-内酰胺酶的影响
步骤同1.2.1,配制浓度为2,3,4,5,6 U/mL的β-内酰胺酶标准品的牛奶样品,分别装到10 mL的离心管中,用浓度为1 mol/L的盐酸和1 mol/L的氢氧化钠溶液分别将其pH值调制至3,4,5,6,7和8。再通过青霉素酶活性检测试剂盒进行检测。
2 结果与分析
2.1青霉素酶活性检测试剂盒最低检测限的确定
用青霉素酶活性检测试剂盒分别对样品检测,结果如表3所示,当溶液浓度≥2 U/mL时,能检测出有β-内酰胺酶。所以,青霉素酶活性检测试剂盒的最低检测限为2 U/mL。

表3 β-内酰胺酶检测限的测定
2.2贮存温度和时间对牛奶中β-内酰胺酶稳定性的影响
用青霉素活性检测试剂条检测奶样,检测周期为1天1次,检测结果如表4所示。

表4 不同温度下贮存不同时间后β-内酰胺酶的稳定性
由表4可以看出,在-18~-20℃和4℃下贮存1周,各个浓度的牛奶样品都能检出β-内酰胺酶,贮存2周,仍能检出(表内未列出),说明低温贮存条件对牛奶样品中β-内酰胺酶的活性基本没有影响。在25℃下贮存1周,浓度为2.5,3,4 U/mL的牛奶样品1周内均能检出β-内酰胺酶;浓度为2 U/mL的样品,贮存6 d已无法检出。在37℃下贮存1周,浓度为3 U/mL和4 U/mL的样品,一周内均能检出β-内酰胺酶;浓度为2.5 U/mL的样品,贮存第6天时已无法检出;浓度为2 U/mL的样品,贮存第3天时已无法检出。
比较25℃和37℃条件下的牛奶样品,浓度为3 U/mL和4 U/mL的牛奶样品基本没有变化,分析低浓度2 U/mL的样品,37℃条件下的样品第3天开始就无法检出,25℃从第6天开始无法检出。随着贮存时间的增长,牛奶样品中β-内酰胺酶的活性呈下降趋势。同时说明随着贮存温度的升高,加速了β-内酰胺酶的活性减少,但没有完全失活。
2.3灭菌方法对牛奶中β-内酰胺酶稳定性的影响
用青霉素活性检测试剂条检测不同灭菌方法的牛奶样品,结果如表5所示。

表5 63,75,100和121℃下β-内酰胺酶酶活的变化
由表5可以看出,在63℃和75℃加热30 min和1 h时,当含β-内酰胺酶标准品的牛奶样品浓度为2,4,6,8 U/mL时,均未检测出β-内酰胺酶。当牛奶样品浓度为10 U/mL和20 U/mL时,均检测出β-内酰胺酶,这说明巴氏灭菌(63℃和75℃)方法对低浓度的β-内酰胺酶有一定的灭活作用,而对于高浓度的β-内酰胺酶即大于10 U/mL时,巴氏灭菌方法对β-内酰胺酶的灭活作用不明显。
在100℃加热不同时间时,当牛奶样品含β-内酰胺酶的浓度为2,4,6,8 U/mL时,均未检测出β-内酰胺酶。当牛奶样品浓度大于10 U/mL时,加热处理时间小于30 min后,均检测出β-内酰胺酶,但是从试剂条中可以发现当β-内酰胺酶浓度为10 U/mL时,第二个指示横杠颜色随着加热时间延长明显变浅,说明β-内酰胺酶的活性在较高温度随着时间的增加而有所降低。
而对于121℃条件,当浓度为10 U/mL和20 U/mL时,牛奶样品在121℃下加热处理15 s,1 min,10 min后,β-内酰胺酶被检测出,而加热30 min后,β-内酰胺酶未被检测出。将浓度增至30 U/mL和40 U/mL,在121℃下加热处理30 min后,β-内酰胺酶被检测出(结果未列出)。说明在超高温度下处理牛奶样品对β-内酰胺酶的活性影响较大。
2.4酸碱处理对牛奶中β-内酰胺酶稳定性的影响
用青霉素活性检测试剂盒检测对酸碱处理的含β-内酰胺酶标准品的牛奶样品,结果如表6所示。
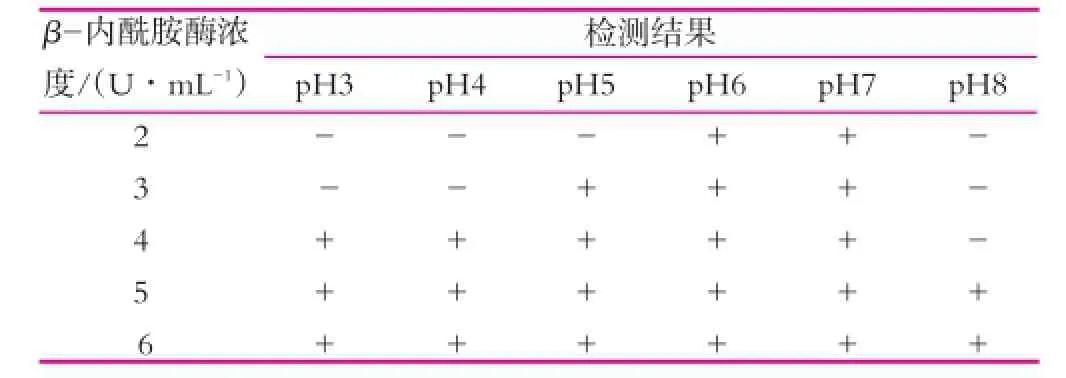
表6 在不同pH值下β-内酰胺酶酶活的变化
由表6可以看出,当pH值为6和7时,所有浓度的含β-内酰胺酶标准品的牛奶样品均被检出,且被检出的最低浓度与试剂盒最低检测限相同,均为2 U/mL。当pH值为5时,青霉素酶活性检测试剂盒在β-内酰胺酶浓度为3 U/mL时才检出,牛奶样品中的β-内酰胺酶最低检测限升高,可能是酸性条件下导致β-内酰胺酶活力降低。当pH值为3和4时,青霉素酶活性检测试剂盒在β-内酰胺酶的浓度为4 U/mL时才检出,牛奶样品中的β-内酰胺酶最低检测限进一步升高,但β-内酰胺酶仍具有一定的活性。说明随着pH值的降低,β-内酰胺酶的活性有所减弱。当pH值为8时,青霉素酶活性检测试剂盒在β-内酰胺酶的浓度为5 U/mL时才检出,牛奶样品中的β-内酰胺酶活性大幅度降低,且下降速率比酸性条件快,说明酸或碱性条件均对β-内酰胺酶有破坏作用。
3 结论
本研究通过快速检测试剂盒对β-内酰胺酶的稳定性进行测定,分别对β-内酰胺酶的保存时间、灭菌方法和酸碱处理进行研究。
(1)随着贮存时间的增加,β-内酰胺酶的活性减小,并且减小程度与温度成正相关。但是活性没有完全丧失,表明β-内酰胺酶在乳中有很高的稳定性。
(2)对于灭菌方法,巴氏灭菌及短时间煮沸对β-内酰胺酶无明显影响,长时间煮沸和高温对β-内酰胺酶有不同程度的灭活效果,表明β-内酰胺酶有很强的耐热性,一些灭菌方法都不能彻底的使β-内酰胺酶失活。
(3)酸碱处理对乳中β-内酰胺酶有不同程度的抑制作用,β-内酰胺酶对酸具有较强的耐受性,碱的抑制作用比酸的强,说明β-内酰胺酶在酸乳制品仍能表现出较高活性。
本研究的意义在于表明如果原料乳中含有β-内酰胺酶,以此为原料制备的牛奶制品,在生产加工后仍会有残留,尤其是低温巴氏奶,这对消费者的健康是极大的威胁,所以我们应从源头抓起,对原料乳的质量安全进行监控,从而减少β-内酰胺酶对消费者的危害。
[1]迟骁玮,陈志伟.牛奶中β-内酰胺酶检测方法的研究[J].黑龙江畜牧兽医.2011.10(19):27-29.
[2]ZHOU S,WANG D,ZHAO Y F,et al.A rapid high-performance liquid chromatography method for indirect quantification ofβ-lac⁃tamase activity in milk american[J].Dairy Science Association,2015,98(4):2197–2204.
[3]刘志楠,喻东威,赵源,等.乳与乳制品中β-内酰胺酶的特性及检测方法[J].中国乳品工业,2011.11:53-55.
[4]付欣,鲁明,吴兴壮,等.大肠杆菌产β-内酰胺酶发酵条件研究[J].安徽农业科学,2014,42(17):5642-5644.
[5]张明,郑凤娥,杨春晖.液体乳和乳饮料中β-内酰胺酶检测方法的研究[J].食品研究与开发,2012,33(11):44-48.
[6]KORYCK-DAHL M,RICHARDSON T,BRADLEY R.Use of mi⁃crobial beta-lactamase to destroy penicillin added to milk[J].J Dairy Sci.,1985,68(8):1910-1916.
[7]JOUMANZ N SAMAHA-KFOURY,GEORGE FARAJ.Recent developments in beta-lactamases and extended spectrum beta-lac⁃tamases[J].Bmj,2003,327(7425):1209-1213.
[8]HARRY BRIK.Development of a Method for the Detection of β-Lactamases in Milk Samples[J].AOAC,2007,10(1):514-557.
[9]薛晓晶,李玲,金涌,等.杯碟法检测乳中的β-内酰胺酶[J].食品科学, 2011,32(4):216-219.
[10]B B WINTERMANS,C MJE VANDENBROUCKE-GRAULS. Outline of a bacterial filter-based assay to detect beta-lactamases[J]. Journalof Microbiological Methods,2016,120:29–33.
[11]穆小婷,董文宾,王玲玲,等.ELISA试剂盒及其在乳品检测中的应用[J].食品科技,2013,38(07):304-310.
[12]A O’CONNELL,P L RUEGG,K JORDAN,et al.The effect of storage temperature and duration on the microbial quality of bulk tank milk[J].Journalof Dairy Science,2016,99(5):3367–3374.
[13]NICHOLAS G BROWN,JEANINE M PENNINGTON, HUANG WZ,et al.Multiple Global Suppressors of Protein Stability Defects Facilitate the Evolution of Extended-Spectrum TEM β-Lactamases.Journalof Molecular Biology.2010,404(5):832-846.
[14]KHEIROLOMOOM A,KAZEMY-VAYSARI A,ARDJMAND M,et al.The combined effects of p H and temperature on penicillin G decomposition and its stability modeling,Process Biochemisrtry. 1999,35(1-2):205–211.
[15]李勇,夏骏,徐国茂,等.不同灭菌工艺和贮存条件对牛奶品质的影响[J].江西畜牧兽医杂志.2016(1):14-16.
Effect of different treatment on the stability ofβ-lactamase in milk
FAN Meijing1,CHEN Yuan1,CAIXinghang2,ZANG Xiaodan1,YUE Conghui1,SUN Qi1, YU Guangji1,YU Guoping1
(1.College of food science,Northeast Agricultural University,Harbin 150030,China;2.Shanxi University of Chinese Medicine,Shannxi Collaborative Innovation Center of Chinese Medicinal,Xianyang 712046,China)
The stability ofβ-lactamase in milk was detected with Penicillin activity detection kit in this study,and the effect ofthe hold time, sterilization methods and acid or alkaline environment on stability ofβ-lactamase in milk were studied respectively.A comprehensive assess⁃ment of the stability ofβ-lactamase was conducted finally.As a result,the detection limit ofβ-lactamase in milk is 2 U/mL when used the method of penicillin activity detection kit.The activity ofβ-lactamase was reduce as the hold time increase,the correlation between the de⁃crease degree of activity ofβ-lactamase and temperature was positively.The conventional sterilization methods could not completely make β-lactamase inactivated.There were different degrees of inhibition forβ-lactamase under acid or alkaline environment,wherein the inhibi⁃tion of alkaline treatmentwere stronger than thatofacid.
rapid detection;β-lactamase;stability
Q93-33
A
1001-2230(2017)04-0008-03
2016-09-13
国家科技支撑计划(2013BAD18B00)。
范美婧(1992-),女,硕士,从事食品质量与安全方面的研究。
于国萍

