牛奶中糠氨酸检测方法的研究进展
陈冲冲,郑楠,文芳,李明,张焕,任辉,李松励,王加启
(1.中国农业科学院北京畜牧兽医研究所动物营养学国家重点实验室,北京100193;2.吉林大学食品科学与工程学院,长春130022;3.中国农业科学院北京畜牧兽医研究所,农业部奶产品质量安全风险评估实验室(北京),北京100193)
牛奶中糠氨酸检测方法的研究进展
陈冲冲1,2,3,郑楠1,3,文芳1,3,李明1,3,张焕1,2,3,任辉2,李松励1,3,王加启1,3
(1.中国农业科学院北京畜牧兽医研究所动物营养学国家重点实验室,北京100193;2.吉林大学食品科学与工程学院,长春130022;3.中国农业科学院北京畜牧兽医研究所,农业部奶产品质量安全风险评估实验室(北京),北京100193)
综合阐述了牛奶等食品中糠氨酸检测方法的最新进展,比较了高效液相色谱、液相色谱质谱联用、毛细管电泳质谱联用和表面荧光法在糠氨酸检测中的优缺点,为进一步开发牛奶等食品中糠氨酸检测的新方法提供参考。
牛奶;糠氨酸;营养;检测方法
0 引言
糠氨酸(Furosine)又称“呋喃素”,按照“国际纯粹和应用化合物系统命名法”(International Union of Pure and Applied Chemistry)缩写为IUPAC,其名字应该为“ε-N-2-呋喃甲基-L-赖氨酸”,是美拉德反应的重要产物。美拉德反应的程度与牛奶在加工过程中热处理的类型和强度有关,反映了热处理过程中营养成分的损失程度,液态乳品质的优劣。本文从糠氨酸的形成、现状、检测方法、应用等方面进行综述,为糠氨酸及其检测方法的研究提供参考。
1 糠氨酸的结构与来源
食品的质量主要取决于其组成成分和加工条件。食品的热加工会引起一系列化学反应,使食品营养物质的组成随之发生相应的变化[1]。这些化学反应主要包括脂肪氧化和美拉德反应,而糠氨酸正是美拉德反应的产物之一。美拉德反应可以分为初级阶段、高级阶段和最终阶段三个阶段[2]。美拉德的初级阶段是还原糖和氨基基团之间的反应。氨基酸基团与还原糖发生缩合反应形成席夫碱(Schiff’s base),后可以重排形成阿姆瑞德化合物(Amadori)。高级阶段,Amadori可以有三种不同的反应途径,分别是酸性环境、中性环境和碱性环境。三种不同的环境可以有不同物质的产生,分别是1,2-烯醇化反应生成3-脱氧酮醛糖,2,3-烯醇化反应产生1-脱氧酮醛糖,进一步生成还原酮类及脱氢还原酮类,和继续进行裂解反应,形成含羰基化合物,如4-脱氧氨基还原酮及羟甲基吡喃酮。最终阶段,由于反应太过于复杂,反应机理尚无较有说服力的理论,主要的产物是一种含氮的高分子物质类黑精,如图1所示,利用酸水解法从多肽链释放游离氨基酸用来促进1-deoxy-fructo⁃syl-l-lysine(AP)转换为环化希夫碱,最终转化为糠氨酸(Furosine)。因此,糠氨酸可以用于量化美拉德反应,而被广泛地用来衡量食品尤其是乳制品的热处理程度[2]。
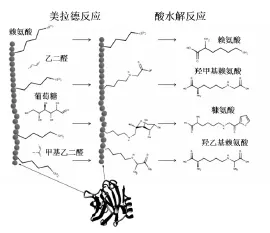
图1 美拉德反应酸水解反应示意图
糠氨酸作为美拉德反应的产物,可以很好地体现出美拉德反应程度,于是在1992年欧盟各国政府将糠氨酸质量分数作为鉴定液态乳品质的一个重要的指标,且糠氨酸的检测方法于1996年被国际奶业联合会正式公布,在2004年被国际标准化组织认可,颁布标准号18329[3]。蔬菜水果、谷物豆类、乳制品、肉制品、蜂王浆、酿造发酵和饲料等领域均以糠氨酸的质量分数作为衡量营养成分损失和食品质量的一项重要。首先,糠氨酸可被用于评价乳品等食品受热程度,影响糠氨酸质量分数变化的主要因素为乳品的热处理程度,糠氨酸可以很好的评价乳品的热处理程度,且反映出营养物质的热损伤程度。其次,糠氨酸可用于评价乳品等食品的贮藏时间,影响糠氨酸质量分数变化的次要因素为乳制品的贮藏时间,较长贮藏时间可以导致乳制品糠氨酸质量分数的增加。最后,糠氨酸可用于评价乳品的营养价值的损失,较高的糠氨酸质量分数和乳制品中蛋白等生物活性物质含量有较强的相关性,通过衡量糠氨酸质量分数可以粗略讨论营养物质的损失程度,糠氨酸与其他相关热敏感指标相结合,可以充分的补充糠氨酸作为营养成分损伤指标的单一性,更好的评价乳制品营养物质的损伤程度。
2 糠氨酸检测在奶制品中的应用
糠氨酸的质量分数主要与乳制品的加工工艺相关,反映了乳制品中赖氨酸的破坏量,是乳制品中早期美拉德反应的特异性标示物,可指示乳制品经受热处理的程度[4]。在牛奶中,糠氨酸经常作为一种牛奶营养物质热损伤程度的指标,糠氨酸的质量分数与牛奶中活性营养成分含量负相关[5]。糠氨酸还可以作为一种检测牛奶掺假(巴氏杀菌乳中添加复原乳、直接添加乳粉或添加炼乳)的重要指标,通过检测牛奶中的糠氨酸质量分数可以总体确定牛奶的加工工艺参数[6-12]。
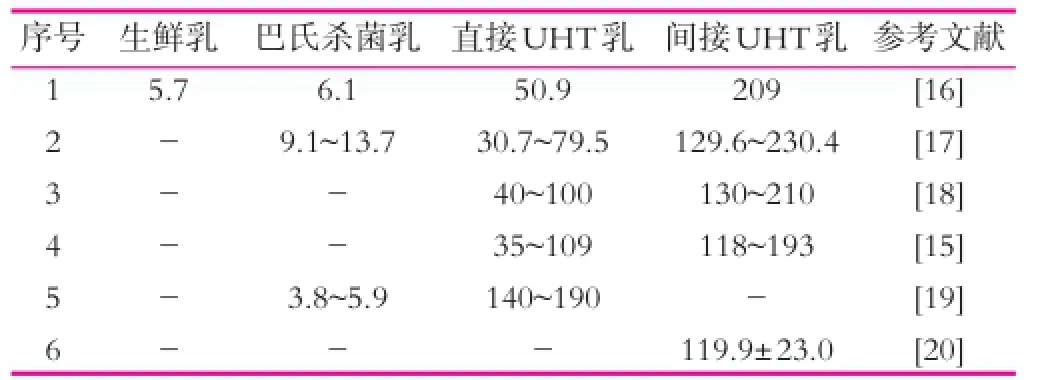
表1 不同牛奶的糠氨酸质量分数 mg/100g
影响牛乳中糠氨酸质量分数的因素主要有以下几点:不同的热处理方式[9,11,13]、贮藏时间和贮藏温度[6,14]。这些因素中,对糠氨酸影响最大的因素为牛乳的不同热处理方式,在牛乳热处理过程中,温度越高,热处理时间越长,糠氨酸的质量分数就会越高,且在牛乳贮藏过程中糠氨酸的质量分数还会持续的升高[15]。表1总结了部分文章中不同的加工工艺的乳制品中糠氨酸的质量分数分部范围,除加工条件对牛奶中糠氨酸质量分数的影响外,乳制品的贮藏温度和时间对糠氨酸质量分数也有较大的影响,Corzo[21]等报道,乳制品在20℃、30℃和40℃的条件下贮藏90 d,糠氨酸的质量分数是不同的,其中贮藏在20℃时,糠氨酸质量分数升高8.3~48.6 mg(每100 g蛋白质中);贮藏在30℃时,糠氨酸升高77~157 mg(每100 g蛋白质中);贮藏在40℃时,糠氨酸升高66~312 mg(每100 g蛋白质中)。
糠氨酸不但在牛奶中的研究较为深入,而且在其他食品工业中也有广泛的应用。例如,蔬菜[22]、水果[23-25]、谷物[26-29]、豆类[30-32]、肉制品[33-34]等领域。
3 糠氨酸检测方法
糠氨酸质量分数是牛奶等食品行业评价产品质量和安全的重要指标。根据糠氨酸检测方法的发展顺序,目前,主要的检测方法有高效液相色谱(HPLC)、高效液相色谱串联质谱(HPLC-MS/MS)和毛细管色谱串联质谱(CE-MS/MS)方法。其中,HPLC是使用最早且应用最广的检测方法,国际乳品联合会简称国际乳联(IDF)标准和我国农业行业标准中使用的检测方法均为高效液相色谱法。随着检测技术手段的发展,检测设备的创新,大量学者努力开创出更加新颖、适应性更强、更加高效的检测方法。近几年,利用高效液相色谱串联质谱(HPLC-MS/ MS)和毛细管色谱串联质谱(CE-MS/MS)方法检测糠氨酸质量分数屡见报导。然而,几乎所有的糠氨酸检测方法都受到前处理方法的限制,Moreno,F Javier等[35]研究发现,为了阻止美拉德的反应的继续,使糠氨酸充分游离出蛋白质或肽链,必须使用浓度不小于6 mol/L的盐酸溶液。无论采用HPLC、HPLC-MS/ MS还是采用CE-MS/MS方法检测糠氨酸,糠氨酸前处理程序有近乎一致的相似性,虽然具体实施可能略有不同,但是如加入盐酸、高温水解和过滤除杂等关键程序都保持一致。故以下检测方法叙述中前处理方法不赘述。对于牛奶中糠氨酸质量分数检出限的问题,由于生鲜乳中固有的糠氨酸质量分数一般高于2 mg/100 g,故糠氨酸质量分数检测较少考察方法的检出限和定量限的问题。
3.1 HPLC
高效液相色谱法(HPLC)是经典的化学分析检测方法,具有高速、高效和高灵敏度等优势,其原理是溶于流动相(mobile phase)中的各组分经过固定相时,由于与固定相(stationary phase)发生作用(吸附、分配、离子吸引、排阻、亲和)的大小、强弱不同,在固定相中滞留时间不同,从而先后从固定相中流出。HPLC的应用范围极广,具有超强的适用性。用于糠氨酸检测的主要液相色谱方法有:离子交换色谱法[36-38]、离子对反相色谱[11,20,39,40]等。
Sakkas L[41]等利用反相离子对色谱法(IP-RPHPLC)检测牛奶中的糠氨酸质量分数,样品运行时间为30 min,糠氨酸的保留时间是15 min左右。取2 mL的牛奶样品和6 mL的10.6 mol/L的盐酸溶液放入可以密闭的小瓶中,向小瓶中连续冲入氮气2 min后密闭小瓶,放入110℃的干燥箱中保持23 h,视为糠氨酸全部游离在溶液中。23 h后取出水解瓶冷却到室温后使用Whatman 5951/2的滤纸过滤掉滤渣。滤液使用反相固相萃取柱(SPE)浓缩除杂,使用3 M的盐酸洗脱复溶糠氨酸,含有糠氨酸的洗脱液使用旋转蒸发器蒸干,干提取物使用3.5 mL体积分数为5%乙腈/0.2%(体积分数)甲酸水溶液进行复溶,过0.22μm的PVDF滤膜。以下使用HPLC检测糠氨酸的方法与此方法大同小异。Roldan M[37],Corzo-Martinez, Marta[40],Lopez-Sanz,Sara[42]同样是使用离子对反相色谱检测牛奶中的糠氨酸。Corzo-Martinez,Marta[40]的糠氨酸检测方法中样品运行时间为30 min,保留时间21 min。Zilic,S[43]等使用液相方法检测豆类制品中的糠氨酸质量分数,因为原料是固体,但是前处理也是经过水解,过滤,固相萃取然后上机等过程。作者考虑到水解液水解完成后,会有大量的色素类物质产生,这些物质可能会干扰糠氨酸的检测,故作者在过滤纯化水解液时使用了Oasis HLB cartridge固相萃取柱。使用Atlantis HILIC column作为分离柱,液相条件是使用1%的甲酸水溶液,流速为1.0 mL/min,柱温是40℃。ISO 18329号标准中HPLC能够检测出生鲜乳中糠氨酸的质量分数。在我国农业行业标准中HPLC的检出限为1.0 mg/100 g,定量限为3.0 mg/100 g,可以正常检测出生鲜乳中糠氨酸质量分数。
对于液相色谱自身而言,其色谱柱可以反复的使用,可维护性强等特点使HPLC方法可以被大众所接受。但是HPLC方法存在一些局限性:检测时间较长,由于糠氨酸上机液过酸导致色谱系统容易损坏等。
3.2 HPLC-MS/MS
液质联用(HPLC-MS/MS)又被称为液相色谱质谱联用,它与液相色谱的构成相似,但是检测器被质谱仪充当,即分离系统是由液相色谱构成,检测器不是传统的HPLC使用的二极管阵列、紫外或荧光检测器而是质谱。液相色谱质谱联用检测样品时,首先样品在液相色谱部分由于流动相和色谱柱的作用,使样品得到初步的分离,然后流出液相色谱部分时,质谱仪会使流动相中的样品发生离子化,离子化后的样品经过质谱分析仪,离子碎片将按照质量分数分开,经过检测器而得到质谱图。
HPLC-MS/MS方法的前处理方法与HPLC相似,但因HPLC-MS/MS对上机液和流动相有更高的要求,这就决定了HPLC-MS/MS方法的前处理过程更加复杂。与HPLC方法相比,HPLC-MS/MS方法增加的前处理过程有氮气吹干过程、复溶过程。HPLC-MS/MS对前处理过程要求更加严格的同时,对流动相的要求也相对严格:不能高于5 mmol/L的盐溶液流动相等。Troise,Antonio Dario[44]等利用HPLC-MS/MS的方法检测牛奶中的糠氨酸质量分数,取可以密闭的玻璃瓶,向其中加入100 mg的样品和4 mL的6 mol/L的盐酸,然后连续充氮气15 min,之后密封小瓶,在110℃的干燥箱中水解20 h。水解完成后使用聚偏二氟乙烯过滤器(PDVF)进行过滤,取400μL水解液使用氮吹仪吹干。复溶之后通过在线过滤器除杂和浓缩之后直接进入液相色谱质谱系统。分离检测糠氨酸的液相系统使用的是反相的色谱柱(Kinetex C18 2.6μL,2.1 mm×100 mm Phe⁃nomenex,Torrance)。使用的流动相:溶液A为5 mmol/L的全氟戊酸水溶液,溶液B是乙腈溶解的5 mmol/L的全氟戊酸。流动相的流速是200μL/min,通过溶液B的流动梯度(时间(min)/B的比例):(0/ 10),(2/10),(5/70),(9/90),(10/90),(12/10),(15/ 10)。离子源是采用的点喷雾电离,质谱参数为:喷雾电压5.0 kV;毛细管温度350℃;驻留时间100 ms;碰撞气和气帘气被设置为45和5任意单位(arbitrary units)。色谱图选择的是MRM模式,使用的质谱室三重四极杆API3000。液相色谱串联质谱检测糠氨酸检出限可达0.003 mg/L定量限可达0.009 mg/L,线性范围是0.009 mg/L至1 mg/L。
液相色谱质谱联用体现了液相色谱和质谱的优势互补,既具有液相色谱对复杂成分样品的超高的分离能力,又表现出质谱的高选择性、高灵敏度的特点。在药物、食品和环境分析等诸多领域都得到了广泛的应用。虽然液相色谱质谱联用具有明显的优势,但是也有其明显的不足,极高灵敏度所付出的代价就是前处理异常复杂。
3.3 CE-MS/MS法
毛细管电泳(capillary electrophoresis,CE)是一种基于待分离物组份间淌度和分配行为差异而实现分离的电泳新技术。毛细管电泳技术和质谱分析技术相结合成为分析生物大分子物质的优良分析仪器。
Bignardi,Chiara[45]等利用毛细管电泳技术检测食品中的糠氨酸。样品水解完成后,使用0.45μm的PTEE滤膜对水解液进行过滤,然后使用氮气吹干。使用2.5 mL的电泳缓冲液(50 mmol/L的甲酸水溶液,pH值为2.7)复溶被吹干的水解液干燥物,复溶物使用0.22μm的PTEE膜过滤。在使用毛细管电泳之前,新的毛细管电泳必需使用0.1 mol/L盐酸润洗5 min,之后,使用超纯水润洗5 min。这些程序是为了避免ESI被污染。雾化气体为纯度99.999%的氮气,气压为68.95 kPa,干燥气(纯度99.999%的氮气)流速为5 L/min,干燥温度200℃,ESI设置为正离子模式,电压3.5 kV。毛细管电泳串联质谱检测糠氨酸检出限可达0.07 mg/L定量限可达0.25 mg/L,回收率77%~97%。
毛细管电泳串联质谱检测糠氨酸报导较晚且使用较少。虽然毛细管电泳对某些物质具有较好分离检测效果,但是毛细管电泳也有其固有的缺点:仪器维护和使用的成本较高,且检测速度较慢,前处理程序复杂。
3.4表面荧光法
固体表面荧光测定分析方法可以分为两种,其一是直接测定待测物质表面的荧光特性,其二是通过某些前处理方法使待测物质可以吸附在固体的表面,然后进行荧光分析,通过样品的荧光强度和标准物质的荧光强度对比进行定量的测定。
Yang Xiaoqian[46]使用表面荧光的方法检测牛奶中的糠氨酸的质量分数。取5 mL样品加入石英比色皿中(10 mm×18 mm×45 mm),放置于固体样品支架中。测定美拉德反应程度,激发波长设定为360 mm,发射波长为400至600 mm。提伟钢[47]使用表面荧光法,以美拉德反应的产物糠氨酸为指标,检测生牛乳中添加复原乳的含量。通过和HPLC方法检测糠氨酸相对比,发现荧光强度值超过70可以判断生乳中含有复原乳。当牛奶掺加复原乳的比例达到10%,用表面荧光方法即可检出。
固体表面荧光检测方法是一种快速方便的检测方法,但此检测方法不可控因素较多,应用范围较窄,方法开发进展缓慢。
4 结束语
现今已经开发出如HPLC、HPLC-MS/MS、CE-MS/ MS和表面荧光法等高效率检测方法,但是,无论是我国的农业行业标准还是IDF或ISO的标准,迄今糠氨酸的检测存在着较多亟需解决的问题。其一,糠氨酸的检测所用时间较长,在前处理过程中,要经过最少23 h的消化水解,不能很好的实现高通量的检测。其二,样品经过强酸处理,且在进入色谱系统或其他检测系统之前,酸度并没有显著的降低,不能避免的对检测设备产生较大危害。对于表面荧光法而言,其最大的弊端是不能准确的定量糠氨酸的质量分数,虽然能够在复原乳鉴定方面起到一定作用,但是其检出限较高,可能实际价值较低。以上这些问题又对糠氨酸的检测提出了更高的要求,糠氨酸检测方法的开发急需提向日程。伴随着更多高效快捷的检测方法和检测工具的问世,糠氨酸检测方法需要紧跟技术发展潮流,更多的利用最新检测设备,提高糠氨酸的检测效率。
[1]VAN BOEKEL M,FOGLIANO V,PELLEGRINI N,et al.A review on the beneficial aspects of food processing[J].Mol Nutr Food Res, 2010,54(9):1215-1247.
[2]KRAUSE R,KNOLL K,HENLE T.Studies on the formation of fu⁃rosine and pyridosine during acid hydrolysisof different Amadori prod⁃ucts of lysine[J].Eur Food Res Technol,2003,216(4):277-283. DOI:10.1007/s00217-002-0649-0
[3]许国庆,赵慧芬,李克杰,等.乳与乳制品中糠氨酸含量的测定方法[J].中国奶牛,2006,7):44-46.
[4]BURTON H.Reviews of the progress of dairy science:the bacterio⁃ logical,chemical,biochemical and physicalchanges that occur in milk at temperatures of 100 150°C[J].Journalof Dairy Research,1984,51 (02):341-363.
[5]SEIQUER I,DELGADO-ANDRADE C,HARO A,et al.Assessing the effects of severe heat treatment of milk on calcium bioavailability: in vitro and in vivo studies[J].JDairy Sci,2010,93(12):5635-5643.
[6]CHO Y H,HONG S M,KIM C H.Determination of Lactulose and Furosine Formation in Heated Milk as a Milk Quality Indicator[J]. Korean JFood Sci An,2012,32(5):540-544.
[7]RUIZ-MATUTE A I,CORZO-MARTINEZ M,MONTILLA A, et al.Presence of mono-,di-and galactooligosaccharides in commer⁃cial lactose-free UHT dairy products[J].J Food Compos Anal,2012, 28(2):164-169.
[8]HO Y K,ZAKRZEWSKI S F,MEAD L H.Hydrophobic interac⁃tions between the 5-alkyl group of 2,4-diamino-6-methylpyrimi⁃dines and dihydrofolate reductase[J].Biochemistry-Us,1973,12(5): 1003-1005.
[9]SUZUKI T,AKIYAMA M,MATSUI H,et al.Changes in Physico⁃chemical Properties and Sensory Characteristics of UHT Milk Pasteur⁃ized by Indirect and Direct Heating Methods during Storage at 10 de⁃grees C[J].Journalofthe Japanese Society for Food Science and Tech⁃nology-Nippon Shokuhin Kagaku Kogaku Kaishi,2014,61(5): 199-205.
[10]LORENZEN P C,CLAWIN-RAEDECKER I,EINHOFF K,et al.A survey of the quality of extended shelf life(ESL)milk in rela⁃tion to HTST and UHT milk[J].Int J Dairy Technol,2011,64(2): 166-178.
[11]MAYER H K,RABA B,MEIER J,et al.RP-HPLC analysis of fu⁃rosine and acid-soluble beta-lactoglobulin to assess the heat load of extended shelf life milk samples in Austria[J].Dairy Sci Technol, 2010,90(4):413-428.
[12]PELLEGRINO L,CATTANEO S,MASOTTI F,et al.Detection of milk powder and caseinates in Halloumi cheese[J].J Dairy Sci, 2010,93(8):3453-3460.
[13]SAKKAS L,MOUTAFI A,MOSCHOPOULOU E,et al.Assess⁃ment of heat treatment of various types of milk[J].Food Chem, 2014,159(293-301.
[14]ELLIOTT A J,DATTA N,AMENU B,et al.Heat-induced and other chemical changes in commercial UHT milks[J].Journal of Dairy Research,2005,72(72):442-446.
[15]VAN RENTERGHEM R,DE BLOCK J.Furosine in consumption milk and milk powders[J].International Dairy Journal,1996,6(4): 371-382.
[16]TIRELLI A,PELLEGRINO L.Determination of furosine in dairy products by capillary zone electrophoresis:A comparison with the HPLC method[J].ItalJFood Sci,1995,7(4):379-385.
[17]BIRLOUEZ-ARAGON I,NICOLAS M,METAIS A,et al.A rap⁃id fluorimetric method to estimate the heat treatment of liquid milk [J].International Dairy Journal,1998,8(9):771-777.
[18]PELLEGRINO L,DENONI I,RESMINI P.Coupling of Lactulose and Furosine Indexes for Quality Evaluation of Sterilized Milk[J].In⁃ternational Dairy Journal,1995,5(7):647-659.
[19]MORTIER L,BRAEKMAN A,CARTUYVELS D,et al.Intrinsic indicators for monitoring heat damage of consumption milk[J].Bio⁃technologie,Agronomie,Sociétéet Environnement,2000,4(4): 221-225.
[20]RAUH V M,JOHANSEN L B,BAKMAN M,et al.Protein lacto⁃sylation in UHT milk during storage measured by Liquid Chromatog⁃raphy-Mass Spectrometry and quantification of furosine[J].Int J Dairy Technol,2015,68(4):486-494.
[21]CORZO N,L PEZ-FANDI O R,DELGADO T,et al.Changes in furosine and proteins of UHT-treated milks stored at high ambient temperatures[J].Z Lebensm Unters Forch,1994,198(4):302-306.
[22]RUFI N-HENARES JÁ,GUERRA-HERN NDEZ E,GARC A-VILLANOVA B.Effect of red sweet pepper dehydration condi⁃tions on Maillard reaction,ascorbic acid and antioxidant activity[J].J Food Eng,2013,118(1):150-156.
[23]DAMIANI C,ASQUIERI E R,LAGE M E,et al.Study of the shelf-life of a mixed araca(Psidium guineensis Sw.)and marolo(An⁃nona crassiflora Mart.)jam[J].Ciencia Tecnol Alime,2012,32(2): 334-343.
[24]GAMBOA-SANTOS J,MEGIAS-PEREZ R,CRISTINA SORIA A,et al.Impact of processing conditions on the kinetic of vitamin C degradation and 2-furoylmethylamino acid formation in dried straw⁃berries[J].Food Chem,2014,153(164-170.
[25]PRIMAVESI L,PRAVETTONI V,BRENNA O V,et al.Influence of technological processing on the allergenicity of tomato products [J].Eur Food Res Technol,2011,232(4):631-636.
[26]CASIRAGHI M C,PAGANI M A,ERBA D,et al.Quality and nu⁃tritional properties of pasta products enriched with immature wheat grain[J].Int JFood Sci Nutr,2013,64(5):544-550.
[27]ZILIC S,MOGOL B A,AKILLIOGLU G,et al.Effects of infrared heating on phenolic compounds and Maillard reaction products in maize flour[J].J Cereal Sci,2013,58(1):1-7.DOI:10.1016/j. jcs.2013.05.003
[28]BIGNARDI C,CAVAZZA A,RINALDI M,et al.Evaluation of thermal treatment markers in wheat flour-derived products cooked in conventional and in low-emissivity ovens[J].Food Chem,2013, 140(4):748-754.
[29]MALGORZATA W,KONRAD P M,ZIELINSKI H.Effect of roasting time of buckwheat groats on the formation of Maillard reac⁃tion products and antioxidant capacity[J].Food Chem,2016,196 (355-358.
[30]ZILIC S,MOGOL B A,AKILLIOGLU G,et al.Effects of extru⁃sion,infrared and microwave processing on Maillard reaction prod⁃uctsand phenolic compounds in soybean[J].JSci Food Agr,2014,94 (1):45-51.DOI:10.1002/jsfa.6210
[31]WELLNER A,NUSSPICKEL L,HENLE T.Glycation compounds in peanuts[J].Eur Food Res Technol,2012,234(3):423-429.
[32]TORO-FUNES N,BOSCH-FUSTE J,LATORRE-MO⁃RATALLA M L,et al.Isoflavone profile and protein quality during storage ofsterilised soymilk treated by ultra high pressure homogeni⁃sation[J].Food Chem,2015,167:78-83.
[33]YAMAGUCHI K,NOMI Y,HOMMA T,et al.Determination of Furosine and Fluorescence as Markers of the Maillard Reaction for the Evaluation of Meat Products during Actual Cooking Conditions [J].Food Sci TechnolRes,2012,18(1):67-76.
[34]ZARDETTO S,DALLA ROSA M.Effect of Different Industrial Pasteurization Conditions on Physicochemical Properties of Egg-Filled Pasta[J].JFood Process Eng,2015,38(4):374-384.
[35]MORENO F J,MOLINA E,OLANO A,et al.High-pressure ef⁃fects on Maillard reaction between glucose and lysine[J].J Agr Food Chem,2003,51(2):394-400.
[36]HENLE T,WALTERA W,KLOSTERMEYERH.A simple meth⁃od for the preparation of furosine and pyridosine reference material [J].Zeitschrift fur Lebensmittel-Untersuchung und-Forschung, 1994,198(1):66-67.
[37]ROLDAN M,LOEBNER J,DEGEN J,et al.Advanced glycation end products,physico-chemical and sensory characteristics of cooked lamb loins affected by cooking method and addition of flavour pre⁃cursors[J].Food Chem,2015,168(487-495.
[38]SCHLIMP G.Estimation by paper chromato-graphy of the free ami⁃no acidsin milk[J].Bodenkultur,1964,14A(4):350-376.
[39]FONTAINE E,SAVARD R,TREMBLAY A,et al.Resting meta⁃bolic rate in monozygotic and dizygotic twins[J].Acta geneticae me⁃dicae etgemellologiae,1985,34(1/2):41-47.
[40]CORZO-MARTINEZ M,MONTILLA A,MEGIAS-PEREZ R, et al.Impact of high-intensity ultrasound on the formation of lactu⁃lose and Maillard reaction glycoconjugates[J].Food Chem,2014,157 (186-192.DOI:10.1016/j.foodchem.2014.01.072
[41]SAKKAS L,MOUTAFI A,MOSCHOPOULOU E,et al.Assess⁃ment of heat treatment of various types of milk[J].Food Chem, 2014,159(293-301.
[42]LOPEZ-SANZ S,MONTILLA A,MORENO F J,et al.Stability of oligosaccharides derived from lactulose during the processing of milk and apple juice[J].Food Chem,2015,183(64-71.
[43]ZILIC S,MOGOL B A,AKILLIOGLU G,et al.Effects of extru⁃sion,infrared and microwave processing on Maillard reaction prod⁃ucts and phenolic compounds in soybean[J].JSci Food Agric,2014, 94(1):45-51.
[44]TROISE A D,FIORE A,WILTAFSKY M,et al.Quantification of Nepsilon-(2-Furoylmethyl)-L-lysine (furosine), Nepsilon-(Car⁃boxymethyl)-L-lysine(CML),Nepsilon-(Carboxyethyl)-L-lysine (CEL)and total lysine through stable isotope dilution assay and tan⁃dem mass spectrometry[J].Food Chem,2015,188(357-364.
[45]BIGNARDI C,CAVAZZA A,CORRADINI C.Determination of furosine in food products by capillary zone electrophoresis-tandem mass spectrometry[J].Electrophoresis,2012,33(15):2382-2389.
[46]ARZT G H.[Lung function disturbances in fibrosis][J].Der Inter⁃nist,1974,15(7):364-369.
[47]提伟钢,霍贵成.一种快速检测复原乳的方法[J].食品工业科技, 2007,28(8):239-242.
Research progress on detection method of furosine in milk
CHEN Chongchong1,2,3,ZHENG Nan1,3,WEN Fang1,3,LI Ming1,3,ZHANG Huan1,2,3,REN Hui2,LI Songli1,3,WANG Jiaqi1,3
(1.State Key Laboratory of Animal Nutrition,Institute of Animal Science Chinese Academy of Agriculture Sciences,Bei⁃jing 100193,China;2.School of Food Science and Technology,Jilin University,Changchun 130022,China;3.Ministry of Agricultural Milk and Dairy Inspection and Supervision Center(Beijing),Institute of Animal Science Chinese Acade⁃my of Agricultrue Sciences,Beijing 100193,China)
The method introduces the high performance liquid chromatography(HPLC),liquid chromatography-mass spectrometry,capil⁃lary electrophoresis mass spectrometry hyphenated and surface fluorescence method.In order to provide references for the further develop⁃ment offurosine in milk and other food.
furosine;milk;nutrition;detection method
TS252.7
B
1001-2230(2017)04-0025-05
2016-06-29
生鲜乳质量安全风险评估专项(GJFP2016009);中国农业科学院科技创新工程(ASTIP-IAS12);公益性行业(农业)科研专项(201403071);现代农业产业技术体系专项资金(NY⁃CYTX-04-01)。
陈冲冲(1992-),男,硕士,研究方向为食品科学与工程、牛奶质量与安全。
李松励

