短期辅助用直流电磁驱动搏动式血泵设计与测试
刘京京 葛 斌 陆 通 魏凌轩 张 磊 董骄阳
(上海理工大学医疗器械与食品学院,上海 200093)
引言
体外膜肺氧合(extracorporeal membrane oxygenation, ECMO)在1972年首次成功治愈一例急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)患者,在这之后的40多年里,ECMO经历了两次重要革新,期间在1990年成为新生儿和儿童心肺疾病的标准护理方法,并将在未来10年向第三代ECMO快速发展[1]。另外,目前针对在器官移植过程中离体器官的灌注也被大量研究。血泵作为上述两类器械的核心组件之一,在离体器官的灌注过程中,以及在ECMO被用于心脏手术或治疗ARDS中,起到提供血液驱动力以完成体外循环的关键作用。
目前应用的血泵主要有滚压泵和离心泵两种。从早期的体外循环(cardiopulmonary bypass, CPB)至今,由于良好的搏动血流和相对低廉的成本,滚压泵在不断改进中已有超过60年的使用历史;但在其运行过程中,泵头对泵管产生极高的压力,从而血液创伤较高,进而对肾脏及其他机能造成损伤[2-4]。对血液破坏更小的离心泵目前应用更为广泛,针对儿童或成人患者均表现出更好的治疗效果[5-6]。但其泵头高速运转时产生负压从而发生溶血,另外其恒压输出易导致血管和其他器官的形态学改变和出血,针对离心泵搏动性控制的研究目前尚在探索[7-8]。因此,结合磁耦合和机械传动一体的新型驱动模式也在血泵领域有所探索[9],若能研制出兼备以上优点的新型血泵,将有利于进一步推进离体器官灌注和ECMO的普及和发展。
根据电磁学原理,本研究提出了一种利用直流螺线管实现永磁体往复直线运动的方法,继而结合容积控制原理设计了一种新型血泵——直流电磁驱动搏动式血泵。该血泵的设计目标为:首先在器官移植过程中,对离体器官的灌注和心肺手术过程中的短期辅助体外循环持续优化设计,最终替代目前ECMO中的血泵,实现长期体外循环辅助。在设计过程中,通过数值模拟设计了一种内部趋于匀强磁场的补偿螺线管结构作为血泵驱动结构,并针对常见的电磁感应发热问题进行了理论和实验验证,最后制作了血泵样机,并通过搭建加速度实验台和流量实验台,分别对血泵样机进行了性能指标的测试,证明了该血泵性能满足设计要求,满足离体器官灌注和体外循环短期辅助临床的要求。
1 设计与实验方法
1.1 驱动原理及方法
根据电磁学原理,将漆包线密绕在塑料制中心管上而制成的有限长螺线管水平放置,接入直流电流,此时若永磁体磁极方向与感应磁场方向一致,且永磁体端面在螺线管端面磁场的磁力有效范围内,则置于螺线管任意一个端面处的轴向磁化圆柱形永磁体(以虚线表示)将在不平衡的磁力作用下运动至螺线管中心,如图1所示。

图1 永磁体在通电有限长螺线管内部运动Fig.1 The schematic diagram of movement of a magnet inside a finite solenoid with current
根据图1所述原理,无需改变螺线管接入的直流电流方向,便可实现永磁体的往复直线运动。将多个螺线管排列密绕在中心管的圆柱外表面上,每个螺线管的长度和旋向相同;使每个螺线管长度均等于永磁体的宽度,根据通电螺线管的外部磁场特性,在依次对相邻螺线管接入相同方向的直流电流并断开当前螺线管电源时,永磁体便会依次运动至在相邻螺线管中间位置。
利用此方法,只需对每个螺线管接入直流电流的时机及时长进行控制,便可实现永磁体的往复直线运动——当永磁体的中心横截面首次运动至螺线管内某个位置的同时(该位置不超过螺线管的中心横截面),使运动方向上相邻螺线管接入直流电流并断开当前螺线管电源,实现了永磁体的往复直线运动。另外,对每个螺线管接入直流电流的大小和变化进行控制,便可控制永磁体的运动参数的变化(如速度、加速度)。
1.2 血泵结构设计
1.2.1泵体材料及结构设计
结合容积控制原理以及上面所述永磁体的往复直线运动的实现方法,直流电磁驱动搏动式血泵结构如图2所示。
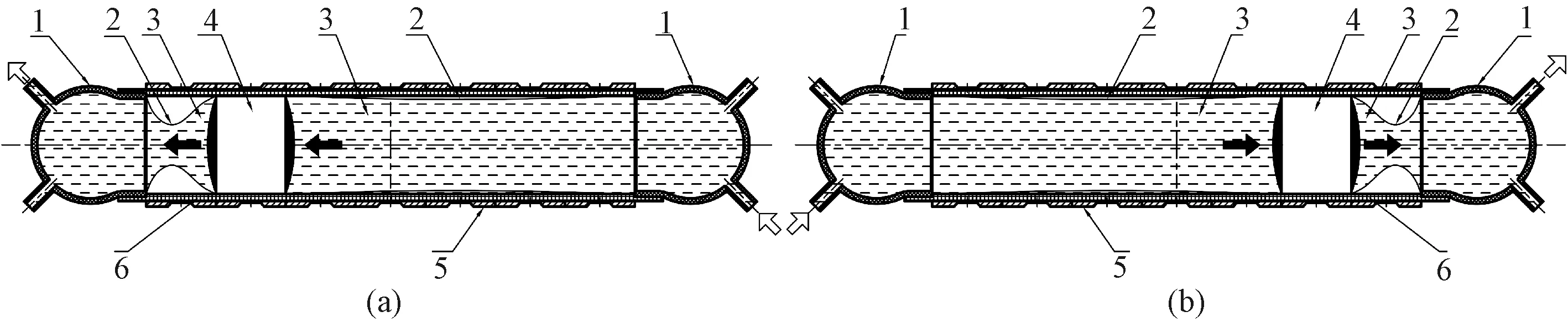
图2 血泵结构及运动示意(1—壳体;2—弹性薄膜;3—血液;4—动子;5—补偿螺线管;6—中心管;实体箭头—动子运动方向;空心箭头—血液流动方向)。(a)向左侧运动;(b)向右侧运动。Fig.2 The diagram of the structure of blood pump body and the movement (1-housing, 2-elastic film, 3-blood, 4-mover, 5-solenoids with compensation coils, 6-central tube, solid arrow-motion direction of mover, and hollow arrow-motion direction of blood). (a) The diagram of movement towards left; (b) The diagram of movement towards right
其中,中心管为薄壁结构,材料为医用硬质塑料;永磁体和两侧密封液囊组成动子,液囊中充有生理盐水,使动子运动过程中与血液为柔性接触;动子的直径与中心管内径相同,采用高精度间隙配合,即两者间隙极小,这样既保证了动子运动过程中与中心管的高同轴度,又保证充分润滑条件下两者之间摩擦力较小;血泵两侧壳体由医用硬质塑料制成,每侧各有一个入口和出口,分别是由单向阀控制以防止血液倒流;动子两侧分别由材料延伸率达到300%的弹性薄膜及壳体组成的左右两个彼此密封的腔体,薄膜与中心管内壁之间充分润滑,腔体内均预充满血液,在直流电磁驱动下动子由右侧向左侧运动,则左侧的弹性薄膜被压缩使左侧腔体体积减小,血液经出口流出,而右侧的弹性薄膜被拉伸使右侧腔体体积增大,血液由外部储血装置经入口流入,反之亦然,实现搏动式泵血。
上述结构中,单向阀作为一个重要的部分,影响着血液在血泵中流动,目前ECMO中各个管路中均设置有类似的单向阀,且这些产品的性能优异,故本研究不单独设计单向阀。另外,根据血泵的设计目标,其工作时间多为数小时,因此目前有很多高分子材料可作为泵体材料中使用的弹性材料,相关材料的使用寿命一般可达数天,远超血泵的正常工作时间,故本研究也不进行材料使用寿命相关实验。
该血泵泵体和动子尺寸设计主要根据血流量要求而定。一般成年人静息时心脏每搏输出量为60~80 mL,正常心率为60~100 次·min-1,则血流量为3.6~8.0 L·min-1[10];另外,目前ECMO主要检测参数中要求血流量75~150 mL·(kg·min)-1,若病人体重为80 kg,则血流量为6~12 L·min-1[11];一般国内外应用的离心泵和滚压泵均可提供10 L·min-1的最大血流量[12]。根据上述不同参数,选取10 L·min-1为本血泵空载(不考虑前、后负荷的情况下)即最大搏动输出血量,另外为满足搏动要求,动子运动频率(以动子完成覆盖某方向的全部距离的运动为一次)需与成年人正常心率相同或相近,即60~100 次·min-1,取平均80 次·min-1,则该血泵的动子有效运动腔体体积需达到125 mL。考虑该血泵整体尺寸以及各尺寸取整后的结果,取动子直径35 mm、其中永磁体宽度25 mm和运动距离150 mm,则有效运动腔体体积为144.32 mL,满足血泵血流量的设计要求。
1.2.2补偿螺线管设计
根据上面所述永磁体的往复直线运动的实现方法,每个螺线管的长度与动子中永磁体宽度相等,又需要满足单次运动距离为150 mm,所以在中心管上需要排列密绕7个长度为25 mm的螺线管。
该螺线管长径比仅为1.25(25 mm/20 mm), 其内部磁感梯度很大。为了简化运动过程中动子受力的复杂程度,需使短螺线管内的磁场分布趋于均匀磁场,故从磁场叠加原理出发,采用对短螺线管两端边缘进行多层绕制补偿线圈的绕制方法[13]。根据现有研究,蔡旭红、李邵辉通过Matlab的模拟证明了有限长通电螺线管内部空间磁场分布表现:除了靠近两个端面及非常靠近螺线管壁的小部分区域外,螺线管内的磁场为沿轴向的匀强磁场[14]。因此,只要计算出螺线管轴线上的磁场,即可得到螺线管内空间磁场的大小。如图3所示的螺线管坐标,若主螺线管为单层密绕,则根据文献[15]单层螺线管轴线上任意一点z的轴向磁感应强度B0可表示为
(1)
式中:d为漆包线直径;μ0为真空磁导率,为4π×10-7T·m·A-1;I0为直流电流;l为螺线管长度;r为螺线管的半径;z为轴线上的点至螺线管中心O的距离。

图3 螺线管坐标Fig.3 The coordinate of solenoid
在对具有多层补偿线圈的短螺线管轴线上感应磁场进行计算时,把每层补偿线圈等效为端面与原单层螺线管端面重合的新螺线管,则相应在轴线上产生的磁感应强度为
(2)
式中:n为补偿线圈的层数,为1,2,3,…;ln为第n层补偿线圈长度,是d的整数倍;zn为第n层补偿线圈中心距原单层螺线管中心的距离。
根据磁场叠加原理,最终通过进行绕制多层补偿线圈的方法,获得补偿螺线管轴线上的磁感应强度为
(3)
式中,N为补偿线圈总层数。
根据泵体设计数据可知,l=25 mm,r=20 mm,其他计算参数取I0=1 A,d=0.41 mm。由于螺线管为对称结构,所以只需计算其一侧的磁感应强度。利用Wolfram Mathematica软件,对式(3)进行计算和模拟,即得到了补偿螺线管的绕制方法。
1.3 理论要求计算
1.3.1磁力驱动力理论计算
作为体外循环的重要性能指标之一,血泵可提供的磁力驱动力直接影响血泵运行。根据能量守恒定律,可知动子运动过程中(从初始位置的静止状态至末端位置的静止状态),其所受的平均合力在单位时间内做的功等于血泵泵血所消耗的功率,即
PQ=vF0L
(4)
式中:P为血泵输出端的压强,即血泵的后负荷;Q为血泵流量;ν为动子运动频率;F0为动子所受合力;L为动子每次运动距离。
正常成年人平均动脉压正常值为70~105 mmHg(1 mmHg=133.3 N·m-2)[16],而ECMO过程中的设定值略小于该正常值,故取上限值Pmax=100 mmHg。根据上面的设计数据,Q=10 L·min-1,L=150 mm,ν=80 次·min-1,求得理论上动子每个运动过程中所需平均合力F0=1.133 N。动子运动过程中,所受阻力包含与中心管的滑动摩擦和血泵输出端的压强:在血泵正常工况下,通常将血泵内的滑动摩擦视为混合摩擦状态,此时滑动摩擦系数f混的数值一般在0.01~0.001数量级,根据所设计的动子尺寸以及其材料密度等参数计算滑动摩擦力F1=0.02 N;根据国家标准,体外循环用于向主动脉供血时使用管路内径通常为3/8 吋,即9.525 mm,故血液阻力F2=0.097 N。为满足实际运动需求,摩擦力和阻力分别取安全系数为2并将结果向上取整,得到F1=0.05 N,F2=0.20 N,所需平均磁力驱动力F=F0+F1+F2=1.383 N。
1.3.2通电螺线管发热问题理论计算
该血泵驱动原理基于通电螺线管电磁感应现象,而且在其他相关领域电磁感应的发热问题一直存在,因此,本研究对通电螺线管在血泵相应工况下的发热问题进行数值模拟。
在基本电学和传热学推导中,以单个螺线管从一次开始通电到下次开始通电为一个周期,另外由于血泵运行中血液储备量大,故假设环境和血液为恒温,那么最有可能对血液造成破坏的区域为螺线管与血液接触的内表面温度。在其他条件不变的情况下,该温度只与完成通电周期的次数相关的函数为
(5)
式中,n为单个螺线管完成通电周期的次数,T0为螺线管初始温度,h为对流换热系数,A为换热面积,m为螺线管质量,c为螺线管比热容,t0为通电周期,I为螺线管所接入的电流,R为螺线管电阻,T∞为环境及血液温度。
由于空气自然对流换热系数与液体自然换热系数相比,可忽略不计,故式(5)只考虑螺线管与血泵内液体的对流换热对螺线管内表面温度的影响。
1.4 实现方法及实验台搭建
制作血泵样机,并且分别搭建加速度实验台和流量实验台,以测试样机的性能指标。
1.4.1实验方法
加速度实验中,由于该血泵的每个补偿螺线管结构完全一致,所以将每个补偿螺线管分别接入直流电流,并将加速度传感器与动子固定,空载的状态下,测量动子在血泵样机接入不同电流大小时的相应加速度变化走势并读取其最大值。以4/3 Hz为例的血泵搏动频率中,由于动子在单个螺线管中运动时间不到0.11 s,故该最大值将被近似为动子运动过程中所受的平均驱动力。
测量通电螺线管发热时,将血泵样机中动子取出,并预充满生理盐水,对单个螺线管循环其通电周期,电流大小为满足其驱动力需求时的最小电流。用功率为4.5 W的散热风扇对血泵样机散热,此时血泵内部为生理盐水的自然对流换热,而外部为空气强制对流换热,经过不同时间测量螺线管的内表面和外表面的温度。
流量实验台通过控制液面高度以分别控制前、后负荷。区别在于安装在液体出口的液体溢出装置控制后负荷,将液体介质预充至不同长度细管的相应高度形成后负荷,当血泵运行时,液体介质受动子挤压由装置顶部排液口排出形成血泵流量,此时液体溢出装置内液体介质的液面不随之改变,即过程中后负荷为定值;而安装在液体入口的储液腔,同样需要预充液体介质至相应高度形成前负荷。当血泵运行时,液体介质在压力作用下流入血泵内,因其容积远大于液体溢出装置,故过程中其液面下降的高度可忽略不计,形成稳定的前负荷。进而,以生理盐水模拟血液作为液体介质测量不同前、后负荷情况下相应的流量。
1.4.2实验台搭建
加速度实验台包括血泵样机、加速度传感器、数据采集设备和直流电源等装置,用以测量动子运动过程中受到的磁力及变化走势,如图4所示。

图4 加速度实验台Fig.4 The photo of acceleration test bed
流量实验台包括血泵样机、液体溢出装置及压力表、储液腔以及直流电源等装置,用来测试血泵在不同前后负荷时的流量。为简化结构,将液体出口和入口分别设置在血泵样机两侧,如图5所示。

图5 流量实验台Fig.5 The photo of flow test bed
2 结果
2.1 补偿螺线管结构
通过上述补偿螺线管设计方法,经过数值计算和模拟,根据血泵结构设计中的尺寸要求,得到如下补偿螺线管结构:用直径0.41 mm的螺线管绕制长度为25 mm的两端双层补偿线圈,第一层长度为原单层螺线管长度的0.72倍,第二层长度为原单层螺线管长度的0.62倍,补偿螺线管结构如图6所示。此时除了在螺线管的内部磁感应强度得到加强以外,其磁感应强度的均匀区也达到最大。对比补偿螺线管与原单层螺线管可知,两者产生的磁感应强度如图7所示,若与中心处磁场强度误差在5%以内视为匀强磁场,则单层螺线管的匀强磁场的范围为41%,而补偿螺线管的匀强磁场范围达到87%。

图6 补偿螺线管结构(1—原单层螺线管;2—第一层补偿线圈;3—第二层补偿线圈;4—中心管)Fig.6 The structure diagram of compensation solenoid (1-single layer solenoid; 2-first layer compensation coils; 3-second layer compensation coils; and 4-part of central tube)

图7 轴线上磁感应强度Fig.7 The magnetic induction at axis
2.2 磁力驱动力测试结果
加速度实验台实验结果的基本统计量如表1所示,表中最大值与最小值取值范围为全样本,离群
样本数为含粗大误差的样本数目,平均值、标准差及变异系数均为剔除离群值后的样本参数。
由表1可知,在不同电流组内,实验结果的变异系数均在5%左右,说明重复实验所得实验结果之间偏离程度很小,而且实验结果的偏离基本由随机误差造成。该实验中所使用的加速度传感器型号为CT1 020 L,其精度为20.41 mV·s2·m-1,动子质量为110.8 g,经单位换算得到动子所受最大磁力如表2所示。
由该数据可知:动子做往复运动时所受最大磁力数值基本相同,且与补偿螺线管接入的电流大小呈正相关线性关系;当电流大小达到2.7 A时,动子所受最大磁力大于1.4 N已经满足计算所需磁力驱动力要求,只需控制血泵工作过程中电流变化即可优化动子运动过程中受力,并减少其对血液的影响。
2.3 通电螺线管发热计算和测试结果
在实验方法所述的条件下,式(5)中对流换热系数h取生理盐水的自然对流换热系数500,将螺线管接入加速度实验中得到的最小满足血泵磁力驱动力的电流2.7 A,其计算结果和实验测量结果如图8所示。由图8可知, 本研究所设计的补偿螺线管内表面的温度,即血泵与血液接触的面的温度,其由式(5)计算得到的结果与实测的实验结果基本吻合,在开始通电的最初20 s,温度从初始的26℃升高至27℃左右,继而进入动态平衡阶段,该阶段内电磁感应现象产生的热量与生理盐水自然对流换热散热相当,所以螺线管内表面温度不再继续升高。对于螺线管外表面,在通电开始后的首个60 s内快速从26℃升温至50℃,之后至7 min左右升温逐渐放缓,继而进入动态平衡阶段,最终平衡在55℃左右。

表1 加速度实验结果基本统计量Tab.1 The basic statistics of the acceleration experimental results

表2 动子所受最大磁力/NTab.2 The maximum of magnetic force of the mover/N

图8 螺线管计算和测量温度结果比较Fig.8 The calculation and measurement results of temperature of solenoid
2.4 流量测试结果
由于ECMO辅助过程中一般后负荷平均在60~80 mmHg,故流量实验台测试时取后负荷测试范围为50~80 mmHg,而前负荷范围为5~30 mmHg;由上述加速度实验台的实验结果可知,当电流达到2.7 A时血泵样机可满足驱动要求,故将血泵样机接入2.7 A的直流电流,并且设定动子运动一次的时间为0.75 s即频率为80 次·min-1,相同设定下将15次实验结果进行基本统计,由于数据量过多,在此不详细列出基本统计量表,仅将血泵流量的实验结果平均值列于表3。
表3直流电磁驱动搏动式血泵流量
Tab.3Theflowofthepulsatingbloodpumpdrivenbydirect-currentelectromagnetism

L·min-1
由表3可知,除前负荷与后负荷压差过大的情况下(不小于70 mmHg),血泵流量基本满足器官移植过程中离体器官灌注要求,即绝大多数ECMO中心在手术中所设定的短期辅助流量最低要求3.0 L·min-1以及上文提及的ECMO检测标准,且血泵流量最大值为9.864 L·min-1,该值与设计空载流量值10 L·min-1相近,故该血泵满足设计要求。
3 讨论
驱动原理和结构设计方面,滚压泵运行时由电机的旋转通过传动装置传入泵中心轴,从而带动滚轴在泵槽内旋转滚动,最终推动血液流动;离心泵通过安装在圆盘磁力耦合器之上的转子带动叶片或旋转椎体高速旋转推动血液沿切向运动[17-18]。两者的结构使得驱动力必须通过彼此连接的各个部件才能传递至执行机构,这样紧凑的结构限制了在上述血泵中添加柔性接触的可能,不可避免地造成一定程度的血液破坏。本研究所设计的新型血泵,根据其直流电磁驱动原理,电磁驱动力可在空间内进行传播,使得血泵的运动部分与驱动部分之间可以存在间隙用作布置柔性接触相关设计。因此,本研究在血泵动子两侧设计有充有生理盐水的液囊,使血泵在运行过程中独自始终与血液保持着液体与液体间的柔性接触,极大程度上减小了由滚压泵泵头挤压泵管或离心泵泵头与血液刚性接触的血液创伤。
磁力驱动力测试结果由表2可知,血泵空载时的磁力驱动力与接入直流电流大小呈良好的正相关线性关系,因此在实际应用中若前、后负压或其他条件变化较大,可随时调整接入直流电流大小,以满足相应的磁力驱动力的需求。另外,目前血泵样机接入直流电流大小数值尚小,如遇需更大驱动力的特殊情况,可适当增大接入直流电流。但由于试验条件限制,血泵在具有液体介质的载荷时的驱动力未能进行测量,且在不同载荷下的驱动力规律仍有待研究。
在血泵发热方面,因滚压泵的滚轴处于开放空间且通常情况下转速较低,不与血液直接接触,所以该类血泵的运行发热问题对血液影响较小;离心泵则由于其相对封闭的结构产生很多的摩擦力和热量,该热量一定程度上会造成溶血;相比之下,最新的磁悬浮离心泵通过利用磁悬浮技术,改进流动力学等措施,基本避免了发热造成的溶血问题[12,19]。同样地,根据通电螺线管发热的测试结果,如图10所示,该直流电磁驱动血泵,其内表面温度在实验条件下只升高1℃便进入动态平衡状态,该升温幅度并不会对血液造成破坏;虽然其外表面最终动态平衡在55℃左右,但并不与血液直接接触,所以在实际应用中同样不会对血液造成破坏。另外,无论数值计算还是实验测量,本研究均采用的是液体自然对流换热。在实际应用中,由于血泵搏动式的泵出血液,其换热方式应为液体强制对流换热。液体强制对流换热的换热能力通常为自然对流换热能力的10倍,因此其散热能力更强。综上所述,该血泵中通电螺线管的电磁感应现象的发热问题并不会影响血泵正常的使用,也不会对血液造成破坏。
由表3分析得到,本研究所设计的流量测试结果基本符合以下趋势:一是在实验条件下血泵流量与后负荷呈负相关,且其线性显著性随前负荷的增加而增加。二是血泵流量与前负荷呈正相关,其线性趋势更为显著但与后负荷无显著相关。三是通过多元回归得到,前负荷较后负荷对血泵流量具有更为显著的影响。四是将前负荷和后负荷形成的压差与血泵流量对比分析可知,血泵流量与压差线性负相关比较显著,但相同压差时,不同的前负荷和后负荷对血泵流量仍然具有非线性影响。目前,使用较为广泛的离心泵最大流量基本为10 L·min-1,技术相对新颖的磁悬浮离心泵大部分流量可维持在5 L·min-1左右,而在新生儿或婴儿体外循环中使用的小流量血泵基本流量为0.3~1.5 L·min-1[12,18]。相比之下,本研究所设计的血泵在压差较大的实验条件下,流量较少,但已经满足离体器官灌注和体外循环短期辅助的要求。
结合以上结果,该血泵将首先应用于器官移植过程中对离体器官的灌注,以及心肺手术中的短期辅助体外循环过程。
在后续研究中,首先将对具有液体介质载荷时的磁力驱动力及规律进行研究;其次,由于目前本研究仅采用生理盐水为液体介质进行流量测试,但是生理盐水与血液仍存在一定差异,后续研究中可采用动物血液等液体介质进行实验,测定全血条件下的血泵参数,以便更加真实地衡量该血泵的性能指标;再次,为使血泵运行过程中动子受力更加优化,血泵性能更加良好,计划将目前血泵接入的恒定直流电流优化成呈一定规律变化的直流电流,相关研究有待进行;最后,将对血泵搏动性相关指标进行实验论证,以进一步优化血泵设计和输出特性,从而达到体外循环长期辅助的设计目标。
4 结论
本研究结合磁耦合的新型驱动模式以及电磁学原理,提出了一种利用直流落实线管实现永磁体往复直线运动的驱动原理,继而设计了一种新型直流电磁驱动搏动式血泵,其中通过数值模拟的方法设计了一种内部磁场趋于匀强的补偿螺线管结构。制作血泵样机,并进行了动子加速度即血泵磁力驱动力测试,针对螺线管发热问题的理论和实验验证,和血泵流量指标测试。样机测试结果表明,该血泵的磁力驱动力和血泵流量均满足器官移植过程中离体器官灌注和心肺手中体外循环短期辅助的临床要求,但仍有进一步测试优化的空间。本设计的应用对于器官移植、术中辅助、ECMO的发展和推广以及对于体外循环血泵的发展都具有重要意义。
[1] Bartlett RH. ECMO: The next ten years [J]. Egyptian Journal of Critical Care Medicine, 2016, 4(1):7-10.
[2] Passaroni AC, Silva MADM, Yoshida WB. Cardiopulmonary bypass: development of John Gibbon's heart-lung machine [J]. Revista Brasileira De Cirurgia Cardiovascular, 2014, 30(2):235-245.
[3] 丁军. 改良滚压泵搏动灌注在小儿体外循环心脏手术中的临床对比研究 [J]. 中国伤残医学, 2016, 24(6): 62-63.
[4] 周玉姣,于坤. 体外循环红细胞损伤的原因、表现及危害 [J]. 中国体外循环杂志, 2015, 13(1): 61-64.
[5] 杨天宇, 龙村, 李春华,等. 离心泵在心血管领域中的应用—附66例临床病例总结 [J]. 中国循环杂志, 1996, 11(1): 678-680.
[6] 周成斌, 张镜芳, 章晓华, 等. 离心泵在小儿体外循环中的应用 [J]. 广东医学, 2005, 26(3): 335-336.
[7] Toomasian JM, Bartlett RH. Hemolysis and ECMO pumps in the 21st century [J]. Perfusion, 2011, 26(1): 5-5.
[8] 唐敏, 杨明. 基于模糊PI速度调制的离心血泵搏动性研究 [J]. 中国医疗设备, 2016, 31(1): 21-25.
[9] 谭江浩, 葛斌, 方旭晨, 等. 磁耦合驱动搏动式血泵的可行性研究 [J]. 医用生物力学, 2015, 30(5): 458-462.
[10] 王莲芸. 现代医学导论 [M]. 北京: 科学出版社, 2010.
[11] 陆铸今, 陆国平, 闫钢风. 体外膜肺的配置及实施 [J].中国小儿急救医学, 2015, 22(6): 438-442.
[12] 余洪龙, 解启莲. ECMO血泵研究进展 [J]. 医学信息, 2014, 27(4): 543.
[13] 王子煜, 宋瑞星, 李旭, 等. 螺线管磁场均匀型的改进 [J]. 科技展望, 2015, 25(30): 150.
[14] 蔡旭红, 李邵辉. 有限长通电螺线管内部空间磁场的模拟 [J]. 汕头大学学报(自然科学版), 2004, 19(2): 28-31.
[15] 温越琼, 王华军. 通电螺线管中磁场的计算机模拟 [J]. 西华大学学报(哲学社会科学版), 1999, 1(4): 17-19.
[16] 王庭槐. 生理学 [M]. 北京: 高等教育出版社, 2004.
[17] 路力军, 胡兆燕, 陈正龙,等. 体外循环用血泵研究进展 [J]. 北京生物医学工程, 2012, 31(4):433-439.
[18] 郭龙辉. 第三代血泵的研究进展 [J]. 中国胸心血管外科临床杂志, 2010, 17(4):321-325.
[19] Thiara AP, Hoel TN, Kristiansen F, et al. Evaluation of oxygenators and centrifugal pumps for long-term pediatric extracorporeal membrane oxygenation [J]. Perfusion, 2007, 22(5):323-326.

