阿司匹林-LDHs-壳聚糖微球的制备及其体外释放研究*
王启平 李 慧 王慧云 孙珊珊 丁 林 张 波 全先高△
(1济宁市任城区卫生监督所, 济宁 272000;2济宁医学院药学院,日照 276826)
阿司匹林是人工合成的非选择性环氧酶抑制剂,属于非甾体抗炎药。在临床上,阿司匹林用来解热镇痛、消炎抗风湿;还可对心血管疾病、糖尿病等有治疗作用。目前已研发的有肠溶剂、缓释与控释剂、复方制剂、泡腾剂、环糊精包合物等多种剂型[1-2]。目前研究缓释控释制剂将是阿司匹林剂型的发展方向[2-4]。微球作为一种缓控释剂型,采用高分子材料作为载体,其中明胶、壳聚糖(CS)、糊精等常被用作载体材料[5-9]。近年来,将药物插入LDHs层板之间,形成药物-纳米杂化物因的研究报道屡见报道[10-14],但是把Cs插入LDHs形成有机高分子杂化纳米杂化物,再用来制备载药微球的报道却很少。
1 仪器与试剂
1.1 仪器
UV-2450紫外分光光度计(日本岛津公司);Nano-ZS90马尔文激光粒度仪(英国马尔文公司);岛津IRTracer-100 红外分光光度计(日本岛津公司);DZF-6020型真空干燥器(上海博迅实业有限公司医疗设备厂);ZRS-8G智能溶出试验仪(天津天大天发科技有限公司);生物显微镜(日本尼康)。
1.2 试剂
硝酸锌(AR,上海研生实业有限公司);硝酸铝(AR,天津市巴斯长化工有限公司);阿司匹林(99.7%,北京亚希尔化工科技有限公司);壳聚糖(Cs,脱乙酰度90%,天津市北方天医化学试剂厂);Span80(AR, 天津市凯通化学试剂有限公司);石油醚(AR,天津市富宇精细化工有限公司);聚乙二醇(AR, 上海光明化工厂);戊二醛(w=0.25,AR,天津市科密欧化学试剂有限公司)。
2 方法
2.1 Cs-LDHs的复合材料的制备
将0.7000g Cs溶于35mL的醋酸溶液中,加入5.9500 g六水合硝酸锌和3.7503g九水合硝酸铝,制备成盐溶液。在通入氮气保护条件下,将52ml稀氨水(2%)碱液迅速加入到盐溶液中得到混合盐溶液。将混合液在40℃条件下搅拌3h,得到沉淀,将沉淀过滤洗涤后密封于烧杯中60℃条件下交融24h。24h后取出沉淀在100℃条件下真空干燥5h后,得到Cs-LDHs。
2.2 ASP-Cs-LDHs微球的制备
取0.0300g上述制备出的Cs-LDHs和0.3000g阿司匹林、2.5000g明胶,加入10ml蒸馏水在(50±0.5)℃的水浴中充分搅拌形成A液,作为水相。 在100ml液体石蜡中加入2ml span-80,充分搅拌形成B液,作为油相。将搅拌完全的A液缓慢滴入B液中,剧烈搅拌10min形成C液。将C液放入4℃的水浴中并滴加1ml戊二醛搅拌,固化1h。之后抽滤并分别用石油醚、乙醚洗涤数次。抽滤完成后在40℃条件下真空干燥。干燥完成后得到ASP-Cs-LDHs微球。
2.3 阿司匹林标准曲线的绘制
精密称取ASP标准品0.0040g放入200ml容量瓶中,并用95%乙醇稀释至刻度线并定容。配置好后,分别吸取10、20、30、40、50ml至100ml容量瓶中,用95%乙醇定容。这样就得到2、4、6、8、10μg/ml 5个梯度的ASP溶液。通过紫外分光光度计光谱扫描,得到其最大吸收波长约250nm。通过测量他们的吸光度A得到标准曲线(图1),ASP在2~10μg/ml存在良好的线性关系,回归方程为A=0.0044c+0.0457,R2=0.9992。
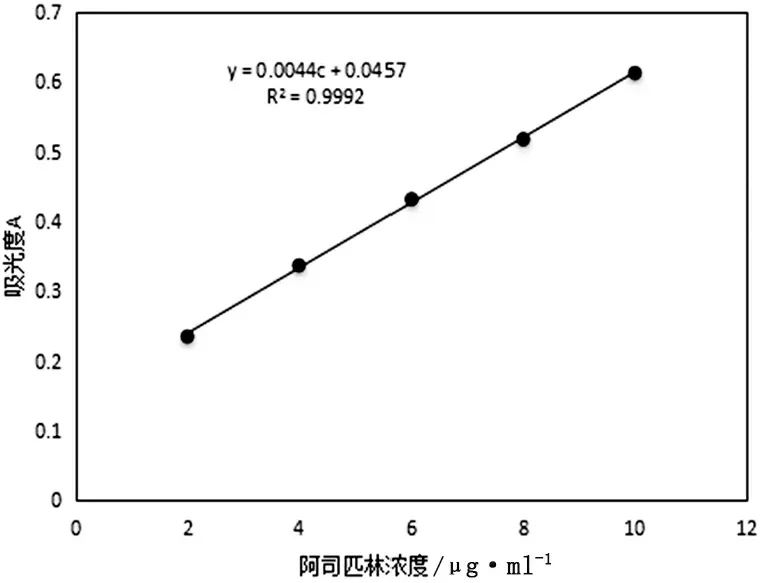
图1 ASP标准曲线图
2.4 ASP-Cs-LDHs微球包封率、载药量的计算
精确称取0.05 g载药微球置于烧瓶中,加入50ml 95%乙醇37℃条件下搅拌8h。过滤取10ml滤液于100ml容量瓶中,95%乙醇定容。测吸光度,计算其包封率(公式1)和载药量(公式2):
包封率=微球中药物质量/投入的总药量 (1)
载药量=微球中药物质量/称取的微球质量
(2)
2.5 ASP-Cs-LDHs微球的表征
红外表征 采用压片机溴化钾压片,利用岛津IRTracer-100红外分光光度计进行表征,分辨率0.5~1cm,波数范围7800~350cm-1。
微球平均粒径及电位测量 采用马尔文激光粒度仪(英国马尔文公司)、以乙醇为分散介质将产物分散后分别进行电位和粒径的测量。
电光显微镜 以最佳制备条件下所得载药微球在电光显微镜下观察其形态。
紫外可见分光光度计:采用UV-2450双光束紫外可见分光光度计,测其吸光度。
2.6 ASP-Cs-LDHs微球的体外释放实验
制备pH=1.2的盐酸溶液(模拟胃液)和pH=7.4的磷酸盐缓冲液(模拟肠液)。
称取25mg ASP-Cs-LDHs微球置于透析袋中,加入5ml预热的释放液分散盐酸缓释体系。密封后放入装有释放液的溶出杯中,每个溶出杯有释放液400ml。模拟体内温度37℃。分别于30、60、90、120、150、180、240、300、360、420、480min取样5ml,取样后同时补充5ml释放介质。测其吸光度,计算其累计释放量(公式3)
(3)
Er为阿司匹林的累计释放量,%;Ve为释放介质置换体积,%;V0为起始释放液体积,ml;ρi为第i次置换时,释放液中药物浓度, g.ml-1;n为置换释放介质的次数;mdrug为起始微球的质量,g;D为ASP-Cs-LDHs微球的载药量,%。
3 结果与讨论
3.1 影响阿司匹林包封率和载药量的因素
影响因素有阿司匹林含量、Cs-LDHs用量、戊二醛用量、明胶用量等,考察制备条件对载药微球结构和载药量的影响,探索载药微球制备最佳条件。
3.1.1阿司匹林含量的影响 固定Cs-LDHs 用量为0.030g,明胶用量为2.50g,戊二醛用量为1ml,改变阿司匹林的用量制备微球,并对其载药量和包封率进行测定, 绘制阿司匹林含量对微球载药量与包封率的影响曲线。见图2。
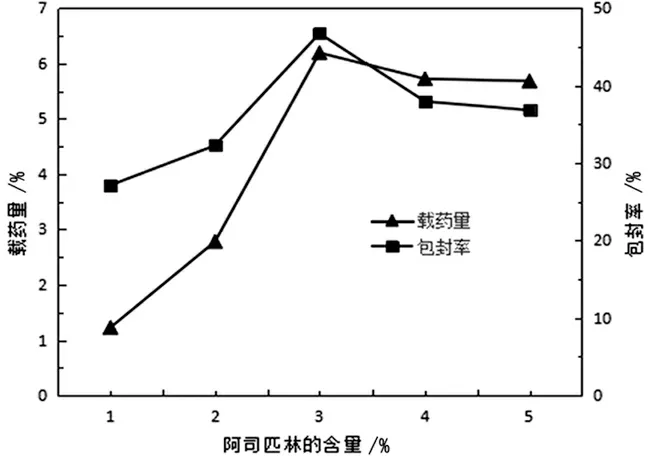
图2 阿司匹林用量对微球包封率与载药量影响曲线
由图2可以看出投入阿司匹林的百分比不同对微球的包封率和载药量有很大影响,还可以看出包封率和载药量随着药量所占百分比的增大而增大,但当药量在3%时到达最大值,之后曲线下降。说明3%的阿司匹林是制备微球最大的饱和药量。阿司匹林与高分子载体和物质之间达到最大结合程度,所以选择3%阿司匹林作为制备微球的最佳投入药量。
3.1.2Cs-LDHs投入量的影响 固定阿司匹林用量为3%,明胶用量为2.50g,戊二醛用量为1ml,改变Cs-LDHs的用量制备微球,并对其载药量和包封率进行测定, 绘制Cs-LDHs投入量对微球载药量与包封率的影响曲线。见图3。

图3 Cs-LDHs不同投入量对微球包封率和载药量影响曲线
由图3得出随着Cs-LDHs投入量的增多,微球包封率和载药量均呈上升趋势,但在投入量为0.03g时达到最大值。之后曲线呈下降趋势。故当Cs-LDHs投入量为0.03g是制备微球的最佳投入量。
3.1.3阿司匹林/明胶投入比的影响 固定阿司匹林用量为3%,Cs-LDHs 用量为0.030g,戊二醛用量为1ml,改变阿司匹林/明胶比例制备微球,并对其载药量和包封率进行测定, 绘制阿司匹林/明胶比例对微球载药量与包封率的影响曲线。见图4。
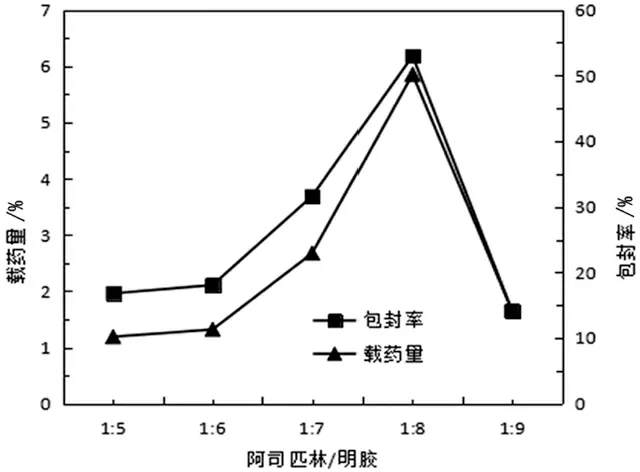
图4 阿司匹林/明胶对微球包封率和载药量的影响曲线
由图4得出阿司匹林与明胶的投入比对微球包封率和载药量有很大影响,尤其是对包封率影响非常明显。由此得出在阿司匹林与明胶比例1∶8的时候微球的包封率与载药量达到最高,说明此比例是药物与高分子物质的最佳比例。综合考虑选择1∶8的阿司匹林/明胶来制备微球。
3.1.4戊二醛用量的影响 固定阿司匹林用量为3%,Cs-LDHs 用量为0.030g,胶用量为2.50g,改变戊二醛用量制备微球,并对其载药量和包封率进行测定, 绘制戊二醛用量对微球载药量与包封率的影响曲线。见图5。

图5 戊二醛用量对微球包封率和载药量的影响曲线
由图5得出戊二醛的用量对微球包封率和载药量是有影响的,得出随着固化剂戊二醛用量的增加包封率和载药量是减少的,所以戊二醛最合适的用量应是0.5ml。
3.2 ASP-Cs-LDHs微球的表征
3.2.1微球的显微图 采用最优制备工艺制得的载药微球,利用生物显微镜(日本尼康)观察其形态。见图6。

图6 微球显微图片
由图6得出微球的成球性很好,大小均匀。
3.2.2微球的粒度分布 采用最优制备工艺制得的载药微球,利用马尔文激光粒度仪测定其平均粒径。见图7。

图7 微球粒径分布
微球的平均粒径:2793nm ,PDI多分散系数0.436, 粒径合乎要求。
3.2.3红外表征 图8为阿司匹林,Cs,LDHs和载药微球的红外光谱图。阿司匹林(8a )的在3300~2500cm处的特征吸收峰为-COOH特征宽吸收峰,在1740cm处的特征吸收峰为苯环酯羰基C=O的伸缩振动峰,在1189cm为C-O-C吸收峰,在1610、1574、14581cm处的特征吸收峰为苯环的振动峰。壳聚糖(图8b)在3420cm处是-OH的伸缩振动,而在1599 cm处为NH2的伸缩振动吸收峰。LDHs(图8c)在3500cm左右处的吸收峰是层间水的伸缩振动谱带,1369cm为碳酸根离子的伸缩振动,1621cm为层间水分子中O-H的变形振动。载药微球(图8d)中不仅含有1369cm为碳酸根离子的伸缩振动,还含1740cm处的苯环酯羰基的伸缩振动峰有壳聚糖的特征峰,而且有些基团吸收峰发生迁移。这是由于壳聚糖上的羟基和氨基,与LDHs片层上的-OH化学键合作用的缘故。
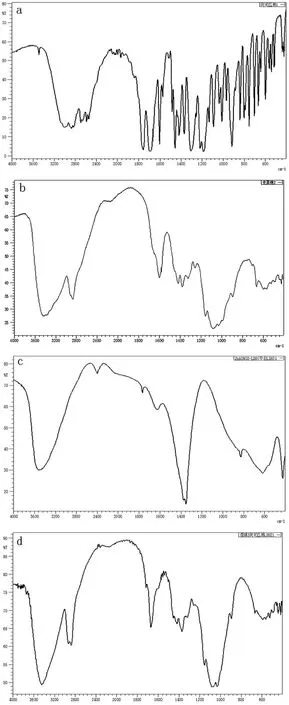
a:阿司匹林;b:壳聚糖;c:LDHS,d:载药微球
图8 红外红外光谱图
3.3 阿司匹林磁性微球的体外释放研究
由图9得出,在模拟胃液中,阿司匹林原料药在起初30min就释放了约30%,在240min几乎释放完全;而微球在240min的累计释放度仅为20%左右,在420min时累计释放度释放为24.37%,之后几乎保持恒定,最大的累计释放量为25.93%。由图10可知,在模拟肠液中,阿司匹林原料药在起初30min释放为37%左右,在150min中左右释放稳定;微球起初的1h内释放比较缓慢,到150min左右释放加快,在360min释放稳定,最大累计释放量为58.03%。由图11可知,微球在模拟肠液中的累计释放度明显大于在模拟胃液中的累计释放度。

图9 微球在模拟胃液中的释放曲线(pH=1.2的盐酸溶液)

图10 微球在模拟肠液中的释放曲线(pH=7.4磷酸盐缓冲液)

图11 微球在模拟肠液和模拟胃液中的释放曲线
4 结论
以Cs和Cs-LDHs为复合载体,通过优化合成条件,制备新型药物缓释微球Cs-LDHs-阿司匹林;在阿司匹林用量为3%、0.03g Cs-LDHs用量为0.03g、阿司匹林/明胶为1∶8 ,0.5ml戊二醛用量为0.5ml的条件下,所制得成球性好、粒径分布均匀,其平均粒径为2793nm;体外释放试验研究缓释微球微球的释放对pH值有一定的敏感性,在模拟肠液中缓释性更强。
[1] 张培培,唐忠锋.药物阿司匹林剂型的研究进展[J].中国现代应用药学,2009,26(7): 542-545.
[2] 陈有梅,刘博,周安宁,等.盐酸西替利嗪/蒙脱土纳米复合物的制备及其结构与性能[J].复合材料学报,2010,27(1): 43-50.
[3] Rinaudo M.Chitin and chitosan:properties and applications[J].Prog.Polym.Sci.2006.31(7):603-632.DOI:10.1016/j.progpolymsci.2006.06.001.
[4] Wang SF,Shen L,Tong YJ,et al.Biopolymer chitosan/montmorillonite nanocomposites:prepatation and chatacterization[J].Polym Degrad Stabil,2005,90(1):123-131.DOI:10.1016/j.polymdegradstab.2005.03.001.
[5] Mao C,Qiu Y,Sang H,et al.Various approaches to modify biomaterial surfaces for improving hemocompatibility[J].Adv Colloid Interface Sci,2004,110(1-2): 5-17.DOI:10.1016/j.cis.2004.02.001.
[6] Guo L,Liu G,Hong RY,et al.Preparation and characterization of chitosan poly(acrylic acid) magnetic microspheres[J].Mar Drugs,2010,8(7): 2212-2222.DOI:10.3390/md8072212.
[7] 顾梦洁,王欢,胡新,等.明胶微球制备方法的改进[J].实验室研究与探索,2015,34(4): 57-60.
[8] 全先高,王军,刘景,等.正交试验优化甲氨蝶呤-壳聚糖-蒙脱土缓释微球的制备工艺及其体外释放研究[J].济宁医学院学报,2016,39(4): 237-240,244.
[9] Zheng JP,Luan L,Wang HY,et al.Study on ibuprofen/montmorillonite intercalation composites as drug release system[J].Applied Clay Science,2007,36(4): 297-301.DOI:10.1016/j.clay.2007.01.012.
[10] Sun Y,Gu L,Gao Y,et al.Preparation and characterization of 5-Fluorouracil loaded chitosan microspheres by a two-step solidification method[J].Chem Pharm Bull,2010,58(7): 891-895.DOI:10.1248/cpb.58.891.
[11] Huang L,Sui W,Wang Y,et al.Preparation of chitosan/chondroitin sulfate complex microcapsules and application in controlled release of 5-fluorouracil[J].Carbohydrate Polymers,2010,80(1): 168-173.DOI:10.1016/j.carbpol.2009.11.007.
[12] Xu Z,Zhang J,Cong L,et al.Preparation and characterization of magnetic chitosan microsphere sorbent for separation and determination of environmental estrogens through SPE coupled with HPLC[J].J Sep Sci,2011,34(1): 46-52.DOI:10.1002/jssc.201000640.
[13] 俞怡晨,姚炎庆,张亚琼,等.壳聚糖-海藻酸盐纳米粒子的制备及其对BSA的载药与释放特性[J].功能高分子学报,2005(4): 598-601.
[14] 全先高,王慧云,丁林,等.甲氨蝶呤/蒙脱土纳米插层化合物的制备及缓释作用研究[J].济宁医学院学报,2014,37(4): 251-255,259.

