PEDV、TGEV和PoRV三重PCR检测方法的建立及初步应用
蒲翠敏,冯旭芳,张双翔,胡兴义,张 海,丁尊俄,王开功*,周碧君,文 明,程振涛
(1.贵州大学动物科学学院,贵州贵阳 550025;2.贵州省德江县动物疫病预防控制中心,贵州德江 565200;3.贵州省动物疫病预防控制中心,贵州贵阳 550001)
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由冠状病毒科冠状病毒属的猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起仔猪和育肥猪以呕吐、腹泻、脱水为特征的一种急性、接触性肠道传染病。 PED于1971首次发现于英国,其病原体PEDV于1977年首次在比利时发生急性腹泻的猪群中分离到,并命名为CV777株[1]。我国于1973年首次发现该病[2]。2010年10月以来,仔猪急性感染性腹泻广泛流行,发病率、病死率高,给养猪业造成了严重的经济损失[3-4]。猪传染性胃肠炎(Porcine transmissible gastroenteritis,TGE)是由猪传染性胃肠炎病毒(Porcine transmissible gastroenteritis virus,TGEV)引起猪的一种高度接触性肠道传染病,以2周龄以内仔猪呕吐、严重腹泻、失水和高病死率为主要特征,属于世界动物卫生组织(OIE)规定必须上报的猪传染病[5]。我国从20世纪50年代末就有该病的报道,近几年来在我国仍时有发生和流行,给养猪业造成了极大的损失[6]。猪轮状病毒病是一种人畜共患病,是由猪轮状病毒(Porcine rotavirus,PoRV)引起1日龄~5日龄或断奶仔猪的一种以厌食、呕吐、腹泻和脱水,以及机体酸碱平衡紊乱、死亡为特征的接触性传染病。1982年,我国学者从腹泻猪粪便中分离到PoRV,证实了PoRV在我国各规模化养猪场普遍存在[7]。由于猪流行性腹泻病毒、猪传染性胃肠炎病毒、猪轮状病毒引起的猪病毒性腹泻,在临床症状与病理变化上很难鉴别区分,必需通过实验室方法确诊,所以需要建立一种能够同时检测这3种病毒且敏感、特异的方法,能够快速且大批量的对临床样本进行检测。目前,国内外针对PEDV、TGEV和PoRV已有单项和多重RT-PCR[8-10]、单项和多重荧光定量PCR[11-13]等病原学快速检测方法的报道。本研究结合当前国内外流行毒株的遗传变异新特点,针对3种病毒基因的保守区域,设计特异性引物,建立了能同时检测并区分PEDV、TGEV和PoRV的三重PCR检测方法,对临床快速鉴别检测及流行病学调查具有重要意义。
1 材料与方法
1.1 材料
1.1.1 试验毒株 PEDV-TGEV-PoRV三联疫苗(含猪传染性胃肠炎病毒弱毒株、猪流行性腹泻病毒CV777弱毒株和猪轮状病毒NX株,山东沈氏动保集团,批号:201605),贵州省瑞特农牧发展有限公司产品;猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪伪狂犬病病毒(PRV)、猪细小病毒(PPV)和猪圆环病2型(PCV2)阳性样本,北京世纪元亨动物防疫有限公司产品。
1.1.2 主要试剂 RNA及DNA提取试剂盒,北京世纪元亨动物防疫有限公司产品;PrimeScriptTMRT Master Mix,TaKaRa公司产品;PCR扩增试剂及分子克隆试剂,宝生物工程(大连)有限公司产品;E.Z.N.A.TM Gel Extraction Kit 胶回收试剂盒、E.Z.N.A.TM Plasmid Kit质粒提取试剂盒,Omega公司产品;Bst DNA聚合酶,NEG生物技术有限公司产品。
1.2 方法
1.2.1 引物设计与合成 分别根据PEDV S基因、TGEV M基因及PoRV VP7基因保守序列各设计一对特异性引物(PEDV-P1/PEDV-P2、TGEV-P1/TGEV-P2及PoRV-P1/PoRV-P2),并送上海英俊生物有限公司合成,引物序列见表1。

表1 多重PT-PCR特异性引物
1.2.2 质粒标准品的制备 取PEDV-TGEV-PoRV三联疫苗株毒液,按照RNA提取试剂盒说明书提取总RNA,利用一步RT-PCR法扩增目的基因,将RT-PCR产物纯化回收连接pMD19-T载体,转化,构建pMD19-T-PEDVS、pMD19-T-TGEVM、pMD19-T-PoRVVP7共3种重组质粒,并通过PCR测序鉴定。
1.2.3 PEDV、TGEV和PoRV单项PCR反应条件优化 以已构建的3种重组质粒为模板,取2×TaqDNA master mix 12.5 μL,Primer 1(10 μmol/L) 0.5 μL,Primer 2(10 μmol/L)0.5 μL,模板2.0 μL,ddH2O补至25 μL,建立25 μL反应体系,进行PCR扩增。设置退火温度梯度(51、53、55、57、59℃)、引物浓度梯度(0.2、0.3、0.4、0.5 μmol/L)进行PCR扩增,确定最佳退火温度、引物浓度,优化反应条件。
1.2.4 PEDV与TGEV双重PCR反应条件优化 根据PEDV及TGEV单项PCR条件优化结果,建立25 μL PEDV及TGEV双重PCR反应体系,体系为:2×TaqDNA master mix 12.5 μL,PEDV Primer Mix(10 μmol/L) 2.0 μL,TGEV Primer Mix(10 μmol/L) 1.5 μL,质粒模板各1.0 μL,ddH2O补至25 μL。对退火温度(51、53、55、57、59℃)、pMD19-T-PEDVS/pMD19-T-TGEVM模板比例(1 μL/1 μL、1 μL/1.5 μL、1.5 μL/1 μL、2 μL/1 μL、1 μL/2 μL)、PEDV/TGEV引物浓度(0.2 μmol/L∶0.6 μmol/L、0.3 μmol/L∶0.5 μmol/L、0.4 μmol/L∶0.4 μmol/L、0.5 μmol/L∶0.3 μmol/L、0.6 μmol/L∶0.2 μmol/L、0.7 μmol/L∶0.2 μmol/L )设定梯度,优化PCR扩增条件。
1.2.5 PEDV、TGEV和PoRV三重PCR反应条件优化 根据PEDV、TGEV和PoRV单项PCR条件优化结果,建立PEDV、TGEV和PoRV三重PCR反应体系:2×TaqDNA master mix 12.5 μL,PEDV Primer Mix(10 μmol/L) 2.0 μL,TGEV Primer Mix(10 μmol/L) 1.5 μL,PoRV Primer Mix(10 μmol/L) 2.0 μL,质粒模板各1.0 μL,ddH2O补至25 μL。将退火温度设置5个梯度(51、53、55、57、59℃)优化退火温度,在最佳退火温度及PEDV与TGEV双重PCR已优化条件的情况下,设定5个pMD19-T-PoRVVP7添加量梯度(0.5、0.75、1、1.25、1.5 μL),PoRV引物浓度梯度(0.15、0.2、0.25、0.3 μmol/L)进行三重PCR扩增反应条件优化。
1.2.6 三重PCR特异性及敏感性试验 利用已经建立并优化好的三重PCR对单一模板、三联模板、PCV2、CSFV、PRRSV进行检测,评价其特异性。将3种重组质粒的拷贝数调整为1×1010拷贝/μL,进行10倍倍比稀释,分别以1×104、1×103、1×102、1×101、1×100拷贝/μL稀释液为模板进行三重PCR扩增反应,评价其敏感性。
1.2.7 三重PCR临床应用 利用已建立的PEDV、TGEV和PoRV三重PCR对102份临床病料进行检测,并与单项PCR检测结果对比分析。
2 结果
2.1 单项PCR条件优化
以pMD19-T-PEDVS、pMD19-T-TGEVM、pMD19-T-PoRVVP7三种重组质粒为模板,对退火温度及引物浓度进行优化。结果显示,PEDV在5个不同温度下均能扩增出条带,TGEV在55℃时条带最为清晰,PoRV在51℃及53℃条带较清晰(图1);PEDV、TGEV和PoRV的引物浓度分别为0.5、0.4、0.4 μmol/L时,条带清晰,且无非特异性扩增(图2)。

M.DNA 标准DL 2 000;1~5.51、53、55、57、59℃
M.DNA Marker DL 2 000;1-5.51,53,55,57,59℃
图1 PEDV、TGEV和PoRV单项PCR退火温度优化
Fig.1 The amplification of single PCR under different anneal temperature for PEDV,TGEV and PoRV,respectively
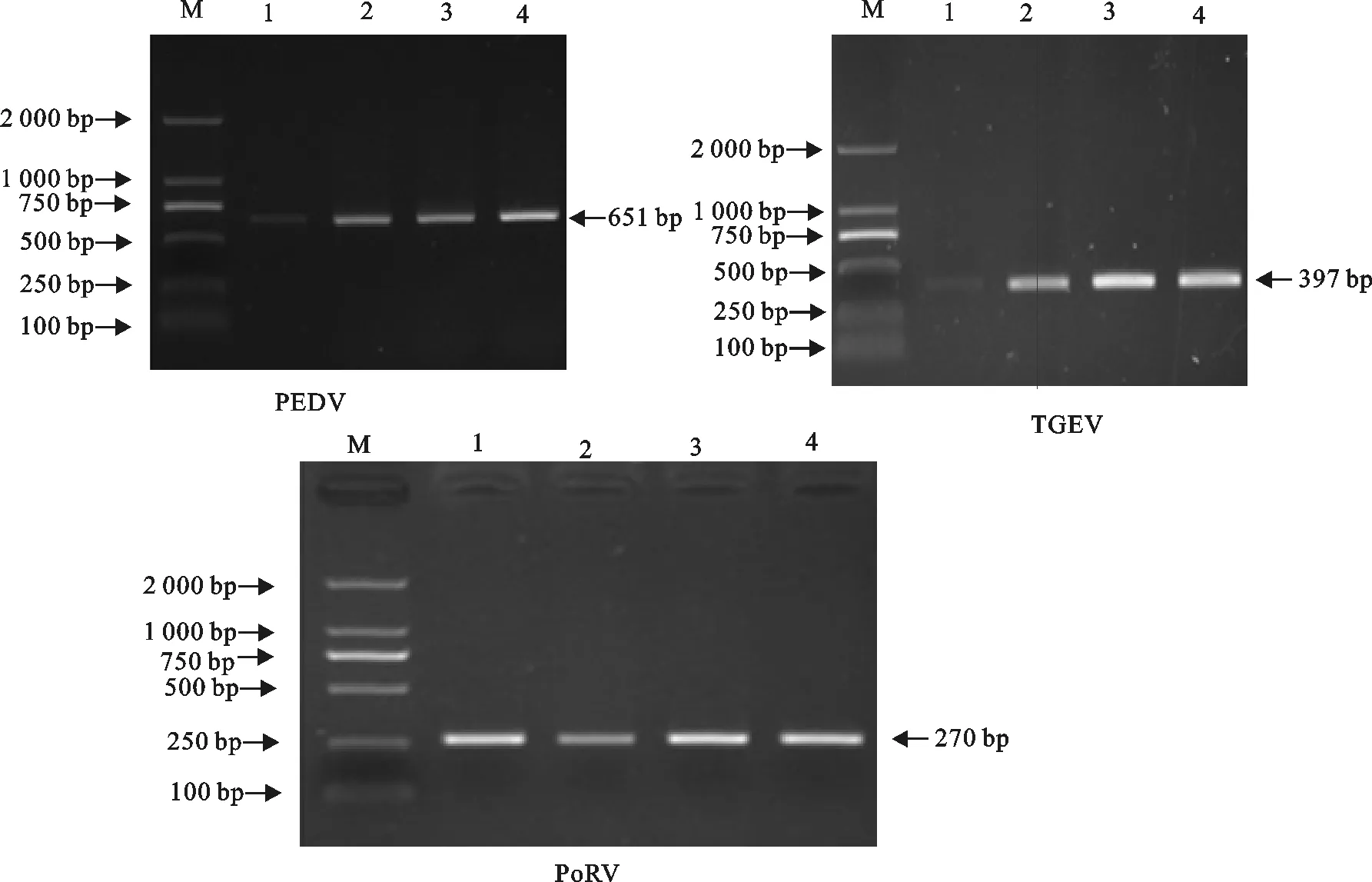
M.DNA 标准DL 2 000;1~4.0.2、0.3、0.4、0.5 μmol/L
M.DNA Marker DL 2 000;1~4.0.2,0.3,0.4,0.5 μmol/L
图2 PEDV、TGEV和PoRV单项PCR引物浓度优化
Fig.2 The optimization of primer concentrations of single PCR for PEDV,TGEV and PoRV,respectively
2.2 PEDV与TGEV双重PCR条件优化
建立25 μL双重PCR反应体系,在单项PCR优化条件的基础上,对退火温度、模板比例和引物浓度进行优化。结果表明,最佳退火温度为51℃、TGEV和PoRV的最佳模板量分别为2 μL和1 μL、PEDV与TGEV的最佳引物浓度为0.5 μmol/L∶0.3 μmol/L(图3~图5)。

M.DNA 标准DL 2 000;1~5.51、53、55、57、59℃
M.DNA Marker DL 2 000;1-5.51,53,55,57,59℃
图3双重PCR退火温度优化
Fig.3 The amplification of duplex PCR under different anneal temperatures
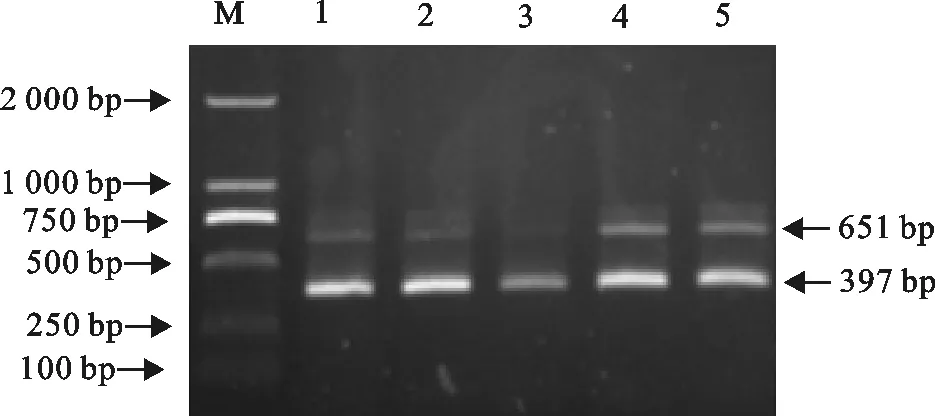
M.DNA 标准DL 2 000;1~5.1∶1、1∶1.5、1.5∶1、2∶1、1∶2
M.DNA Marker DL 2 000;1-5.1∶1,1∶1.5,1.5∶1,2∶1,1∶2
图4双重PCR反应模板比例的确定
Fig.4 The determination of template proportions for duplex PCR

M.DNA 标准DL 2 000;1~6.0.2∶0.6、0.3∶0.5、0.4∶0.4、0.5∶0.3、0.6∶0.2、0.7∶0.2
M.DNA Marker DL 2 000;1-6.0.2∶0.6,0.3∶0.5,0.4∶0.4,0.5∶0.3,0.6∶0.2,0.7∶0.2
图5不同引物浓度下的双重PCR反应
Fig.5 The results of duplex PCR under different primer concentrations
2.3 PEDV、TGEV和PoRV三重PCR的条件优化
根据优化好的双重PCR条件,对三重PCR的退火温度、PoRV模板量、PoRV引物浓度优化。结果在退火温度51℃、PoRV的模板量1.5 μL、PoRV引物浓度为0.3 μmol/L时PCR反应条件最佳(图6~图8),所以最终确定三重PCR反应体系为:2×TaqDNA master mix 12.5 μL,PEDV Primer Mix(10 μmol/L) 2.5 μL,TGEV Primer Mix(10 μmol/L)1.5 μL,PoRV Primer Mix(10 μmol/L) 1.5 μL,PEDV模板2 μL,TGEV模板1 μL,PoRV模板1.5 μL,ddH2O补至25 μL。PCR循环参数为:95℃ 3 min;94℃ 30 s,51℃ 30 s,72℃ 45 s,循环35次;最后72℃ 10 min。
2.4 三重PCR特异性分析
利用已经建好的三重PCR方法对单项模板、三联模板、PCV2、CSFV、PRRSV进行检测。结果显示,PEDV、TGEV和PoRV单项和混合模板的三重PCR检测呈阳性,而PCV2、CSFV及PRRSV的三重PCR呈阴性(图9)。

M.DNA 标准DL 2 000;1~5.51、53、55、57、59℃
M.DNA Marker DL 2 000;1-5.51,53,55,57,59℃
图6三重PCR退火温度优化
Fig.6 The amplification of triplex PCR under different anneal temperatures

M.DNA 标准DL 2 000;1~5.pMD19-T-PoRVVP7分别为0.5、0.75、1、1.25、1.5 μL
M.DNA Marker DL 2 000;1-5.pMD19-T-PoRVVP7 amounts were 0.5,0.75,1,1.25,1.5 μL
图7三重PCR反应中PoRV模板量的确定
Fig.7 Determination of PoRV template dosages in triplex PCR
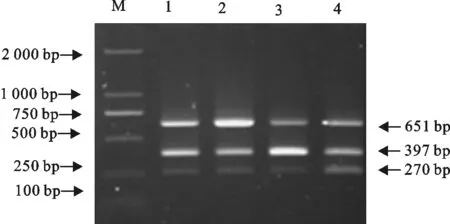
M.DNA 标准DL 2 000;1~4.PoRV引物浓度分别为0.15、0.2、0.25、0.3 μmol/L
M.DNA Marker DL 2 000;1-4.PoRV primer concentrations were 0.15,0.2,0.25,0.3 μmol/L
图8三重PCR引物浓度优化
Fig.8 The optimization of primer concentrations for triplex PCR

M.DNA 标准DL 2 000;1.PEDV/TGEV/ PoRV;2.PoRV;3.TGEV;4.PEDV;5.CSFV;6.PCV2;7.PRRSV
M.DNA Marker DL 2 000;1.PEDV/TGEV/ PoRV;2.PoRV;3.TGEV;4.PEDV;5.CSFV;6.PCV2;7.PRRSV
图9三重PCR特异性试验
Fig.9 The spicificity test of the triplex PCR
2.5 三重PCR敏感性分析
分别取1×104、1×103、1×102、1×101、1×100拷贝/μL稀释液进行三重PCR扩增,根据模板的最低检测量评价其敏感性。结果显示,PEDV、TGEV和PoRV质粒模板的最低检测量分别为1×102、1×100、1×103拷贝/μL(图10)。

M.DNA 标准DL 2 000;1~5.1×104、1×103、1×102、1×101、1×100拷贝/μL
M.DNA Marker DL 2 000;1~5.1×104,1×103,1×102,1×101,1×100copies/μL
图10三重PCR敏感性试验
Fig.10 The sensitivity test of the triplex PCR
2.6 PEDV、TGEV和PoRV三重PCR临床应用
应用建立的三重PCR方法对102份临床病料进行PEDV、TGEV和PoRV检测,并与单项PCR结果进行对比分析,结果见表2。

表2 临床病料中PEDV、TGEV和PoRV检测结果
3 讨论
随着我国养猪行业规模的不断扩大,猪的病毒性腹泻给养猪业造成了严重的危害和巨大的经济损失。引起猪病毒性腹泻最主要的病原就是猪传染性胃肠炎病毒、猪流行性腹泻病毒和猪轮状病毒这3种病毒,它们可以对各个年龄阶段的猪造成危害,但以仔猪最为严重,病死率高,即使猪耐过存活,康复猪也生长缓慢,致使饲料报酬降低[14]。这3种病毒感染引起的临床症状和病理变化非常相似,且常存在混合感染。杜季梅[15]对河南省58个不同规模猪场181份发病仔猪的病料进检测,PEDV与TGEV、PoRV混合感染率分别为2.76%、2.21%,3种病毒混合感染率为0.55%;毛黎红等[16]对贵州省9个规模化养猪场腹泻粪便样品进行检测,1个猪场存在PEDV与TGEV混合感染;2个猪场存在PEDV与PoRV混合感染,给猪病毒性腹泻的临床诊断带来了一定的困难。因此,建立一种能够同时检测这3种病毒且快速、敏感、特异的方法,对于猪病毒性腹泻的确诊及防控工作有着非常重要意义。
PCR作为分子生物学技术中最常用的检测技术,它能针对不同的组织样本进行检测,具有重复性好、特异性强、灵敏度高,检出时间短等特点。因此,PCR技术已成为病原鉴别诊断的首选方法。多重PCR是在单项PCR的基础上加以改进建立的,不仅能够同时扩增出多个目的基因,而且效率高、省时、节约成本。在多重PCR的建立过程中,合理的引物设计尤为重要,本研究使用的引物是分别针对PEDV S基因、TGEV M基因及PoRV VP7基因这些高度保守性的序列所设计的3对特异性的引物,且扩增目的片段大小有合适的梯度,便于电泳时观察区分。
本研究在对三重PCR的反应条件进行优化时,先对检测3种病毒的各自单项PCR的退火温度、引物浓度等条件进行优化,确定检测3种病毒单项PCR反应的公共条件;再根据单项PCR的公共反应条件对检测PEDV和TGEV的双重PCR反应条件进行优化;最后根据双重PCR反应条件对三重PCR反应条件进行优化,最终建立了三重PCR检测方法,并进行了特异性、敏感性试验。结果显示,所建立的3重PCR检测方法特异性高,与PCV2、CSFV、PRRSV无交叉反应;敏感性强,PEDV、TGEV和PoRV质粒模板的最低检测量分别为1×102copies/μL、1×100opies/μL、1×103copies/μL,与龙飞翔等[17]所建立的多重PCR检测方法进行比较,增加了单项PCR与双重PCR反应条件的优化,并对3种病毒的模板添加比例进行了优化,而与曹玉琴[18]所建立的方法比较,增加了病毒模板添加比例条件的优化,所以本研究PEDV、TGEV和PoRV最低检测量与龙飞翔PEDV、TGEV、PoRV 重组质粒最低检出量1.41×103copies/μL、1.41×102copies/μL、1.41×103copies/μL和曹玉琴的PEDV、TGEV、PoRV 阳性RNA模板最低检出量1.5×105copies/μL相比都低,灵敏度更高。同时,本研究所建立的3重PCR检测方法与PCV2、CSFV、PRRSV均无交叉反应,特异性高。对临床送检的102份病料进行PEDV、TGEV和PoRV检测,结果三重PCR与单项PCR的检出符合率为100%。总之,本研究所建立的PEDV、TGEV和PoRV三重PCR检测方法快速、特异、敏感,可应用于临床病原的检测与流行病学的调查研究。
[1] Pensaert M B,de Bouck P.A new coronavirus like particle associated with diarrhea in swine[J].Arch Virol,1978,58(3):243-247.
[2] Jungle K,Saif L J.Porcine epidemic diarrhea virus infection:Etiology,epidemiology,pathogenesis and immunoprophylaxis[J].Vet J,2015,204(2):134-143.
[3] Pan Y,Tian X,Li W,et al.Isolation and characterization of a variant porcine epidemic diarrhea virus in China[J].Virol J,2012,9:195.
[4] 孙贤刚,唐蕊涵,蔡雨函,等.2011—2012年四川省猪流行性腹泻病毒的h遗传变异分析[J].中国兽医学报,2015,35(1):16-21.
[5] Leman A D,Straw B E,Mengeling W L.Diseases of Swine[M].London:Wolfe Publishing.Iowa State University Press,1992:362-386.
[6] 何孔旺,林继煌,还红华,等.侯继波.猪传染性胃肠炎病毒弱毒株 STC3 细胞培养特性及致病性研究[J].中国兽医科技,2001,31(8):8-9.
[7] 何孔旺,何家惠.我国动物轮状病毒研究概况[J].江苏农业科学,1994(4):61-63.
[8] 路 超,张 莉,王丽莉,等.猪传染性胃肠炎病毒和猪流行性腹泻病毒二重 PCR检测方法的建立[J].中国畜牧兽医,2015,42(6):1377-1382.
[9] Song D S,Kang B K,Oh J S,et al.Multiplex reverse transcription-PCR for rapid differential detection of porcine epidemic diarrhea virus,transmissible gastro enteritis virus,and porcine group A rotavirus[J].J Vet Diagn Invest,2006,18(3):278-281.
[10] 曹玉琴,付 丹,杨 尧,等.PEDV-TGEV-RV多重RT-PCR鉴别检测方法的建立及应用[J].中国兽医科学,2015,45(9):881-887.
[11] Miller L C,Crawford K K,Lager K M,et al.Evaluation of two real-time polymerase chain reaction assays for porcine epidemic diarrhea virus (PEDV) to assess PEDV transmission in growing pigs[J].J Vet Diagn Invest,2016,28(1):20-29.
[12] Kim S H,Kim I J,Pvo H M,et al.Multiplex real-time RT-PCR for the simultaneous detection and quantification of transmissible gastroenteritis virus and porcine epidemic diarrhea virus[J].J Virol Methods,2007,146(1-2):172-177.
[13] 陈小金.PEDV,TGEV,PoRV SYBR Green I 实时荧光PCR诊断方法的探索[D].北京: 中国农业科学院,2010.
[14] 杨丽梅,马 力,徐倩倩,等.我国猪病毒性腹泻的诊断与流行病学调查研究概况[J].动物医学进展,2004,35(2):115-119.
[15] 杜季梅.仔猪病毒性腹泻流行病学调查及卵黄抗体在PEDV防治中的应用[D].河南郑州:河南农业大学,2013.
[16] 毛黎红,王开功,周碧君,等.贵州省仔猪腹泻4种病原感染情况的调查研究[J].动物医学进展,2015,36(5):121-124.
[17] 龙飞翔,施开创,张 珍,等.PEDV、TGEV和PRoV多重RT-PCR检测方法的建立及应用[J].中国畜牧兽医,2016,43(10):2518-2526.
[18] 曹玉琴,付 丹,杨 尧,等.PEDV-TGEV-RV多重RT-PCR鉴别检测方法的建立及应用[J].中国兽医科学,2015,45(09):881-887.

