褐藻岩藻多糖生物活性研究进展
,,, ,,,钰金
(1. 浙江工业大学 药学院,浙江 杭州 310014;2. 浙江工业大学 长三角绿色制药协同创新中心, 浙江 杭州 310014;3. 山东省海洋食品营养研究院,山东 威海 264200)
全球有超过70%的表面积由海洋占据着,海洋环境是功能性原料的来源[1],包括多不饱和脂肪酸(PUFA)、多糖、矿物质、维生素、抗氧化剂、酶和生物活性肽[2].在海洋生物中,海洋藻类作为一种新的生物活性物质来源越来越受到广泛关注[3].海藻分红藻、褐藻和绿藻三大类,褐藻(Phaeophyta)是海洋藻类中的第二大种群,因其含有绿棕色的藻褐素而得名[4].褐藻(Phaeophyta)分为25 个属,大约有1 500 种[3],是生长在海洋中的低等植物,而褐藻(Phaeophyta)如墨角藻(Fucus)、海带(Laminariajaponica)和羊栖菜(Hizikiafusifarme)等被广泛作为食品来食用.同时,海藻提取物在功能膳食以及保健品开发上受到了全世界人们的极大关注[5-6].
褐藻多糖硫酸酯(FCSPs),又名岩藻多糖(Fucoidan),是Kylin[7]1913年首次从掌状海带中提取的,并命名为Fucoidan,是一类含有L-岩藻糖和硫酸基团,并伴有其他单糖(如半乳糖、甘露糖、木糖、葡萄糖醛酸和阿拉伯糖)的水溶性杂多糖[8].岩藻多糖性质为淡黄色,也存在于一些海洋无脊椎动物中.目前,海洋天然药物的使用已经在世界范围内得到认可和支持,在现代科学指导下,海洋天然药物在治疗特殊疾病方面已经有所成效.岩藻多糖作为一种天然糖聚合物,具有双向调和免疫力、消除胃肠系统紊乱和抗过敏功能,在食品应用方面已经得到人们的肯定.岩藻多糖还具有肌肤再生,皮肤保湿等超过20 项以上的生理功效.褐藻岩藻多糖一般采用水提法[9]或酸提法[10]进行提取.现今,在传统提取方法的基础上发展出了一些新的提取方法,如微波[11]、超声[12]带动细胞内水分子振动,破碎细胞辅助水法提取;酶[13]提取法是利用酶溶解细胞壁,使细胞内容物流出来,提高提取效率.研究表明:从褐藻分离得到的岩藻多糖具有广泛的生物活性[14],包括抗凝血、抗病毒、抗氧化和抗炎等活性[15-16].近10 年来,褐藻岩藻多糖受到了人们极大的关注.笔者就褐藻岩藻多糖的结构及生物活性进行综述.
1 褐藻岩藻多糖结构
随着褐藻种类的不同,岩藻多糖的结构和组成也不同.墨角藻(Fucus)和泡叶藻(Ascophyllumnodosum)来源的岩藻多糖主要含有α(1→3)和α(1→4)硫酸岩藻聚糖,而海带(Laminariajaponica)来源的则主要是α(1→3)硫酸岩藻聚糖.几种常见典型的褐藻岩藻多糖[17]结构式为Usov等[18]从海带Laminariajaponica提取出岩藻多糖,Chizhov等[19]从褐藻Chordafilum中提取岩藻多糖,利用红外、核磁图谱进行结构解析,通过对比发现:这2 种岩藻多糖结构主要是由岩藻糖通过α-(1-3)糖苷键链接,但硫酸基团的位置不同,Usov等提取出的岩藻多糖结构的硫酸基团主要在C -4上,小部分在C -2上,Chizhov等提取出的岩藻多糖结构的硫酸基团主要在O -4位上,有一部分在O -2位置上.
不同的提取方法,对同种褐藻中的岩藻多糖的化
学组成和结构组成也会产生一定的影响.Lu等[20]用水提取、柠檬酸提取2 种方法,从海带Laminariajaponica中提取岩藻多糖,水提取岩藻多糖(LJPW)由岩藻糖、半乳糖、木糖和甘露糖组成,单糖比例分别为63.44%,20.65%,10.31%,5.60%.而用柠檬酸提取岩藻多糖,单糖组成为半乳糖(36.96%),岩藻糖(20.27%),甘露糖(12.81%),木糖(12.43%),葡萄糖(10.29%),还伴有少量鼠李糖(4.51%).
2 褐藻岩藻多糖生物活性
褐藻岩藻多糖具有多种生物活性,包括抗凝血、抗氧化、抗肿瘤和抗病毒等.近年来,对褐藻岩藻多糖的研究已成为天然海洋药物的研究热点.
2.1 抗氧化活性
人体内产生的活性氧(ROS)会攻击大分子化合物如脂质、蛋白质和DNA,从而导致癌症、糖尿病和炎症等疾病,抗氧化剂可以保护人体免受活性氧的损伤[21].褐藻岩藻多糖具有良好的抗氧化活性,通过自由基清除及还原力实现抗氧化作用,是良好的天然抗氧化剂.Wang等[22]从海带Laminariajaponica中提取的岩藻多糖(DFPS)经Tris-HCl分离得到的DF1,DF2,DF3等对超氧阴离子清除活性均高于丁基羟基茴香醚(BHA)、丁化羟基甲苯(BHT).DFPS,DF1,DF2,DF3等对超氧阴离子清除活性的EC50分别为9.5,12.6,13.8,9.9 μg/mL;BHA,BHT对超氧阴离子清除活性的EC50分别为31.6,88 μg/mL.
分子量会影响褐藻岩藻多糖的抗氧化活性.Hou等[23]降解岩藻多糖得到不同分子量的片段(1.0,3.8,13.2,35.5,64.3,144.5 kDa).利用超氧阴离子清除率评价抗氧化活性,在质量浓度为0.02 mg/mL时,这7种不同分子量的岩藻多糖清除率分别为50%,65%,80%,82%,84%,77%,70%.同时,羟基自由基清除活性测定,清除率在90%时,3.8,13.2,35.5,64.3 kDa所需质量浓度分别为1.78,2.67,3.56,4.44,0.89 mg/mL.
提取方法也会影响褐藻岩藻多糖的抗氧化活性.Imbs等[24]使用热酸法和无水CaCl2法2 种方法从Fucusevanescens中提取岩藻多糖,热酸法提取的岩藻多糖(FCSP-1)和无水CaCl2法提取的岩藻多糖(FCSP-2),硫酸根的质量分数分别为9.0%,40.3%,岩藻糖的质量分数分别为59.4%,90.0%.使用DPPH自由基清除率评价抗氧化活性,在质量浓度为1.0 mg/mL时,FCSP-1,FCSP-2的DPPH自由基清除率分别为(57.6±3.0)%,(19.4±0.5)%.因此,提取方法不同,导致岩藻多糖化学组成不同,从而会对其抗氧化活性产生影响.而Jing等[25]对从海带Laminariajaponica中得到的岩藻多糖进行硫酸化、乙酰化以及苯甲酰化,并用羟基自由基清除率评价其抗氧化活性,结果表明这3 种岩藻多糖的EC50分别为2.58,2.14,0.51 mg/mL.所以,多糖片段上取代基也会对岩藻多糖的抗氧化活性产生影响.
2.2 抗肿瘤活性
岩藻多糖抗肿瘤活性的作用机理可能是激活巨噬细胞[26],被激活的巨噬细胞释放一些响应信号分子(IL-2,IFN-γ,IL-12),这些信号分子可以激活自然杀伤细胞(NK),从而诱导癌细胞凋亡(图1).
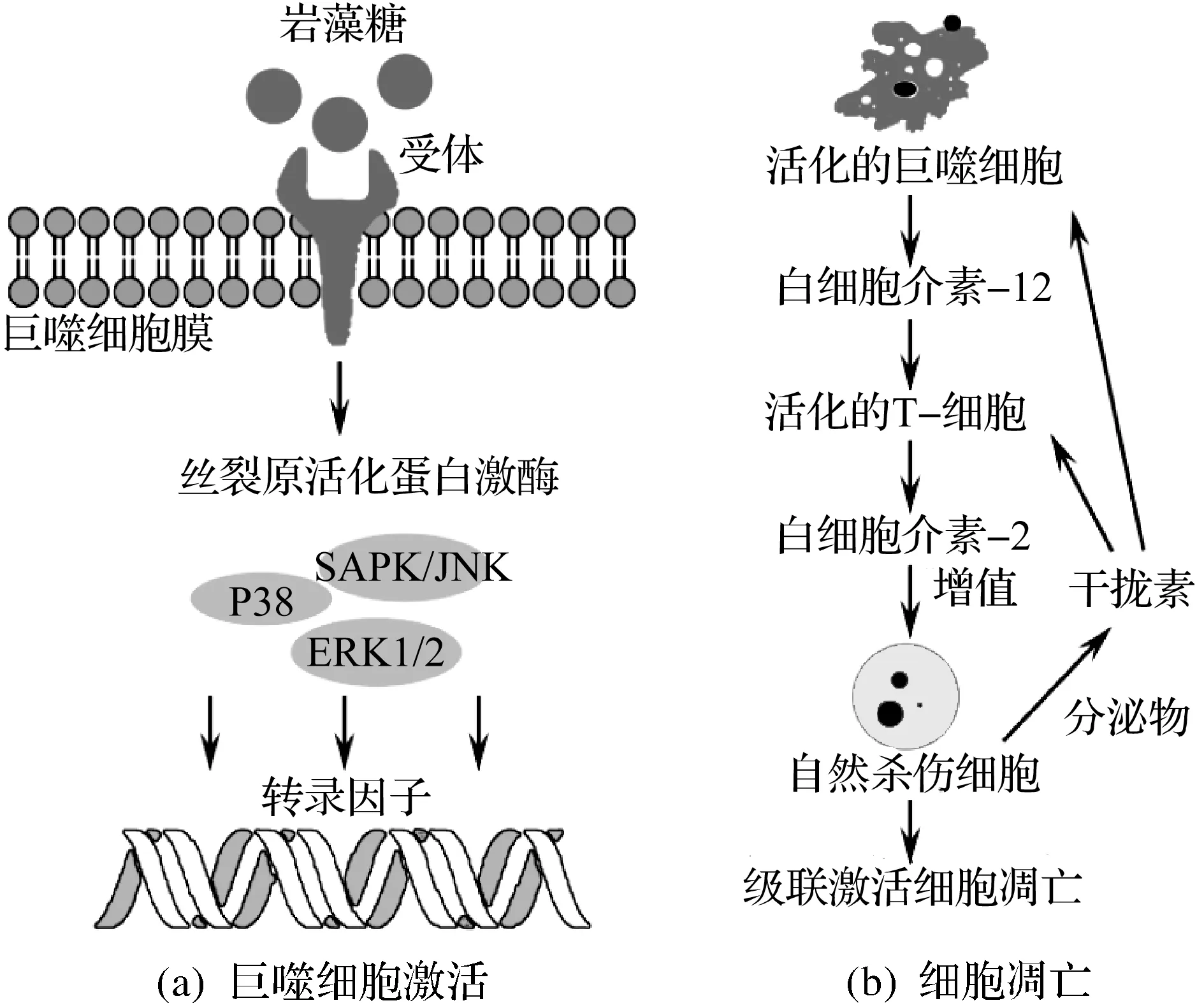
图1 岩藻多糖抗肿瘤活性机制Fig.1 Proposed mechanism responsible for fucoidan bioactivity
在体内研究中,Alekseyenko等[27]研究了岩藻多糖对患有肺腺癌小鼠的肿瘤抑制情况,喂养小鼠岩藻多糖的剂量为10 mg/kg,结果可以有效控制肿瘤转移,有一定的抗肿瘤活性.
岩藻多糖对不同肿瘤细胞的抑制率是有差异的.Ermakova等[28]从3 种褐藻Sargassumhorneri,Ecloniacava,Costaria中获得的岩藻多糖,通过离子交换柱分别获得ShF1,ShF2,ShF3 3 个馏分;EcF1和EcF2 2 个馏分;CcF 1 个馏分.在质量浓度为100 μg/mL时,对人结肠腺癌细胞(DLD-1)的抑制率分别为ShF1(56%),ShF2(68%),ShF3(69%),EcF1(50%),EcF2(64%),CcF(45%);对人皮肤恶性黑色素瘤细胞(SK-MEL-28)的抑制率分别为ShF1(85%),ShF2(68%),ShF3(68%),EcF1(70%),EcF2(91%),CcF(80%).
岩藻多糖也可以通过化学修饰来增强抗肿瘤作用.Soeda等[29]将岩藻多糖(NF硫酸基团质量分数为31.2%)过度硫酸化,使硫酸化岩藻多糖(OSF)硫酸基团质量分数为52.4%,研究发现:在质量浓度为100 μg/mL时,NF和OSF对内皮细胞的抑制作用分别为27%和60%,而OSF可以有效抑制内皮细胞血管的形成,比NF的影响效果明显.因此岩藻多糖过度硫酸化可以有效抑制血管生成,从而抑制肿瘤细胞.
人体内过度的自由氧会导致癌症疾病的发生,褐藻岩藻多糖具有明显的抗氧化活性,体外活性研究中岩藻多糖对肿瘤细胞也具有杀伤作用.因此在肿瘤治疗方面,褐藻岩藻多糖作为辅助药物在进行癌症的治疗中具有很大的潜力.
2.3 抗病毒活性
Gerber等[30]首次发现:从Gelidiumcartilagenium中获得的岩藻多糖,具有抵抗流感病毒的作用.褐藻岩藻多糖是带有硫酸基团的酸性多糖,Huheihel等[31]研究发现:岩藻多糖抗病毒活性与硫酸基团的质量分数有关,质量分数越高,抗病毒活性越强.而分子量[32]、化学组成以及岩藻多糖的构象和化学结构[33]对岩藻多糖的抗病毒活性起着决定性作用.Buck等[34]研究硫酸化岩藻多糖和少量非硫酸化岩藻多糖的抗人乳头瘤病毒(HPV)的活性.通过HPV16体外假病毒感染模型,对岩藻多糖进行抗HPV评价.研究发现:硫酸化岩藻多糖的半数抑制质量浓度IC50为1.1 μg/mL,少量非硫酸化岩藻多糖的半数抑制质量浓度IC50为18 μg/mL.结果表明:褐藻岩藻多糖中的硫酸根在抗HPV活性中起着重要作用.Jiao等[35]从Ascophyllumnodosum中提取的4种多糖组分AN1,AN2,AN3,AN4,硫酸根质量分数分别为12.41%,10.81%,5.30%,5.02%.对这4个组分进行抗甲型H1N1活性评价.AN1,AN2,AN3,AN4对甲型H1N1的抑制率分别为(69.3±7.5)%,(67.1±5.6)%,(55.2±5.0)%,(52.7±7.8)%.结果表明:多糖组分中随着硫酸根质量分数的增加抗甲型H1N1的活性也随着增强.
在体内用药这一块,Hayashi等[36]从裙带菜Undariapinnatifida中提取岩藻多糖,通过口服给药HSV-Ⅰ 感染引起的BALB/c小鼠,与对照组比较,口服岩藻多糖可以有效地预防HSV-Ⅰ 感染引起的BALB/c小鼠死亡.而Lee等[37]对从裙带菜Undariapinnatifida中提取的岩藻多糖(n(岩藻糖)︰n(半乳糖)为1.0︰1.1)进行体外活性研究,该岩藻多糖具有良好的抗HSV-Ⅰ和HSV-Ⅱ 病毒活性.褐藻岩藻多糖抗单纯疱疹病毒HSV活性研究见表1.
表1褐藻岩藻多糖抗单纯疱疹病毒HSV活性研究
Table1Anti-Herpessimplexvirus(HSV)activityoffucoidanfromPhaeophyceae

主要单糖来源病毒株IC50/(μg·mL-1)文献来源岩藻糖SargassumhorneriHSV⁃110[38]岩藻糖SargassumpatensHSV⁃115[39]岩藻糖UndariapinnatifidaHSV⁃205[40]
Béress等[41]报道,褐藻岩藻多糖可以在不损伤阴道上皮细胞和正常菌群的前提下,作为抗病毒药物来使用.经济成本低、安全性高,表明褐藻岩藻多糖作为抗病毒药物是很有潜力的.
2.4 抗凝血活性
抗凝血剂是用于防治血管内栓塞或血栓形成的药物,近几十年来,肝素一直作为临床抗凝血药物[42],然而在使用过程中肝素会引发血小板减少、过度出血[43]等,因此对于寻找安全天然的抗凝血药物,一直是人们研究的热点.
Jing等[44]体外研究岩藻多糖(FPS)的抗凝血活性.根据活化部分凝血活酶时间(APTT)、凝血酶时间(TT)和凝血酶原时间(PT)评价抗凝血活性效果.岩藻多糖(FPS)在质量浓度为7.0 μg/mL时,APPT为(44.70±0.53) s,PT为(9.48±0.59) s,肝素质量浓度为1.5 μg/mL时,APTT为(38.74±1.10) s,PT为(10.93±0.54) s,空白组APPT为(23.25±0.43) s,PT为(9.01±0.32) s,因此研究结果表明岩藻多糖与肝素的抗凝血活性相近.
分子量对抗凝血活性有一定的影响.施志仪等[45]研究指出岩藻多糖由于分子量大,不易被吸收,在抗凝血效果上比肝素弱.Grauffel等[46]发现:岩藻多糖(50 kDa)可以有效阻止人血浆和牛纤维蛋白原溶液中血栓的形成,纯化分离得到四种低分子的岩藻多糖组分(B-Ⅰ,B-Ⅱ,C-Ⅰ,C-Ⅱ),研究表明:C-Ⅰ,C-Ⅱ 的抗凝血活性比较高,C-Ⅰ的抗凝血活性相当于肝素的80%,C-Ⅱ 的抗凝血活性相当于肝素的85%.褐藻来源的岩藻多糖抗凝血活性研究的一些文献见表2.
表2褐藻来源的岩藻多糖抗凝血活性研究的一些文献
Table2SomeanticoagulantsulfatedpolysaccharidesfromPhaeophyceae

主要单糖来源文献来源岩藻糖Eckloniacava[47]岩藻糖Eckloniakurome[48]岩藻糖Laminariajaponica[49]岩藻糖Ascophyllumnodosum[50]岩藻糖Lessoniavadosa[51]
由于岩藻多糖对于引起出血的风险比肝素小得多[52],对血小板和白细胞的数量也不会有影响,可以作为预防血栓药物在临床上使用.
2.5 其他生物活性
除了上述活性,褐藻岩藻多糖还具有促进骨骼发育、抗疲劳、抗辐射和保护胃黏膜等作用.
Young-Sook等[53]从褐藻Undariapinnatifida中提取的岩藻多糖在早期成骨细胞分化时,可以作为表型标记增强碱性磷酸酶的活性和提高骨钙素的分泌量.此外研究还表明:岩藻多糖对骨形态发生蛋白-2(BMP-2)有积极作用,从而对骨的形成,矿化都有良好的作用.
刘芳等[54]研究表明:给予受试小鼠不同剂量的岩藻多糖(10,20,50,100 mg/(kg·d-1)),连续灌胃10 d,并在密闭缺氧的条件下进行抗疲劳实验.研究结果表明:被灌胃岩藻多糖的受试小鼠其负重游泳时间和在常压缺氧下存活时间都显著延长,以50 mg/(kg·d-1)剂量组的小鼠耐受能力最强.实验证明:岩藻多糖可以增强小鼠抗疲劳能力,增强小鼠耐缺氧能力.
吴晓旻等[55]从Laminariajaponica中提取岩藻多糖进行抗辐射研究,将Wistar大鼠随机分为正常对照组、模型组和实验组(给予岩藻多糖),连续灌胃10 d进行一次性γ射线辐射,9.0 Gy/只,18 h后测定各组大鼠体液免疫、细胞免疫、非特异性免疫相关指标及脾淋巴细胞凋亡率.结果表明:正常对照组的免疫指标高于模型组,岩藻多糖组对受到辐射损伤大鼠的免疫功能有显著调节,并且其脾淋巴细胞凋亡率低于模型组,并呈明显的量效关系.
Nagaoka等[56]从褐藻Cladosiphonokamuranus中提取岩藻多糖,研究表明:岩藻多糖可以抑制胃酸和胃蛋白酶,从而具有保护胃黏膜的作用.
3 结 论
近十几年来,在传统提取岩藻多糖方法的基础上,出现了一些新的提取方法:简化提取工艺,提高提取效率,降低提取过程中对岩藻多糖结构、组成以及生物活性的影响.但目前还需进一步精简提取工艺程序,提高褐藻岩藻多糖得率.在纯化多糖方面,探究新的分离纯化方法,为研究岩藻多糖活性提供一定的便利.
研究发现:褐藻岩藻多糖具有抗氧化、抗肿瘤、抗凝血和降血脂等活性.影响褐藻岩藻多糖活性的因素有很多,如提取方法、硫酸基团质量分数、结构组成以及分子量大小等.地域、收获季节也会影响褐藻岩藻多糖的结构组成,从而对活性造成影响.小分子岩藻多糖容易吸收,因此低分子量的岩藻多糖生物活性相对较高,不同的降解方法导致岩藻多糖化学组成不同,会引起生物活性有所差异.在提取分离中,硫酸基团质量分数高的岩藻多糖,其活性也较高.由于天然褐藻岩藻多糖的结构复杂,但岩藻多糖的结构并没有完全阐释清楚,所以目前还不能确定岩藻多糖的化学结构与生物活性之间的关系.
褐藻岩藻多糖具有很多生物活性,但岩藻多糖结构组成和活性的作用机理还没有阐释清楚,对两者之间的关系还需做进一步的研究.今后需继续探索新的提取方法,研究岩藻多糖与药理活性部位之间的关系,同时还需要探究褐藻岩藻多糖稳定的存在形式,为药品、保健品及功能性食品开发奠定基础.
[1] 殷建军,岳建行,倪晓波,等.海底水体耗氧过程原位培养装置的研制[J].浙江工业大学学报,2016,44(6):689-694.
[2] KIM S K, WIJESEKARA I. Development and biological activities of marine-derived bioactive peptides: a review[J]. Journal of functional foods, 2010, 2(1):1-9.
[3] DAVIS T A, VOLESKY B, MUCCI A. A review of the biochemistry of heavy metal biosorption by brown algae[J]. Water research, 2003, 37(18):4311-4330.
[4] MESTECHKINA NM,SHCHERBUKHIN V D. Sulfated polysaccharides and their anticoagulant activity∶a review[J]. Applied biochemistry and microbiology, 2010, 46(3):267-273.
[5] BARTOLOMEUWS S, MIGUELA C, ANAI B, et al. Chemical characterization and antioxidant activity of sulfated polysaccharide from the red seaweedGracilariabirdiae[J]. Food hydrocolloids, 2012, 27(2):287-292.
[6] 钱海丰,陈思,金瑜剑.藻类在除草剂生物毒性安全评估中的应用[J].浙江工业大学学报,2017,45(1):32-36.
[7] KYLIN H. Biochemistry of sea algae[J].Cell physiol biochem, 1913, 83(3):171-197.
[8] HOAGLAND D R, LIEB L L. The complex carbo hydrates and forms of sulphurin marinealgae of the pacificcoast[J]. Journal of biological chemistry, 1915, 23(8):287-297.
[9] RODRIGUEZ-JASSO, ROSA M, MUSSATTO, et al. Extraction of sulfated polysaccharides by autohydrolysis of brown;seaweedFucusvesiculosus[J]. Journal of applied phycology, 2013, 25(1):31-39.
[10] LIOYDLL, KENNEDY J F. Food polysaccharides and their applications[J]. Carbohydrate polymers,1996, 30(4):297-298.
[11] ESKILSSON C S, BJÖRKLUND E. Analytical-scale microwave-assisted extraction[J]. Journal of chromatography A, 2000, 902(1):227-250.
[12] EBRINGEROVA, HROMDKOVZ. An overview on the application of ultrasound in extraction, separation and purification of plant polysaccharides[J]. Central European journal of chemistry, 2010, 8(2):243-257.
[13] JEON Y, WIJESINGHE W A. Enzyme-assistedextraction of bioactive components: a useful approach for recovery of industrially important metabolites from seaweeds: a review[J]. Fitoterapia, 2012, 83(1):6.
[14] 吕莉,孙慧君,韩国柱.中药药代动力学的研究进展[J].药学学报,2013,48(6):824-833.
[15] ALE M T, MIKKELSEN J D, MEYER A S. Important determinants for fucoidan bioactivity: a critical review of structure-function relations and extraction methods for fucose-containing sulfated polysaccharides from brown seaweeds[J]. Marine drugs, 2011, 9(10):2106-2130.
[16] CUI Y Q, LUO D Z, WANG X M. Fucoidan∶advances in the study of it’s anti-inflammatory and anti-oxidative effects[J]. Acta pharmaceutica sinica, 2008, 43(12):1186-1189.
[17] MF D J R, DE MORAIS A M, DE MORAIS R M. Marine polysaccharides from algae with potential biomedical applications[J]. Marine drugs, 2015, 13(5):2967-3028.
[18] USOV A I, SMIRNOVA G P, BILAN M I, et al. Polysaccharides of algae 53 brown algaLaminariasaccharina(L.) lam as a source of fucoidan[J]. Russian journal of bioorganic chemistry, 1998, 24(3):437-445.
[19] CHIZHOV A O, DELL A, MORRIS H R, et al. A study of fucoidan from the brown seaweedChordafilum[J]. Carbohydrate research, 1999, 320(1/2):108-119.
[20] LU J, YOU L, LIN Z, et al. The antioxidant capacity of polysaccharide fromLaminariajaponica, by citric acid extraction[J]. International journal of food science & technology, 2013, 48(7):1352-1358.
[21] WANG C C, SU J Y, CAI J Y, et al. Response surface analysis for the optimization of extraction condition for polysaccharides fromEpimediumpolysaccharidesand studies on itstumor immune activities[J]. Acta pharmaceutica sinica, 2016, 51(9): 1464-1471.
[22] WANG J, ZHANG Q, ZHANG Z, et al. Potential antioxidant and anticoagulant capacity of low molecular weight fucoidan fractions extracted fromLaminariajaponica[J]. International journal of biological macromolecules, 2010, 46(1):6-12.
[23] HOU Y, WANG J, JIN W, et al. Degradation ofLaminariajaponica, fucoidan by hydrogen peroxide and antioxidant activities of the degradation products of different molecular weights[J]. Carbohydrate polymers, 2012, 87(1):153-159.
[24] IMBS T I, SKRIPTSOVA A V, ZVYAGINTSEVA T N. Antioxidant activity of fucose-containing sulfated polysaccharides obtained fromFucusevanescens, by different extraction methods[J]. Journal of applied phycology, 2015, 27(1):545-553.
[25] JING W. Synthesized oversulphated, acetylated and benzoylated derivatives of fucoidan extracted fromLaminariajaponicaand their potential antioxidant activityinvitro[J]. Food chemistry, 2009, 114(4):1285-1290.
[26] ALE M T, MIKKELSEN J D, MEYER A S. Important determinants for fucoidan bioactivity: a critical review of structure-function relations and extraction methods for fucose-containing sulfated polysaccharides from brown seaweeds[J]. Marine drugs, 2011, 9(10):2106-2130.
[27] ALEKSEYENKO T V, ZHANAYEVA S Y, VENEDIKTOVA A A, et al. Antitumor and antimetastatic activity of fucoidan, a sulfated polysaccharide isolated from the Okhotsk seaFucusevanescensbrown alga[J]. Bulletin of experimental biology and medicine, 2007, 143(6):730-732.
[28] ERMAKOVA S, SOKOLOVA R, KIM S M, et al. Fucoidans from brown seaweedsSargassumhornery,Ecloniacava,Costariacostata: structural characteristics and anticancer activity[J]. Applied biochemistry and biotechnology, 2011, 164(6):841-850.
[29] SOEDA S, SHIBATA Y, SHIMENO H. Inhibitory effect of oversulfated fucoidan on tube formation by human vascular endothelial cells[J]. Biological & pharmaceutical bulletin, 1997, 20(11):1131-1135.
[30] GERBER P. Protective effect of seaweed extracts for chicken embryos infected with influenza b or mumps virus[J]. Experimental biology and medicine, 1958, 99(3):590-593.
[31] HUHEIHEL M, ISHANU V, TAL J, et al. Activity ofPorphyridiumsp. polysaccharide against herpes simplex virusesinvitroandinvivo[J]. Journal of biochemical & biophysical methods, 2002, 50(2/3):189-200.
[32] DAMONTE E B, MATULEWICZ M C, CEREZO A S. Sulfated seaweed polysaccharides as antiviral agents[J]. Current medicinal chemistry, 2004, 11(18):2399-2419.
[33] LÜSCHERMATTLI M. Polyanions-a lost chance in the fight against HIV and other virus diseases?[J]. Antiviral chemistry & chemotherapy, 2000, 11(4):249-259.
[34] BUCK C B, THOMPSON C D, ROBERTS J N, et al. Carrageenanis a potent inhibitor of papillomavirus infection[J]. Plos pathogens, 2006, 2(7):69.
[35] JIAO G, YU G, WANG W, et al. Properties of polysaccharides in several seaweeds from Atlantic Canada and their potential anti-influenza viral activities[J]. Journal of ocean university of China, 2012, 11(2):205-212.
[36] HAYASHI K, KAMIYA M, HAYASHI T. Virucidal effects of the steam distillate fromHouttuyniacordataand its components on HSV-1, influenza virus, and HIV[J]. Planta medica, 1995, 61(03):237-241.
[37] LEE J B, HAYASHI K, HASHIMOTO M, et al. Novel antiviral fucoidan from sporophyll ofUndariapinnatifida(Mekabu)[J]. Chemical & pharmaceutical bulletin, 2004, 52(9):1091-1094.
[38] HOSHINO T, HAYASHI T, HAYASHI K, et al. An antivirally active sulfated polysaccharide fromSargassumhorneri(TURNER) C. AGARDH[J]. Biological & pharmaceutical bulletin, 1998, 21(7):730-734.
[39] ZHU W, CHIU L C, OOI V E, et al. Antiviral property and mechanisms of a sulphated polysaccharide from the brown algaSargassumpatensagainst Herpes simplex virus type 1[J]. Phytomedicine, 2006, 13(9/10):695-701.
[40] THOMPSON K D, DRAGAR C. Antiviral activity ofUndariapinnatifidaagainst herpes simplex virus[J]. Phytotherapy research, 2004, 18(7):551-555.
[41] BÉRESS A, WASSERMANN O, BRUHN T, et al. A new procedure for the isolation of anti-hiv compounds (polysaccharides and polyphenols) from the marine algaFucusvesiculosus[J]. Journal of natural products, 1993, 56(4):478-488.
[42] FAN L, JIANG L, XU Y, et al. Synthesis and anticoagulant activity of sodium alginate sulfates[J]. Carbohydrate polymers, 2011, 83(4):1797-1803.
[43] 王玉春,齐占明,刘振中,等.仙人掌多糖对大鼠动脉粥样硬化的治疗作用及其机制[J].药学学报,2015,50(4):453-458.
[44] JING W, ZHANG Q, ZHANG Z, et al.In-vitroanticoagulant activity of fucoidan derivatives from brown seaweedLaminariajaponica[J]. Chinese journal of oceanology and limnology, 2011, 29(3):679-685.
[45] 施志仪,郭亚贞.海带褐藻糖胶的药理活性[J].上海水产大学学报,2000,9(3):268-271.
[46] GRAUFFEL V, KLOAREG B, MABEAU S, et al. New natural polysaccharides with potent antithrombic activity: fucans from brown algae[J]. Biomaterials, 1989, 10(6):363-368.
[47] ATHUKORALA Y, JUNG W K, VASANTHAN T, et al. An anticoagulative polysaccharide from an enzymatic hy
drolysate ofEckloniacava[J]. Carbohydrate polymers, 2006, 66(2):184-191.
[48] NISHINO T, AIZU Y, NAGUMO T. The influence of sulfate content and molecular weight of a fucan sulfate from the brown seaweedEckloniakuromeon its antithrombin activity[J]. Thrombosis research, 1991, 64(6):723-731.
[49] WANG J, ZHANG Q, ZHANG Z, et al. Potential antioxidant and anticoagulant capacity of low molecular weight fucoidan fractions extracted fromLaminariajaponica[J]. International journal of biological macromolecules, 2010, 46(1):6-12.
[50] NARDELLA A, CHAUBET F, BOISSON-VIDAL C, et al. Anticoagulant low molecular weight fucans produced by radical process and ion exchange chromatography of high molecular weight fucans extracted from the brown seaweedAscophyllumnodosum[J]. Carbohydrate research, 1996, 289(1):201-208.
[51] CHANDIA N, MATSUHIRO B. Characterization of a fucoidan fromLessoniavadosa(Phaeophyta) and its anticoagulant and elicitor properties[J]. International journal of biological macromolecules, 2008, 42(3):235-240.
[52] MELO F R, PEREIRA M S, FOGUEL D, et al. Antithrombin-mediated anticoagulant activity of sulfated polysaccharides: different mechanisms for heparin and sulfated galactans[J]. Journal of biological chemistry, 2004, 279(20):20824-20835.
[53] YOUNG-SOOK C, WONKYO J, JUNGAE K, et al. Beneficial effects of fucoidan on osteoblastic MG-63 cell differentiation[J]. Food chemistry, 2009, 116(4):990-994.
[54] 刘芳,李卓能,阎俊,等.海带多糖对小鼠动脉血气影响及抗疲劳作用[J].中国老年学杂志,2004,24(6):540-541.
[55] 吴晓旻,杨明亮,黄晓兰,等.海带多糖的抗辐射作用脾细胞凋亡[J].武汉大学学报(医学版),2004,25(3):239-241.
[56] NAGAOKA M, SHIBATA H, KIMURA-TAKAGI I,et al. Anti-ulcer effects and biological activities of polysaccharides from marine algae[J].Biofactors, 2000, 12(1/2/3/4):267-274.

