化学模型在水溶液平衡备考的初步应用
杨少锋
(广州市第六十六中学,广东 广州)
一、问题提出
水溶液中存在多种平衡,包括H2O的电离平衡、弱电解质电离平衡、盐类离子水解平衡,笔者把它们统称为水溶液平衡。水溶液平衡在历年高考中既是重点又是难点,是全体师生既爱又恨的考点之一。爱是因为它年年考,考点稳定,备考相对稳定,老师都有着丰富的备考经验。恨是因为考查的方式、题型多变、可考查的物质多变,不容易得分,考生普遍反映难!
教育部在新课程改革中提出了化学学科核心素养之一“证据推理与模型认知”。如何把这个核心素养的培养落实在日常教学环节中?笔者结合化学教学内容特点,在日常教学中不断摸索、实践,把核心素养的培养形成探究性教学,笔者以高考中常见考点水溶液平衡为教学案例做一浅析。
二、设计思路
笔者按化学模型开发、建立、拓展运用的过程,构建了水溶液平衡模型,尝试解决水溶液中高考常见的两种问题,即判断离子浓度大小与溶液离子等式对错,进一步发挥化学模型在水溶液平衡备考中的作用。
笔者提倡用具体的案例代替抽象的理论说明推导,本文分别以 0.1mol·L-1NH4Cl溶液与 0.1mol·L-1Na2CO3溶液为例,演示了模型的初步建立到模型拓展。NH4Cl溶液存在一个单一的离子水解平衡,把它作为水溶液平衡的雏形,更适合学生的学习心理,有信心通过模型来认知水溶液的各种平衡。再以Na2CO3溶液为例,从再到可以让学生清晰地感受到水溶液平衡的拓展。水溶液平衡模型旨在帮助学生形成水溶液各种平衡建立的过程,理解各种微粒的来源及改变情况。水溶液平衡是化学平衡中的一种,所以化学平衡移动原理同样适用于水溶液平衡,再结合溶液电中性原理,建立各种常见的等式,可以帮助学生掌握这类知识点的考查。笔者的化学模型就是建立在这样的具体案例上,让学生更好地理解并初步掌握模型认知的学习能力。
三、教学过程
1.开门见山,直接展示水溶液平衡模型。
[模型引入] 以0.1mol·L-1NH4Cl水溶液为例,建立水溶液平衡的化学模型。如下所示。
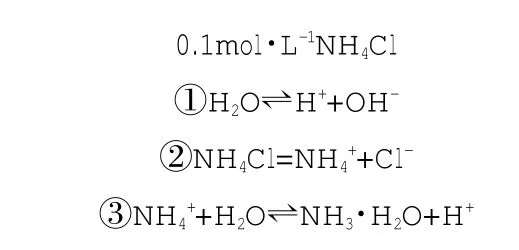
水溶液平衡模型
[师生互动] 我们进行模型拆解、说明。
(1)先写所有水溶液中一定存在平衡,也就是①式水电离平衡。
①H2O⇌H++OH-
(2)再写出溶质的电离,即②式。
(3)最后考虑,溶质电离出的离子能否建立新的平衡,即③式。
设计意图:模型以简单的NH4Cl溶液为例,展示了模型的建立过程,让学生直观、容易接受、可模仿。降低了学生对模型认知的畏惧心理,增强了学生的学习信心。
2.探究活动一:水溶液中离子浓度大小比较
模型认知是一个循序渐进的过程,模型越是简单,背后所隐藏的、可拓展的信息也就越丰富。
[引出问题] 建立水溶液平衡后,水溶液中各种微粒浓度大小如何比较呢?
[方法展示] 建立水溶液平衡,寻找离子的来源,可以轻松完成离子浓度大小比较。仍然以0.1mol·L-1NH4Cl为例,比较溶液中各种离子浓度大小。
首先建立水溶液平衡。
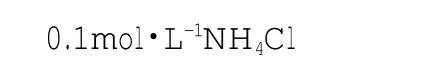
①H2O⇌H++OH-
②
[模型拓展1] ②式中,配上具体浓度的数据更直观。
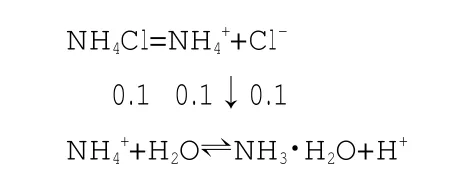
离子减少示意图
通过水溶液平衡的建立,我们可以直观看到各种离子的来源。如H+的来源,即①③式。
所以我们可以轻松地得出c(H+)>c(OH-),c(H+)>c(NH3·H2O)。
设计意图:展示模型的拓展,学生可以清晰地认识知识的延伸,模型丰富性,让学生可以树立掌握更多知识的信心。
[学生交流]
下面请看2012年广东高考真题:对于常温下pH为2的盐酸,表述正确的是 ( )
A.c(H+)=c(Cl-)+c(OH-)
B.与等体积pH=12的氨水混合后所得溶液显酸性
C.由 H2O 电离出的 c(H+)=1.0×10-12mol·L-1
D.与等体积0.01mol·L-1乙酸钠溶液混合后所得溶液中:c(Cl-)=c(CH3COO-)
[教师点拨] B选项,混合后所得溶液其实为,NH4Cl与氨水的混合溶液且氨水过量。建立水溶液平衡如下①H2O⇌H++OH-,③从离子的来源可以得出,c(OH-)>c(H+)即显碱性,故 B 错。
D选项,pH=2的盐酸浓度0.01mol·L-1,与乙酸钠混合后所得溶液其实为,乙酸与NaCl的混合溶液。建立水溶液平衡H2O⇌H++OH-CH3COOH⇌H++CH3COO-,c(Cl-)>c(CH3COO-),故 D错。
[模型拓展2] 以0.1mol·L-1Na2CO3溶液为例,比较溶液中各种离子浓度大小。根据先写出水的平衡、溶质电离、离子水解新平衡,可以得出以下水溶液平衡。
0.1mol·L-1Na2CO3水溶液平衡
(1)H2O⇌H++OH-
配上离子大小数据,

再看其他离子来源,我们可以轻松得出它们的大小比较。
①H2O⇌H++OH-
c(OH-)>c再复杂一点的,c(OH-)
[设计意图] 选用Na2CO3溶液为拓展,是因为②式产生的会继续建立新的平衡,即③式,学生会直接完成的两步水解过程,比较难理解的实际水解过程。这样处理也体现了模型拓展循序渐进的特点。
3.探究活动二:水溶液平衡的两种守恒
[师生互动](1)电荷守恒,根据溶液呈电中性的原理。即溶液中所有阳离子的正电荷之和等于所有阴离子的负电荷之和。如在0.1mol·L-1NH4Cl溶液中,根据水溶液平衡,阳离子有 Na+、H+,阴离子有 Cl-、OH-。它们建立的等式为+c(H+)=c(Cl-)+c(OH-)。又如在0.1mol·L-1Na2CO3溶液中,根据水溶液平衡,阳离子有Na+、H+,阴离子有它们建立的等式为:c(Na+)+c(H+)
(2)物料守恒,即原子守恒关系。如在0.1mol·L-1NH4Cl溶液中,根据水溶液平衡得知在离子建立新的平衡前=c(Cl-)=0.1mol·L-1。所以我们建立 c(N)=0.1mol·L-1,由于所以我们得出:
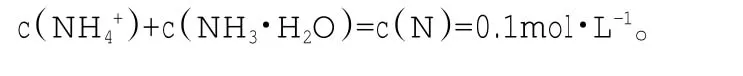
[学生交流](2013安徽高考)已知NaHSO3溶液显酸性,溶液中存在以下平衡:

向0.1mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是 ( )
A.加入少量金属 Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大
B.加入少量 Na2SO3固体,则 c(H+)+c(Na+)=c(HSO3-)+c(OH-)
C.加入少量NaOH溶液,的值均增大
[教师点拨] B选项。虽然加入了Na2SO3,但根据电中性原理,可以轻松建立等式:则所以B选项明显错误。
四、实践感悟
水溶液中存在各种平衡,一直以来都是高考命题者喜欢的热点,而水溶液平衡本身也是化学平衡的主要组成部分。命题人可以在考查的物质上做变动,还可以在数据表征上做改变,甚至结合最近喜欢用的图像坐标来增加难度,不管怎么变,其考查的本质是不会改变的。水溶液平衡模型的开发与应用,恰恰抓住了这一本质,可以帮助考生牢牢掌握这类题型的考查,在高考中从容答题拿分。
“模型认知与证据推理”化学核心素养之一,结合化学基础知识与学生认知角度,建立水溶液平衡模型,可以帮助学生更直观、清晰地学习相关化学知识,可以帮助学生更好地掌握模型认知的学习能力。

