pMHC多聚体技术研究进展①
董 帅 郑红俊 钟 时
(广州市香雪制药股份有限公司,广州 510530)
主要组织相容性复合物(Major histocom-patibility complex,MHC)能将抗原短肽递呈到细胞表面并被位于T细胞表面的T细胞受体(T cell receptor,TCR)识别,这种识别对于细胞内的病原体和癌症控制以及刺激和保持有效的细胞毒性应答起着至关重要的作用,在自身免疫疾病的发展中也可能发挥重要功能。抗原肽结合的MHC分子(peptide MHC,pMHC)与TCR之间相互作用机制的探究对于理解疾病的发展和建立新的治疗策略具有重要意义[1]。但早期研究发现,单体的pMHC复合物与TCR的相互作用较弱,解离速率快,不能形成稳定的相互作用[2],因此不能用于T细胞检测。1996年,Altman等[3]首次报道了pMHC的四聚化为pMHC与TCR的相互作用提供了足够的稳定性并用于抗原特异性T细胞的流式细胞检测和分析。随着癌症免疫治疗的发展,越来越依赖于低亲和的pMHC/TCR相互作用的检测,对pMHC的多聚体又提出了新的要求。本文综述了目前已报道的主要pMHC多聚体技术在抗原特异性T细胞检测和分离方面的研究进展。
1 pMHC单体的结构
MHC 主要包含Ⅰ类和Ⅱ类,均为异源二聚体,分别由一个结合多肽的N端胞外区、一个含有Ig结构域的胞外区、一个疏水性的跨膜区和一个C端胞内区组成。MHC Ⅰ类分子包含一条α重链和β2m蛋白,α重链由3个胞外球蛋白结构域组成,位于N端的结构域α1和α2共价结合构成抗原肽的结合位点,而Ig样的α3结构域与β2m蛋白结合(图1A)。MHC Ⅱ类分子包含一条α链和一条β链,α链和β链的α1和β1结构域组成了多肽的结合区,α2和β2结构域形成与Ig折叠同源的球形环,与多肽的结合无关[4](图1B)。

图1 MHC分子结构图示Fig.1 Structure of MHC
2 pMHC多聚体的结构
pMHC多聚体技术以可溶的pMHC为基础,在重组表达时截除MHC分子的跨膜区及C末端胞内区。pMHC多聚体技术的发展主要集中于多聚体中pMHC价数的增加,以增强多聚体与T细胞的相互作用亲合力,以及连接到多聚体复合物上的荧光分子数量的增加以增强染色强度,提高它们的检测性能[5]。除了荧光分子标记的pMHC多聚体外,还有其他分子标记的pMHC多聚体以适应不同的应用[6,7]。
2.1pMHC二聚体(Dimers) pMHC二聚体利用了免疫球蛋白IgG作为二聚支架(图2A)。二聚的pMHC:IgG结构补偿了单体的pMHC-TCR相互作用相对较低的亲和力特性,提供了更强的结合亲合力。MHC:IgG 二聚的融合蛋白在1993年被构建出来,MHC分子的重链通过重组DNA技术被融合到鼠免疫球蛋白IgG1重链可变区的N末端。包含融合蛋白基因的表达载体随后与人类-b2-微球蛋白(β2m)基因共同转化免疫球蛋白重链缺陷的骨髓瘤细胞株,经表达纯化后的MHC能够方便地被标记和负载目标短肽[8]。此外,pMHC二聚体中免疫球蛋白支架的铰链区为pMHC结合到T细胞上提供了较多的灵活性[9]。
2.2pMHC四聚体(Tetramers) pMHC的四聚体首次被Altman 等于1996年报道用于抗原特异的细胞毒性T细胞的直接观察和计数[3]。pMHC的四聚化是基于链霉亲和素蛋白(Streptavidin,SA)的四聚特性以及SA与生物素的高亲和力结合特性。在构建四聚体时,首先在MHC分子重链的C-末端添加一个15个氨基酸的生物素连接酶BirA依赖的基底肽(BirA substrate peptide,BSP),再与β2m和特异的抗原短肽折叠复性,经纯化后使用BirA进行体外生物素化。生物素化的pMHC与荧光标记的SA混合,形成pMHC的四聚体[3](图2B)。由于pMHC四聚体具有四面体的空间结构,在与T细胞表面的TCR相互作用时,一次最多能结合3个TCR[9]。
2.3pMHC五聚体(Pentamers) pMHC的五聚体包含五个pMHC分子,并通过自组装的卷曲螺旋结构(Coild coil domain)五聚化(图2C)。五聚体中5个pMHC复合物朝向相同,提供了更高的亲合力,并且每个pMHC五聚体能够偶联多至5个的荧光分子或生物素标签用于明亮有效的标记[10]。
2.4Dextramers Dextramers是基于葡萄聚糖(Dextran)骨架的pMHC多聚体(图2D)。Dextrans是葡萄糖主要通过1~6连接和1~3支链连接的多聚物,其长度可变,分子大小从十几到几百kD。通过将荧光分子和链霉亲和素蛋白共价连接到Dextrans上,再与生物素化的pMHC混合制备Dextramers。Dextramers是pMHC不均一的多聚体。一个270 kD的Dextran平均能够交连20个荧光素和10.5个链霉亲和素蛋白,最多能聚合42个pMHC单体,如此高价的pMHC多聚体具有更高的TCR结合亲合力,同时结合的荧光分子数量更多,使得抗原特异性T细胞染色强度更高[11]。此外,也可通过另一种方式制备Dxtramer,即先将生物素化的pMHC单体与荧光标记的SA以3∶1的比例混合,再利用未完全饱和的SA生物素结合位点与生物素化的Dextran混合制备多聚体[12]。
2.5pMHC八聚体(Octamers) pMHC的八聚体也是以链霉亲和素蛋白作为支架(图2E)。通过在MHC分子重链的C-末端引入一个游离的半胱氨酸残基,以便使用烷基化试剂进行生物素标记。在pMHC生物素化时,使用含有分支的包含生物素和两个马来酰胺部分的肽(DMGS-生物素)进行生物素化,获得的pMHC二聚体再与荧光标记的链霉亲和素蛋白混合形成八聚化的pMHC。当使用不含分支的生物素连接的烷基化试剂时,可以制备四聚的pMHC,区别于使用生物素连接酶BirA进行生物素化制备的四聚体。使用烷基化试剂进行生物素化制备的pMHC多聚体更易获得均一的组份[13]。
2.6pMHC十二聚体(Dodecamers) pMHC十二聚体的核心支架是一个经过位点突变无生物素结合活性的链霉亲和素蛋白[14]。通过在核心支架SA末端引入游离半胱氨酸并使用烷基化试剂进行生物素化后,与荧光标记的正常的具有生物素结合活性的SA以1∶4反应,形成SA的五聚体,制备的SA的五聚体再与生物素化的pMHC混合, 完成pMHC的十二聚化[15](图2F)。
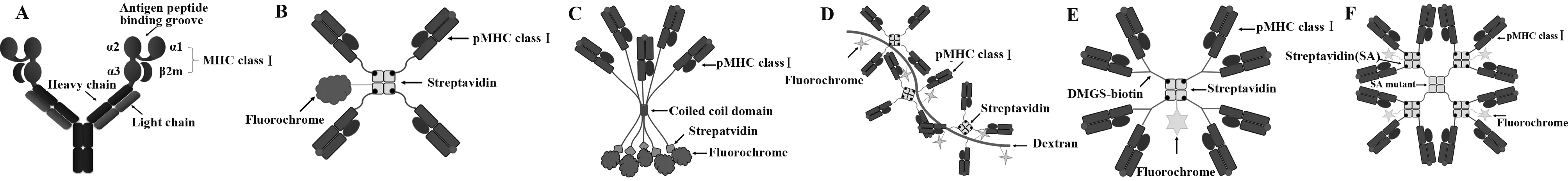
图2 pMHC多聚体的结构示意图Fig.2 Structure of pMHC multimersNote:A.The dimer complex;B.The tetramer complex;C.The pentamer complex;D.The dextramer complex;E.The octamer complex;F.The dodecamer complex.

图3 Streptamer和Histamer复合体可逆染色技术的基本原理Fig.3 Streptamer and Histamer complex and basic princi-ple of reversible staining technologyNote:A.The streptamer complex and the basic principle of the reversible staining technology;B.The Histamer complex and the basic principle of the reversible staining technology.
2.7Streptamers Streptamer是一种能可逆聚化的pMHC多聚体(图3A)。由Neudorfer等[16]设计用于抗原特异的细胞毒性T淋巴细胞(Cytotoxic T lymphocytes,CTL)的检测和纯化。Streptamers由两部分组成,一是C-末端融合表达了Strep-tagIII标签的pMHC,另一个是Strep-Tactin聚合物。Strep-tagIII由两个Strep-tagII串联而成,Strep-tagII包含八个氨基酸残基(Trp-Ser-His-Pro-Gln-Phe-Glu-Lys),与工程改造过的链霉亲和素蛋白衍生物Strep-Tactin具有较强的结合亲和力(KD~10-6M)。pMHC-Strep-tagIII与荧光标记的Strep-Tactin聚合形成的多聚体,可被生物素的加入竞争性的解聚,通过一轮的清洗,pMHC-Strep-tagIII能自发地从CTL上分离。Streptamer的可逆聚化性质,在临床应用中,可使抗原特异的CTL被转移到患者体内而不带任何的Streptamers残基[9]。
2.8Histamers Tischer等报道了另一种能可逆聚化的pMHC多聚体,被命名为Histamer(图3B)。Histamer利用了6×组氨酸标签与金属钴的亲合特性,pMHC的多聚化是将带6×组氨酸标签的pMHC与表面含有钴离子的磁珠混合,形成的多聚体可通过加入L-组氨酸解聚。L-组氨酸能够竞争性地结合磁珠表面的钴离子。由于使用了磁珠制备多聚体,在抗原特异性T细胞分离时,可直接使用磁性吸附进行分离。这种方法可参照GMP(good manufactur-ing practice)被应用于分离高纯度的抗原特异的T细胞亚群,而后被直接或经体外扩增后用于抗原特异的T细胞过继免疫治疗[17]。
此外,还有一些其他类型的pMHC多聚体,如基于NTA-Ni2+与带组氨酸标签的pMHC形成的可逆聚化多聚体[18];使用脱硫生物素制备的pMHC四聚体在低温时具有良好稳定性和染色效果,当温度升高尤其是有生物素存在时可解离形成单体[19];基于量子点的pMHC多聚体也被用于抗原特异的T细胞表型分析[20]。
3 pMHC多聚体的应用
自从Altman等在1996年设计出实用的抗原特异性T细胞标记分子工具以来,pMHC多聚体迅速成为T细胞分析和操作的金标准,以荧光标记的pMHC多聚体染色对应T细胞的方式被广泛应用于抗原特异的T细胞的检测、观察、计数、表型分析和分离等[21-26]。
pMHC多聚体也可用于检测TCR和MHC之间的结合力。一般多聚体染色的强度和TCR/MHC亲和力成正比[27]。TCR和MHC的解离速率可以通过四聚体衰变(Tetramer decay)的方法测量[28],荧光四聚体染色的T细胞在封闭抗体的作用下,四聚体逐渐从T细胞解离下来,通过流式细胞仪分析荧光强度变化,可计算出解离速率。
近年来,过继T细胞治疗(Adoptive T cell therapy)作为一种有效的癌症治疗方法引起广泛关注[29],该方法通过将体外扩增的抗原特异性自体T细胞回输到患者体内达到治疗目的。Yee等报道了利用pMHC四聚体染色技术从患者外周血中分离抗原特异的T细胞并用于转移性黑色素瘤的过继免疫治疗[30,31]。由于外周血中抗原特异性T细胞比例极小,通过体外抗原肽的刺激并结合IL-21的使用,可以大幅度提高抗原特异性T细胞的比例。细胞经体外刺激后再经过荧光标记的pMHC四聚体染色,可使用流式分选仪将抗原阳性的T细胞分离出来并经过体外扩增后回输到患者体内,以达到治疗目的。
此外,pMHC多聚体在监控患者接种癌症疫苗或感染病毒后的T细胞反应中也起到关键作用。 最近有文章报道使用新抗原(Neo-antigens)免疫癌症患者的方法[32,33],免疫后的患者外周血使用新抗原结合的MHC多聚体检测,发现抗原特异性T细胞比例迅速提高,从而证实免疫起到了良好效果。
pMHC多聚体在癌症特异性抗原肽发现和验证上也起着重要作用。通过质谱鉴定[34]或者预测[35]的方法筛选抗原肽并制备成相应的MHC多聚体,应用多聚体染色和流式细胞分选技术将外周血或者肿瘤浸润淋巴细胞中抗原特异性T细胞分离出来,最后通过一系列功能实验对抗原肽作进一步验证。癌症特异的抗原肽发现和验证为癌症免疫治疗提供更多特异性的靶点,具有重要意义。
4 pMHC多聚体之间的比较
pMHC四聚体由于最先被报道用于体外抗原特异性T细胞分析,能够检测和分离外周血中少量存在的抗原特异的T细胞,具有广泛的适用性,另一方面,四聚体能方便容易地在实验室制备,只需要基础的蛋白表达和纯化设备即可,因此四聚体也是目前仍然被广泛使用的多聚体类型[36]。五聚体由于包含5个朝向相同的pMHC复合物,相比于四聚体的四面体结构,具有更强的TCR相互作用亲合力,同时,五聚体允许被高达5个的荧光分子标记,因此也具有比四聚体更亮的信号[10]。Dextramers由于包含更多数量的pMHC和荧光分子,具有比四聚体更明亮的染色,同时在低亲和力的TCR-pMHC相互作用以及Ⅱ型pMHC染色方面,dextramers表现更胜一筹[36]。使用包含马来酰胺的烷基化试剂进行生物素化的方法制备的八聚体比四聚体具有更高的T细胞结合能力,同时,通过烷基化试剂制备的多聚体与传统的四聚体相比,生物素化过程中烷基化形成的硫醚键比BirA生物素连接酶形成的酰胺键更加稳定,不易于被蛋白酶类和化学降解[13]。
十二聚体在抗原特异性T细胞检测、分离和表型分析上比四聚体更加灵敏和多用途。例如,在人类和小鼠CD4+和CD8+αβ T细胞组分中,十二聚体能够检测出比四聚体多2至5倍的抗原特异的T细胞。在低亲和力的T细胞检测上,十二聚体也表现更灵敏,能够检测早期的CD4+CD8+双阳性胸腺细胞,而这些细胞中T细胞受体的密度比成熟T细胞低10~30倍;在稀有的γδ T 细胞分析上十二聚体也表现出更多实用性。此外,由于十二聚体比四聚体具有更强的结合能力并且解离速度更慢,在单细胞质谱技术应用上具有更强的优势。当用于抗原特异性T细胞染色时,十二聚体的荧光强度是四聚体的5倍多;同时,在4℃染色时,具有与四聚体相当的最低染色背景。与Dextramer相比,在使用相同浓度荧光标记的SA时,十二聚体的荧光强度比Dextramer稍强[15]。
在抗原特异性T细胞的检测和分离过程中,多聚体的存在可能导致延长的T细胞受体信号以及随后的T细胞功能改变。Neudorfer 等阐述了基于Streptamer的分选技术。在人类T淋巴细胞分选上,Streptamer具有与传统四聚体相似的特异度和灵敏度,但Streptamer完全可逆。与传统的四聚体相比,Streptamer从细胞上解离后,抗原特异性T细胞仍然保持功能活性,以致于在一定情况下可直接将pMHC多聚体分选出的T细胞转移到特定条件的患者。Streptamer在转移前能从T细胞上解离下来,避免了直接针对pMHC多聚体试剂的免疫反应[16]。使用磁珠偶联的Streptamer也更适用于GMP水平[37]。MHC-streptamer技术对于使用抗原特异的T细胞群体进行的过继免疫治疗的发展具有重要促进作用。Histamers是Tischer等发展出来的另一个新型可逆化多聚体。Histamers同样能分选出高纯度和特异性T细胞而不改变T细胞群体的功能状态。与Streptamer不同的是可直接使用免疫磁珠分离的方法将抗原特异性T细胞分选出来。Histamers在观察和分离抗原特异性细胞的效率上与五聚体相似[17]。
5 结语
pMHC多聚体现已是免疫学研究的常规工具。在进行抗原特异性T细胞标记染色时,一方面,pMHC多聚体染色对应T细胞的能力与单体的pMHC/TCR相互作用半衰期相关。另一方面,对于使用给定的pMHC多聚体进行特定的T细胞染色强依赖于特定的染色条件以及被染色时细胞的状态,Wooldridge等[38]和Dolton等[39]对pMHC多聚体染色的影响因素和技巧作了详细的阐述。近年来,多色流式细胞术以及质谱串联流式细胞术的发展,也为抗原特异性T细胞的分析提供了重要支撑[40]。在实际应用中,我们可根据T细胞标记染色时的TCR/pMHC亲和力选择恰当的pMHC多聚体形式;用于抗原特异性T细胞的分离、克隆并用于过继免疫治疗时,使用可逆的pMHC多聚体更能保留T细胞的功能。
在抗原特异性T细胞染色方面,pMHC多聚体也存在一个主要问题:pMHC多聚体染色对应T细胞所需要的TCR-pMHC亲和力阈值超出了T细胞被pMHC激活所需的亲和力阈值,以致于不能检测出所有的能应答特定pMHC的T细胞。这种情况尤其存在于染色抗肿瘤的T细胞、自身免疫细胞以及Ⅱ类MHC限制的T细胞时[39]。虽然到目前为止,使用一些染色技巧,如在蛋白激酶抑制剂(PKI)存在下染色[41]、使用高价的pMHC多聚体[36]以及使用抗多聚体的抗体增强染色信号等[42],我们已能将染色T细胞所需的pMHC/TCR相互作用亲和力大大提升(KD>10-3M),但仍不能保证这种提升能使pMHC多聚体达到染色所有有功能的T细胞的程度[39]。
近年来,基于pMHC多聚体技术的抗原特异性T细胞检测有了新突破,由于受限于荧光分子及金属标签的种类限制,使得使用流式细胞计数或质谱偶联细胞计数能在单个样品中同时检测的抗原应答T细胞数量有限,Bentzen等利用“DNA条码”标记的pMHC多聚体实现了大规模的抗原特异性T细胞检测,能在单一样品中同时筛查>1 000种的抗原多肽特异性。这种技术能将功能性的T细胞分析与大规模的抗原表位识别谱结合在一起,在各种疾病的T细胞识别表征中发挥重要作用[7]。随着免疫治疗和精准治疗的火热,pMHC多聚体技术在抗原特异的T细胞分析中仍将发挥着重要作用,新技术的发展也将扩展至更多方面的应用。
[1] Bentzen AK,Hadrup SR.Evolution of MHC-based technologies used for detection of antigen-responsive T cells[J].Cancer Immunol Immunother,2017,66(5):657-666.
[2] Corr M,Slanetz AE,Boyd LF,etal.T cell receptor-MHC class I peptide interactions:affinity,kinetics,and specificity[J].Science,1994,265(14):946-949.
[3] Altman JD,Moss PAH,Goulder PJ,etal.Phenotypic analysis of antigen-specific T lymphocytes[J].Science,1996,274(5284):94-96.
[4] Goldberg AC,Rizzo LV.MHC structure and function - antigen presentation.Part 1[J].Einstein (Sao Paulo),2015,13(1):153-156.
[5] Tario J JD,Chen GL,Hahn TE,etal.Dextramer reagents are effective tools for quantifying CMV antigen-specific T cells from peripheral blood samples[J].Cytometry B Clin Cytom,2015,88(1):6-20.
[6] Newell EW,Sigal N,Bendall SC,etal.Cytometry by time-of-flight shows combinatorial cytokine expression and virus-specific cell niches within a continuum of CD8+T cell phenotypes evan[J].Immunity,2012,36(1):142-152.
[7] Bentzen AK,Marquard AM,Lyngaa R,etal.Articles Large-scale detection of antigen-specific T cells using peptide-MHC-I multimers labeled with DNA barcodes[J].Nat Biotechnol,2016,34(10):1037-1045.
[8] Dal Porto J,Johansen TE,Catipovic B,etal.A soluble divalent class I major histocompatibility complex molecule inhibits alloreactive T cells at nanomolar concentrations.[J].Proc Natl Acad Sci U S A,1993,90(14):6671-6675.
[9] Casalegno-Garduo R,Schmitt A,Yao J,etal.Multimer technologies for detection and adoptive transfer of antigen-specific T cells[J].Cancer Immunol Immunother,2010,59(2):195-202.
[10] Duplan V,Suberbielle E,Napper CE,etal.Tracking antigen-specific CD8+T cells in the rat using MHC class I multimers[J].J Immunol Methods,2007,320(1-2):30-39.
[11] Batard P,Peterson DA,Devêvre E,etal.Dextramers:New generation of fluorescent MHC class I/peptide multimers for visualization of antigen-specific CD8+T cells[J].J Immunol Methods,2006,310(1-2):136-148.
[12] Bethune MT,Comin-Anduix B,Hwang Fu YH,etal.Preparation of peptide-MHC and T-cell receptor dextramers by biotinylated dextran doping[J].Biotechniques,2017,62:123-130.
[13] Guillaume P,Legler DF,Boucheron N,etal.Soluble major histocompatibility complex-peptide octamers with impaired CD8 binding selectively induce Fas-dependent apoptosis[J].J Biol Chem,2003,278(7):4500-4509.
[14] Howarth M,Chinnapen DJ,Gerrow K,etal.A monovalent streptavidin with a single femtomolar biotin binding site[J].Nat Methods,2006,3(4):267-273.
[15] Huang J,Zeng X,Sigal N,etal.Detection,phenotyping,and quantification of antigen-specific T cells using a peptide-MHC dodecamer[J].Proc Natl Acad Sci U S A,2016,113(13):1890-1897.
[16] Neudorfer J,Schmidt B,Huster KM,etal.Reversible HLA multimers (Streptamers) for the isolation of human cytotoxic T lymphocytes functionally active against tumor- and virus-derived antigens[J].J Immunol Methods,2007,320(1-2):119-131.
[17] Tischer S,Kaireit T,Figueiredo C,etal.Establishment of the reversible peptide-major histocompatibility complex (pMHC) class I Histamer technology:Tool for visualization and selection of functionally active antigen-specific CD8+T lymphocytes[J].Int Immunol,2012,24(9):561-572.
[18] Schmidt J,Guillaume P,Irving M,etal.Reversible major histocompatibility complex I-peptide multimers containing Ni2+-nitrilotriacetic acid peptides and histidine tags improve analysis and sorting of CD8+T cells[J].J Biol Chem,2011,286(48):41723-41735.
[19] Guillaume P,Baumgaertner P,Angelov GS,etal.Fluorescence-activated cell sorting and cloning of bona fide CD8+CTL with reversible MHC-peptide and antibody Fab′ conjugates[J].J Immunol,2006,177(6):3903-3912.
[20] Chattopadhyay PK,Price Da,Harper TF,etal.Quantum dot semiconductor nanocrystals for immunophenotyping by polychromatic flow cytometry[J].Nat Med,2006,12(8):972-977.
[21] Yee C,Savage PA,Lee PP,etal.Isolation of high avidity melanoma-reactive ctl from heterogeneous populations using peptide-MHC tetramers[J].J Immunol,1999,162:2227-2234.
[22] Meyer AL,Trollmo C,Crawford F,etal.Direct enumeration of Borrelia-reactive CD4 T cells ex vivo by using MHC class II tetramers[J].Proc Natl Acad Sci U S A,2000,97(21):11433-11438.
[23] Micha⊇lsson J,Achour A,Salcedo M,etal.Visualization of inhibitory Ly49 receptor specificity with soluble major histocompatibility complex class I tetramers[J].Eur J Immunol,2000,30:300-307.
[24] Mulder A,Eijsink C,Kardol MJ,etal.Identification,isolation,and culture of HLA-A2-specific B lymphocytes using MHC Class I tetramers[J].J Immunol,2003,171:6599-6603.
[25] Wölfl M,Schalk S,Hellmich M,etal.Quantitation of MHC tetramer-positive cells from whole blood:evaluation of a single-platform,six-parameter flow cytometric method[J].Cytometry A,2004,57A:120-130.
[26] James EA,LaFond R,Durinovic-Bello I,etal.Visualizing antigen specific CD4+T cells using MHC class II tetramers[J].J Vis Exp,2009,25:e1167.
[27] Zhong S,Malecek K,Johnson LA,etal.T-cell receptor affinity and avidity defines antitumor response and autoimmunity in T-cell immunotherapy[J].Proc Natl Acad Sci U S A,2013,110(17):6973-6978.
[28] Malecek K,Zhong S,McGary K,etal.Engineering improved T cell receptors using an alanine-scan guided T cell display selection system[J].J Immunol Methods,2013,392(1-2):1-11.
[29] Restifo NP,Dudley ME,Rosenberg SA.Adoptive immunotherapy for cancer:harnessing the T cell response[J].Nat Rev Immunol,2012,12(4):269-281.
[30] Hunder NN,Wallen H,Cao J,etal.Treatment of metastatic melanoma with autologous CD4+T cells against NY-ESO-1[J].N Engl J Med,2008,358(25):2698-2703.
[31] Pollack SM,Jones RL,Farrar EA,etal.Tetramer guided,cell sorter assisted production of clinical grade autologous NY-ESO-1 specific CD8(+) T cells[J].J Immunother Cancer,2014,2(1):36.
[32] Sahin U,Derhovanessian E,Miller M,etal.Personalized RNA mutanome vaccines mobilize poly-specific therapeutic immunity against cancer[J].Nature,2017,547(7662):222-226.
[33] Ott PA,Hu Z,Keskin DB,etal.An immunogenic personal neoantigen vaccine for patients with melanoma[J].Nature,2017,547(7662):217-221.
[34] Bassani-Sternberg M,Coukos G.Mass spectrometry-based antigen discovery for cancer immunotherapy[J].Curr Opin Immunol,2016,41:9-17.
[35] Snyder A,Chan TA.Immunogenic peptide discovery in cancer genomes[J].Curr Opin Genet Dev,2015,30:7-16.
[36] Dolton G,Lissina A,Skowera A,etal.Comparison of peptide-major histocompatibility complex tetramers and dextramers for the identification of antigen-specific T cells[J].Clin Exp Immunol,2014,177(1):47-63.
[37] Wang X,Pang H,Xu X,etal.Streptamer versus tetramer-based selection of functional cytomegalovirus-specific T cells[J].J Formos Med Assoc,2013,112(6):338-345.
[38] Wooldridge L,Lissina A,Cole DK,etal.Tricks with tetramers:how to get the most from multimeric peptide-MHC[J].Immunology,2009,126(2):147-164.
[39] Dolton G,Tungatt K,Lloyd A,etal.More tricks with tetramers:A practical guide to staining T cells with peptide-MHC multimers[J].Immunology,2015,146(1):11-22.
[40] Bacher P,Scheffold A.Flow-cytometric analysis of rare antigen-specific T cells[J].Cytometry A,2013,83A:692-701.
[41] Lissina A,Ladell K,Skowera A,etal.Protein kinase inhibitors substantially improve the physical detection of T-cells with peptide-MHC tetramers[J].J Immunol Methods,2009,340(1):11-24.
[42] Tungatt K,Bianchi V,Crowther MD,etal.Antibody stabilization of peptide-MHC multimers reveals functional T cells bearing extremely low-affinity TCRs[J].J Immunol,2015,194(1):463-474.

