根尖牙乳头间充质干细胞移植对胶原诱导性关节炎的影响①
顾永春 汤 颖 张燕萍 朱 琦 管学妹
(苏州市吴江区第一人民医院中心实验室,苏州 215200)
类风湿性关节炎(Rheumatoid arthritis,RA)是一种原因不明的自身免疫性疾病,其主要临床表现为慢性、对称性、多发性外周关节炎,以关节滑膜慢性炎症、关节进行性破坏为特征。当前临床药物治疗只能暂时缓解症状,或是减缓疾病的进程,但均不能真正治愈RA,也无法修复骨与软骨的破坏,且存在各种药物副作用[1,2]。
间充质干细胞(Mesenchymal stem cells,MSCs)可从机体各组织中分离获得,它们具有自我更新及多向分化能力[3]。此外,以往研究表明,MSCs在体内及体外均具有免疫调控能力[4];在治疗RA等自身免疫性疾病上具有广阔的应用前景。尤其是同种异体来源的骨髓及脐带MSCs,在临床试验中应用最多,总体被证明是安全、有效的[5,6]。根尖乳头干细胞(Stem cells from the apical papilla,SCAP)是存在于未完全发育成形的恒牙根尖周组织中的成体MSCs,它具有MSCs的基本特征,是牙根发育成牙本质细胞的重要源,在牙根的形成和发育中起重要作用;然而目前,对人SCAP免疫调节作用方面的研究较为欠缺[7]。胶原诱导性关节炎(Collagen-induced arthritis,CIA)是最常用的RA动物模型,它在临床症状、组织学、免疫学等特征上与RA有许多共同点[8]。本研究将评价一次性移植人SCAP(hSCAP)能否改善CIA小鼠的炎症程度。
1 材料与方法
1.1实验动物及试剂 SPF级健康雄性DBA/1J 小鼠(6~8周)26只,体重 18~23 g,购自上海灵畅生物科技有限公司;鼠抗人Stro-1-FICE、CD29-PE、CD73-PE、CD90-PE、CD90-PE、CD105-PE、CD166-PE、CD34-PE、CD45-PE、CD4-PerCP、CD25-APC抗体购自BD Biosciences (美国);抗CD105-PE、Foxp3-PE、IL-17-PE、IL-4-PE和 IFNγ-APC抗体购自eBioscience(美国)。
1.2方法
1.2.1SCAP的分离、培养及诱导分化 临床采集因正畸拔除的根尖发育尚未完成的健康前磨牙。无菌条件下分离根尖牙乳头,采用组织块培养法,将切碎的根尖牙乳头组织碎块放入培养液37℃、5%CO2条件下用含15%FBS(Gibco,美国)的α-MEM培养基(Hyclone,美国)进行培养;每周换液2次。细胞融合达80%时2.5 g/L胰酶消化传代,取P3代细胞用于后继实验。
1.2.2SCAP干细胞表面标志物鉴定 用PBS将SCAP重悬为2×106ml-1的细胞悬液,分装于离心管,每管200 μl。每管分别加2 μl鼠抗人CD29-PE、CD34-PE、CD45-PE、CD90-PE、CD105-PE、CD146-PE、Stro-1-FICE单克隆抗体,并设1管空白对照,4℃避光孵育1 h。然后取得细胞后PBS洗3次,1 600 r/min离心6 min后重悬于PBS溶液中,流式细胞仪(BD Calibur,美国)检测细胞表面标志物的阳性表达率。
1.2.3成骨、成脂诱导培养 将SCAP接种于6孔培养板进行细胞培养,到50%~60%融合时,将完全培养液换为含50 μg/ml抗坏血酸、0.1 mol/L地塞米松、10 mmol/L β-甘油酸钠的成骨培养液进行成骨诱导3周,茜素红染色观察矿化结节,评估SCAP的成骨能力。成脂诱导则换为含0.5 mmol/L IBMX、60 μmol/L吲哚美辛、0.5 μmol/L氢化可的松,10 μg/ml胰岛素的成脂诱导液诱导培养2周,油红O染色观察其成脂能力。
1.2.4诱导、治疗CIA 为了建立CIA小鼠模型,先将鸡Ⅱ型胶原(CⅡ)(Chondrex,美国)与完全性弗氏佐剂(CFA)(Chondrex,美国)在冰上混合并完全乳化,而后在DBA/1J 小鼠尾根部皮下注射含100 μg CⅡ的乳剂,21 d后进行加强免疫,注射含100 μg CⅡ与不完全弗氏佐剂(Chondrex)混合配制的乳剂。阴性对照组(n=6)为正常小鼠,免疫时在相同部位注射同体积的PBS替代CⅡ乳剂。 初次免疫后第21天,SCAP治疗组(n=10)通过CIA小鼠的尾静脉一次性移植1×106个SCAP,阳性对照组注射等体积的PBS(n=10)。每周2次记录关节炎指数评分及CIA发病率。计分方法如下:0分=无病损,1分=爪子有一个指头观察到肿胀,2分=爪子有一个以上指头观察到肿胀,3分=爪子的所有指头及爪背肿胀,4分=爪子及踝关节严重肿胀,将4个爪子的评分相加得到的总分为该小鼠的关节炎指数评分。实验结束(第56天)处死小鼠,采集周围血、脾淋巴细胞、后肢膝关节和足爪作进一步研究。
1.2.5流式细胞分析 采集CIA小鼠的脾脏,并提取淋巴细胞。取1×106/管的细胞先用抗CD4抗体在冰上避光条件下孵育30 min,为了分析调节性T细胞(Tregs),需加入1 μg 抗CD25抗体孵育,用Foxp3 染色缓冲液套装试剂(eBioscience)对细胞固定、打孔后,再用1 μg抗Foxp3抗体(检测Tregs)、抗IL-4抗体(检测Th2)及抗IFN-γ/抗IL-17抗体(分别检测Th1和Th17)孵育细胞。然后用流式分析清洗缓冲液(PBS加0.4% BSA配置)清洗细胞,最后用流式细胞分析仪及 FlowJo 10软件进行流式细胞分析。
1.2.6酶联免疫分析 各组CIA小鼠的血清分离后-80℃冰箱保存。血清TNF-α(pg/ml)及抗CⅡ抗体水平(kU/100 ml)检测采用ELISA试剂盒。小鼠TNF-α ELISA检测试剂盒(Bioscience,美国)及鼠抗鸡CⅡ抗体ELISA检测试剂盒(Cayman,美国)的使用方法参照产品说明书。
1.2.7组织病理学分析 4%多聚甲醛溶液固定膝关节、脱矿、常规石蜡包埋。6 μm的厚度系列切片并作HE染色。显微镜下观察形态特点并对关节炎进行组织病理学评分。按照以往文献报道[11],从滑膜炎症、血管翳、软骨及骨质侵蚀破坏这3个方面进行评分:0分=无炎症迹象,1分=轻微炎症、破坏,2分=轻度,3分=中度,4分=重度。
1.2.8显微CT分析 将小鼠后爪切除后固定于显微CT样品台中央。显微 CT(Skyscan1174,布鲁克斯,比利时)扫描参数设置为:扫描电压 50 kV,电流800 μA,0.5 mm铝箔过滤,扫描角度360°,旋转步长0.7°,空间分辨率设置为23 μm×23 μm×23 μm。将扫描后获得的二维图像进行三维重建,不同角度观察足爪关节骨密质、骨松质及关节间隙的破坏状况。
1.3统计学方法 SPSS13.0 作统计学分析。单因素方差分析及Tukey检验比较3组间的差异,Student-t检验比较两组间均值的差异(病理学评分)。P<0.05 视为差异有统计学意义。
2 结果
2.1hSCAP的培养、鉴定和多向分化 根尖乳头组织块培养7 d后,可观察到SCAP爬出并贴壁生长。细胞呈梭形、成纤维细胞样,之后增殖形成集落,克隆形态呈岛状或巢状,和周围界限明显;14 d后集落增大呈漩涡状,形态均一。在合适的培养条件下,它们向成骨及成脂方向诱导分化。流式细胞分析显示细胞表面标志物CD34、CD45表达均为阴性,但CD29、CD73、CD90、CD105、CD166 及Stro-1表达阳性,符合MSCs的特征(图1)。SCAP在成骨诱导液及成脂诱导液培养条件下能够分别向成骨矿化与成脂方向分化,3周后茜红素染色见矿化结节形成;2周后油红染色见串珠样脂滴形成(图2)。
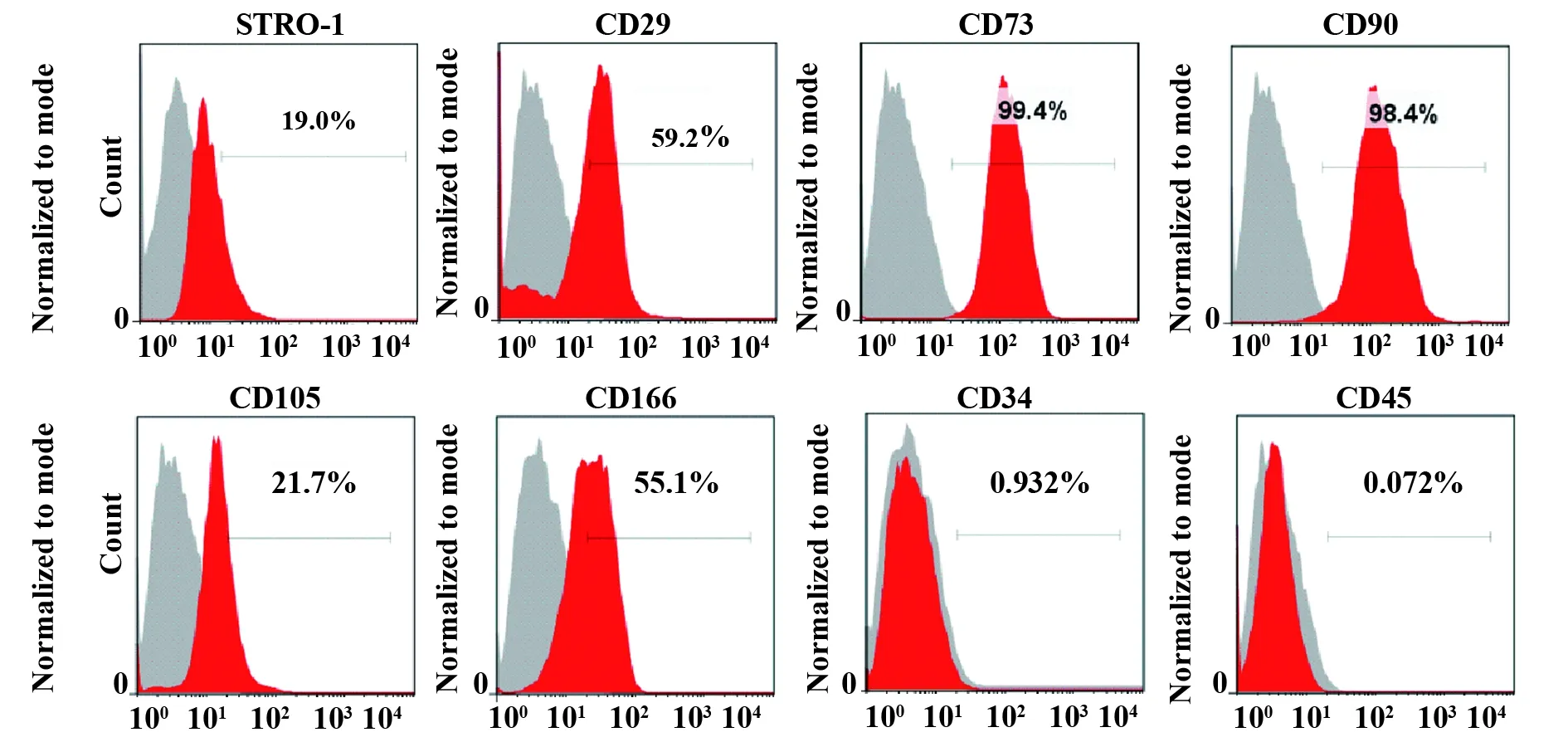
图1 hSCAP细胞表面标志物的流式细胞分析Fig.1 Flow cytometric analysis of surface molecules of hSCAP
2.2一次性移植hSCAP可以有效减轻CIA的炎症程度 本研究中,CIA阳性对照组(n=10,注射PBS)与SCAP移植治疗组(n=10)的20只DBA/1J小鼠用Ⅱ型胶原蛋白免疫后出现不同程度的关节炎症状,对照组CIA发病率100%,SCAP治疗组发病率90%,单从发病率看,两者差异无统计学意义(P>0.05)(图3B)。但从关节炎指数均值看,hSCAP治疗组的评分显著低于PBS阳性对照组(图3C),提示SCAP移植具有减轻炎症的治疗效果。组织病理分析提示,SCAP治疗组在移植后35 d,炎症程度(滑膜炎、血管翳形成、软骨和骨的侵蚀破坏程度)均比对照组轻(图3D、E)。显微CT分析进一步证实SCAP细胞治疗的有效性:CIA组小鼠后爪观察到严重的骨质破坏与侵蚀,关节间隙变得不规则,皮质骨缺损与骨质沉积并存,骨密度下降,而SCAP组关节破坏程度明显减轻(图3F)。ELISA分析显示一次性移植SCAP能降低CIA小鼠血清抗CⅡ特异性 IgG 抗体以及促炎细胞因子TNF-α的水平(图3G、H)。
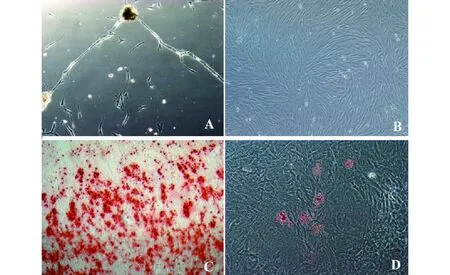
图2 hSCAP的培养与多向诱导分化(×40)Fig.2 Culture and multipotent differentiation of hSCAP (×40)Note:A.SCAP migrate from the pieces of tissue,and adhere to the plastic cell culture plate,exhibiting spindle-like shape in vitro (P0);B.The cell colonies of SCAP are fused together,exhibiting whirlpool-like shape (P3);C.Alizarin red staining for calcium showed the mineralization potential of SCAP after osteogenic differentiation;D.Oil red staining for lipid droplets showed the adipogenic potential of SCAP after adipogenic differentiation.

图3 hSCAP移植能缓解CIA小鼠的炎症症状Fig.3 hSCAP transplantation attenuated inflammatory responses in collagen-induced arthritis (CIA) miceNote:A.Arthritis severity scores system (representative images of swollen hind paws ranging from normal to grossly swollen;from left to right the score is 0-4,respectively);B.The CIA incidence shows no significant difference between the positive control(CIA+PBS) and CIA+SCAP groups (100% vs 90%,P>0.05);C.Arthritis severity scores of 3 mice groups (normal,CIA+PBS and CIA+SCAP) were determined at various time points after immunization;D.Comparisons of the histological analysis (score) of knees of 2 mice groups (CIA+SCAP and CIA+SCAP);E.Representative histological images of knees of 3 mice groups(HE staining,pannus is indicated by an arrow,×40);F.Micro-CT analysis of the joint defections of the hind paws of 3 mice groups (representative images of 3D reconstruction);G.Anti-CⅡ IgG,analyzed by enzyme-linked immunosorbent assay (ELISA);H.Serum concentrations of tumor necrosis factor α (TNF-α) analyzed by ELISA;*.P<0.05,**.P<0.01,ns.P>0.05.
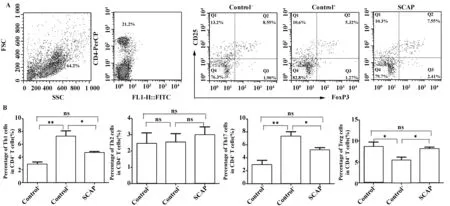
图4 hSCAP移植能影响CIA小鼠脾脏Th细胞的极化(流式分析)Fig.4 hSCAP transplantation influenced polarization of Th cells(Flow cytometry)Note:A.FlowJo software was used to gate CD4+ Th and CD25+ Foxp3+ Tregs;representative flow cytometry data show Tregs in the spleens of 3 mice groups;B.SCAP can significantly decrease the percentage of CD4+IFN-γ+ Th1 and CD4+IL-17+ Th17 cells in the mouse spleen,and increase the percentage of CD4+CD25+FoxP3+ Tregs;whereas the difference in the percentage of Th2 has no statistical significance.*.P<0.05,**.P<0.01,ns.P>0.05.
2.3hSCAP移植会影响CIA小鼠脾脏辅助性T细胞(Th)亚群比例的改变 对脾脏CD4+Th细胞的流式细胞分析显示,hSCAP移植能显著降低CIA小鼠脾脏CD4+IFN-γ+Th1 及CD4+IL-17+Th17 的百分比,上调CD25+FoxP3+Tregs的百分比,而Th2的比例在各组间差异无统计学意义(P>0.05,图4)。
3 讨论
近年来,MSCs的免疫调控功能日益受到关注,通过动物实验及临床试验,越来越多证据表明MSCs移植在治疗自身免疫性疾病上总体是安全、有效的[2,5,6,9-11]。但由于研究方法及疾病种类的差异(如供体MSCs的种类、移植细胞剂量和移植次数、细胞培养方法及细胞状态的不同导致治疗步骤缺乏标准化),在MSCs治疗RA或CIA时,治疗效果有时并不肯定[12]。加上目前关于MSCs发挥免疫调控作用的详细分子机制尚不清楚,在许多问题上仍存在争议。
SCAP是具有高度增生、自我更新能力和多向分化潜能的成体干细胞;是牙根发育成牙本质细胞的重要源,在牙根的形成和发育中起着重要的作用[13]。它增殖速度快,与骨髓间充质干细胞(BMSCs)相比,更容易从口腔科临床获得,并且受伦理学限制较小。以往对SCAP的研究主要集中在牙体组织再生及生物学牙根组织工程领域;关于SCAP的免疫调控作用方面的研究报道较为少见。Ding等[7]分离、培养了小型猪SCAP,体外实验证明SCAP对自体及同源异体T细胞增殖具有抑制作用,并呈浓度依赖性;但尚未见关于SCAP移植治疗实验性关节炎或临床试验治疗RA的报道。本研究从口腔科临床采集健康牙根未完全发育完成的离体牙,因正畸原因拔除的前磨牙或阻生的第三磨牙最为常见。我们从根尖乳头中分离、鉴定了SCAP,流式细胞分析显示,SCAP具有和BMSCs相似的干细胞表面标志谱(图1),通过诱导培养,可以表现出多向分化能力,能向成骨与成脂两个方向分化(图2)。CIA是研究RA最常用的动物模型,在探索治疗RA的新方法、新药物时被广泛使用。2007年,Augello等[14]最早报道一次性移植异种的人BMSCs可以治疗CIA,减轻小鼠关节出现的严重不可逆性的软骨及骨损伤。本研究采用雄性的DBA/1J小鼠成功诱导制作了CIA动物模型,其阳性对照组发病率100%。通过一次性尾静脉注射hSCAP评估其治疗实验性关节炎的效果,从而为RA的细胞治疗探索新的MSCs来源,也为进一步认识SCAP的免疫调控特性积累实验数据。
本实验证明,一次性静脉输注异种基因的hSCAP可以有效缓解小鼠实验性关节炎的临床症状,组织病理分析及免疫检测指标均提示炎症的严重程度得到缓解。图3提示,与CIA阳性对照组相比,SCAP治疗组关节炎发病率为90%,但差异无统计学意义(P>0.05);关节炎指数评分均值明显降低(12.2比8.7),减小了近30%;血清C Ⅱ 特异性IgG抗体水平及TNF-α浓度分别减小了近60%(2 285 kU/ml比942 kU/ml)及35%(12.1 pg/ml比7.8 pg/ml);病理学评分显示,SCAP治疗组滑膜炎、血管翳、软骨及骨破坏的评分均有明显下降,显微CT对关节骨破坏的分析与病理分析一致;上述结果表明SCAP确实能下调免疫反应、减小关节软、硬组织的损伤。
以往研究提示,T淋巴细胞在RA的发生、发展及转归中起着重要的作用;传统认为,RA为Th1驱动的自身免疫疾病,Th1/Th2比例失衡在RA发病过程中起重要作用[15]。而近年来,Th17在关节炎症、破坏中的作用正越来越受到重视,Th17在RA及CIA病灶部位高表达,并与疾病的炎症程度相一致;其主要效应因子IL-17是强大的前炎症细胞因子,是炎症反应重要的微调因子[16]。而Treg在抑制各种自身免疫反应、维持免疫耐受的机制中居于中心地位[17]。Augello等[14]指出,异基因MSCs移植后并不能在体内长期存活,因此干细胞治疗能发挥长期免疫抑制作用并非依赖MSCs的活力,而是要归因于抗原特异性激活Treg克隆,从而诱导免疫耐受。本实验发现,CIA阳性对照组小鼠的Th1和Th17均有升高,而CD4+Th细胞中Treg水平却明显降低。SCAP移植后能上调脾脏Treg水平(从5.4%升高到8.1%)而显著降低Th1及Th17水平,从而导致免疫耐受,降低炎症的严重程度;Th2水平略有升高,但差异无统计学意义(P>0.05)。因此,SCAP具有与BMSCs相似的免疫调控特征,能够帮助个体恢复T细胞亚群间的稳态,将来有望用于RA的临床治疗。
我们先前曾证明,小鼠牙龈间充质细胞移植能有效减轻CIA的炎症程度,Fas/Fas配体(FasL)信号通路在MSCs诱导T细胞凋亡中起重要作用,是发挥免疫抑制作用的重要机制之一[2]。然而,对MSCs免疫调控作用的分子机制远未清楚,已知一系列细胞因子被发现可能参与其中,如TGF-β、IL-10、前列腺素E2、NO、吲哚胺2,3-二加氧酶(Indoleamine 2,3-dioxygenase,IDO)[9,18]。以往研究显示,MSCs能够克服个体间MHC的不匹配;在动物模型上,同种异体或是异种MSCs均有调节免疫的治疗效果[19],但其发挥免疫抑制作用的效率及机制可能并不相同。本研究中我们将异种的hSCAP移植给CIA小鼠,包括动物模型制作方法、干细胞提取及培养方法、注射细胞途径、剂量、注射时间点等步骤均与以往用同种异基因的小鼠牙龈MSCs移植治疗相似[2],并取得了相似的治疗效果。Su等[20]比较了不同物种来源的MSCs免疫抑制作用的特点,并研究不同物种MSCs介导免疫抑制作用的核心分子;发现在相同的培养条件下,人、猕猴及猪来源的MSCs主要通过IDO途径来发挥其免疫抑制作用,而小鼠、大鼠、地鼠及兔来源的MSCs则是通过iNOS途径来实现其免疫抑制功能。鉴于此,作者将进一步设计体外细胞实验及体内动物实验,以验证IDO及其他可能的因素在hSCAP治疗CIA机制中所起的作用,但从目前已经掌握的知识来看,其详细的机制非常复杂,各种机制相互交织、相互影响,这仍有待进一步深入研究。
综上所述,本研究表明,静脉移植hSCAP能诱导CIA小鼠T细胞亚群平衡及免疫耐受,从而有效减轻关节炎的严重程度。
[1] Firestein GS.Evolving concepts of rheumatoid arthritis [J].Nature,2003,423:356-361.
[2] Gu Y,Shi S.Transplantation of gingiva-derived mesenchymal stem cells ameliorates collagen-induced arthritis [J].Arthritis Res Ther,2016,18:262.
[3] Andreeva E,Bobyleva P,Gornostaeva A,etal.Interaction of multipotent mesenchymal stromal and immune cells:Bidirectional effects [J].Cytotherapy,2017,19:1152-1166.
[4] Nauta AJ,Fibbe WE.Immunomodulatory properties of mesenchy-mal stromal cells [J].Blood,2007,110:3499-3506.
[5] 王黎明,周建军,白 雯,等.脐带间充质干细胞治疗17 例类风湿性关节炎患者的临床疗效观察 [J].中国免疫学杂志,2010,26(7):659-662.
Wang LM,Zhou JJ,Bai W,etal.Therapeutic efficacy of umbilical cordmesenchymal stem cells for rheumatoid arthritis in seventeen patients[J].Clin J Immunol,2010,26(7):659-662.
[6] Sun L,Akiyama K,Zhang H,etal.Mesenchymal stem cell transplantation reverses multi-organ dysfunction in systemic lupus erythematosus mice and humans [J].Stem Cells,2010,27:1421-1432.
[7] Ding G,Liu Y,An Y,etal.Suppression of T cell proliferation by root apical papilla stem cells in vitro [J].Cell Tissue Organs,2010,191:357-364.
[8] Brand DD,Latham KA,Rosloniec EF.Collagen-induced arthritis [J].Nature Protocol,2007,2:1269-1275.
[9] Földes A,Kádár K,Kerémi B,etal.Mesenchymal stem cells of dental origin-their potential for anti-inflammatory and regenerative actions in brain and gut damage [J].Curr Neuropharmacol,2016,14:914-934.
[10] Bruna A,Paula AA,Vanessa V,etal.Mesenchymal stem cell therapy and acute graft-versus-host disease:a review [J].Hum Cell,2014,27:137-150.
[11] Wang L,Ting C,Yen M,etal.Human mesenchymal stem cells (MSCs) for treatment towards immune-and inflammation-mediated diseases:review of current clinical trials [J].J Biomed Sci,2016,23:76.
[12] MacDonald GIA,Augello A,De Bari C.Role of mesenchymal stem cells in reestablishing immunologic tolerance in autoimmune rheumatic diseases [J].Arthritis Rheum,2011,63:2547-2557.
[13] Sonoyama W,Liu Y,Yamaza T,etal.Characterization of the apical papilla and its residing stem cells from human immature permanent teeth:a pilot study [J].J Endod,2008,34:166-171.
[14] Augello A,Tasso R,Negrini SM,etal.Cell therapy using allogeneic bone marrow mesenchymal stem cells prevents tissue damage in collagen-induced arthritis [J].Arthritis Rheum,2007,56:1175-1186.
[15] 郭亚春,封桂英,宋鸿儒,等.CIA小鼠血清中IL-27、IL-10、IL-17的动态分析[J].中国免疫学杂志,2015,31(6):803-805.
Guo YC,Feng GY,Song HR,etal.Dynamic changes of IL-27,IL-10,IL-17 in serum of collagen-induced arthritis in mice[J].Chin J Immunol,2015,31(6):803-805.
[16] 冯建华,周晓鸿.Th17在类风湿性关节炎中的研究进展[J].皮肤病与性病,2011,33(6):330-332.
Feng JH,Zhou XH.The research progress of Th17 cells in rheumatoid arthritis[J].J Dermatoivenereol,2011,33(6):330-332.
[17] Chen M,Su W,Lin X,etal.Adoptive transfer of human gingiva-derived mesenchymal stem cells ameliorates collagen induced arthritis via suppression of Th1 and Th17 cells and enhancement of regulatory T cell differentiation [J].Arthritis Rheum,2013,65:1181-1193.
[18] Chen C,Akiyama K,Yamaza T,etal.Telomerase governs immunomodulatory properties of mesenchymal stem cells by regulating FAS ligand expression [J].EMBO Mol Med,2014,6:322-334.
[19] Uccelli A,Prockop DJ.Why should mesenchymal stem cells (MSCs) cure utoimmune diseases? [J].Curr Opin Immunol,2010,22:768-774.
[20] Su J,Chen X,Huang Y,etal.Phylogenetic distinction of iNOS and IDO function in mesenchymal stem cell-mediated immunosuppression in mammalian species [J].Cell Death Differ,2014,21:388-396.

