瘦素预处理的MSC体外调节SLE患者淋巴细胞亚群的初步研究①
陈海凤 邹耀红 孙凌云
(南京医科大学附属无锡人民医院风湿免疫科,无锡 214023)
系统性红斑狼疮(Systemic lupus erythematosus,SLE)是一种自身免疫性疾病,主要表现为自身抗体生成、多器官受累,其发病机制在于T、B淋巴细胞免疫异常,大量自身反应性淋巴细胞浸润及免疫复合物沉积等致靶器官损伤[1]。
间充质干细胞(Mesenchymal stem cell,MSC)是一种非造血、多潜能的祖细胞,可分化成脂肪细胞、成骨细胞、肌细胞等,因其低免疫原性及免疫调节作用,近年来在自身免疫病方面的作用得到了较多关注。大量研究表明MSC移植治疗MRL/lpr鼠或狼疮患者,均可缓解狼疮病情[2]。MSC可抑制T、B淋巴细胞活化增殖及减少抗体生成,如调节性T(Treg)细胞[3]、Th17细胞[4]、滤泡辅助T(Tfh)细胞[5]、B淋巴细胞[6]等。
SLE患者自体骨髓MSC已证实存在异常,表现在迁移、衰老及凋亡等方面,其对免疫细胞的调节作用亦明显受损[2,7-9]。此外,我们前期研究发现SLE血清微环境体外可加剧MSC异常衰老[10],其中异常升高的瘦素起到主导作用[11]。然而瘦素除诱导MSC衰老外,对免疫细胞的调节作用是否受损目前则尚未明确。因此本研究旨在观察瘦素诱导产生的衰老MSC其免疫调节作用是否受到影响,为阐述SLE的发病机制提供新的依据。
1 材料与方法
1.1材料
1.1.1实验试剂 培养基(DMEM/F12、1640)、青/链霉素(Penicillin/Streptomycin)、胎牛血清(FBS)、磷酸盐缓冲液 (PBS)(Gibco公司);人淋巴细胞分离液(天津灏洋生物制品科技有限公司);重组人瘦素(Peprotech公司);流式标记抗体(CD4、CD25、Foxp3、IL-17、CD3、CD69、PD-1、CXCR5、CD19)(BD公司)。
1.1.2实验对象 南京大学医学院附属鼓楼医院风湿免疫科2014年1月至2014年7月收住院的10例女性SLE患者,诊断符合美国风湿病学会1997年修订的SLE分类标准,均处于活动期,SLEDAI评分>6分。收集上述人群的外周血,分离出外周血单个核细胞(Peripheral blood mononuclear cell,PBMC)。脐带组织来自南京大学医学院附属鼓楼医院妇产科健康产妇,无自身免疫病病史或家族史。
1.2方法
1.2.1脐带MSC分离培养 脐带无菌采集后,于保存液中4℃保存,在24 h内处理。无菌状态下,采用无菌器械,分离剥取脐带中的华通氏胶组织,去除静脉及动脉,将胶组织剪成1 mm3的小块接种入T75培养瓶中,采用含10% FBS的DMEM/F12培养基培养,置于温度37℃、5%CO2的温箱中。每3~5 d 换液1次,在倒置显微镜下观察,生长至80%融合时,采用0.25%的胰酶消化处理,收集悬浮细胞,洗涤后,按照1∶3的比例传代接种,扩增,备用。在每次细胞传代时,采用台盼蓝染色计算细胞活力,要求大于95%,细胞冻存后复苏活力大于85%。干细胞纯度:流式细胞仪检测,阳性指标CD73、CD90、CD105表达率>95% ,阴性指标CD14、CD19、CD34、CD45、 HLA-DR表达率<2%。
1.2.2淋巴细胞培养及测定 MSC与PBMC以1∶10 共培养 3 d, 收集PBMC,PBS洗涤一遍,流式细胞仪测定不同的细胞亚群。Treg细胞测定:常温避光标记CD4-FITC,CD25-APC,按照BD公司human Foxp3 buffer set步骤将细胞破膜,标记Foxp3-PE抗体,流式细胞仪检测CD4+CD25+Foxp3+Treg细胞比例。Tfh细胞测定:常温避光标记CD4-FITC、CXCR5-APC、PD-1-PerCP-Cy5.5,流式细胞仪检测CD4+CXCR5+PD-1+Tfh细胞比例。Th17细胞:加入PMA、离子霉素、BFA,在37℃ 5%CO2孵箱共刺激4~6 h,细胞表面标记CD4-FITC,固定、破膜,胞内染色IL-17-APC,流式细胞仪检测CD4+IL-17+Th17细胞比例。B淋巴细胞:常温避光表面标记CD19-PE/Cy5,流式细胞仪检测CD19+B淋巴细胞比例。
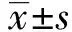
2 结果
2.1瘦素预处理MSC对Treg细胞调节作用的影响 体外以重组人瘦素(100 ng/ml)加入MSC培养基(DMEM/F12+10%FBS)培养3 d,然后弃培养液再与SLE患者PBMC(1∶10)共培养3 d。结果发现脐带MSC上调Treg细胞比例[(8.53±2.33) % vs (5.96±1.22)%,P<0.01],与未处理组相比较,瘦素预处理的MSCs上调Treg细胞的能力下降[(6.79±2.14)% vs (8.53±2.33)%,P<0.01],如图1。通过共培养瘦素预处理的MSC与PBMC,发现瘦素预处理MSC使其上调Treg细胞的能力明显受损。

图1 瘦素预处理MSC前后对Treg细胞调节作用的影响Fig.1 Effects of MSC treated with or without leptin on frequency of Treg cells(±s)Note:**.P<0.01.

图2 瘦素预处理MSC对其调节Th17细胞的影响Fig.2 Effects of MSC treated with or without leptin on frequency of Th17 cellsNote:**.P<0.01.

图3 瘦素预处理MSC对其调节Tfh细胞的影响Fig.3 Effects of MSC treated with or without leptin on frequency of Tfh cellsNote:***.P<0.001;ns.P>0.05.
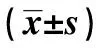
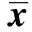

GroupsCD3+TcellCD25MFICD69MFICD19+BcellCD25MFICD69MFIPBMC12 06±4 6212 67±4 7422 43±2 468 56±2 37MSC+PBMC9 63±3 601)11 87±4 1719 16±3 621)9 14±1 34Leptin⁃MSC+PBMC10 67±4 032)12 71±4 292)21 05±2 362)10 09±1 93
Note:PBMC.Peripheral blood monocyte cell;MSC.Mesenchymal stem cell;Leptin-MSC.MSC pretreated with leptin for 3 days;MFI.Median fluorescence intensity.1)P<0.05,compared with PBMC group;2)P<0.05,compared with MSC+PBMC group.
2.2瘦素预处理MSC对Th17细胞及Tfh细胞调节功能的影响 瘦素100 ng/ml预处理MSC 3 d后, 1∶ 10与SLE患者PBMC共培养3 d。结果发现正常脐带来源的MSC可下调Th17细胞[(1.28±0.70)% vs (2.01±0.72)%,P<0.01]、Tfh细胞[(1.48±1.36)% vs (8.80±1.94)%,P<0.001]。而与未处理组相比较,瘦素预处理的MSC对Th17细胞下调作用受到抑制[(1.64±0.55)% vs (1.28±0.70)%,P<0.01],而Tfh细胞比例有增加的趋势[(2.08±1.52)% vs (1.48±1.36)%,P=0.051],但差异无统计学意义,结果如图2、3所示。因此瘦素预处理MSC使其体外作用下调Th17细胞的能力受损,而本研究中对Tfh细胞调节能力改变无统计学差异,可增加样本量进一步明确。
2.3瘦素预处理干扰MSC对SLE患者B淋巴细胞的调节作用 重组人瘦素100 ng/ml加入MSC培养基预处理3 d,弃上清,再以1∶10与PBMC共培养3 d。结果检测可见MSC体外降低SLE患者B细胞比例[(6.78±3.38)% vs (8.40±2.57) %,P<0.05],而瘦素预处理后使得B细胞比例较前部分升高[(7.37±3.56)% vs (6.78±3.38)%,P<0.05]。说明瘦素预处理MSC可损伤其对B细胞的调节作用,但对其亚群(如调节性B细胞、浆细胞等)作用如何仍需进一步研究。
2.4瘦素预处理的MSC对T、B淋巴细胞活性的影响 MSC对免疫细胞的调节作用,除了细胞比例、功能外,还与细胞活性密切相关。本研究瘦素(100 ng/ml)预处理MSC与PBMC(1∶10)共培养3 d,检测CD25、CD69代表T、B淋巴细胞活性。MSC降低CD3+T细胞表面CD25荧光强度[(9.63±3.60) vs (12.06±4.62),P<0.05],而对CD69的表达无明显改变[ (11.87±4.17) vs (12.67±4.74),P>0.05]。与单独MSC组相比,瘦素作用可部分上调MSC对T细胞活化分子CD25、CD69荧光强度[CD25 (10.67±4.03) vs (9.63±3.60),P<0.05;CD69 (12.71±4.29) vs (11.87±4.17),P<0.05]。而在B淋巴细胞活化方面,MSC下调CD19+B细胞表面CD25荧光强度[(19.16±3.62) vs (22.43±2.46),P<0.05],瘦素处理后CD25表达强度较前有增加[(21.05±2.36) vs (19.16±3.62),P<0.05]。瘦素处理前后MSC对B细胞表面CD69的影响差异无统计学意义(P>0.05),见表1。故MSC体外可抑制T、B淋巴细胞活化,而瘦素则一定程度损伤了MSC对免疫细胞活化的调节能力。
3 讨论
SLE是全身性免疫性疾病,表现为免疫细胞过度活化、促炎因子增加,炎症细胞及因子在组织器官浸润,导致多脏器功能受损。目前临床治疗仍以激素、免疫抑制剂治疗为主,近年来CD20单抗、BAFF单抗等靶向药物逐渐应用于临床。
瘦素不仅参与代谢,还参与了免疫及炎症反应,尤其在狼疮疾病方面的作用得到了广泛关注[12]。动物实验发现瘦素可导致狼疮鼠自身抗体的产生、蛋白尿增多、肾脏病理加剧,而中和阻断瘦素则明显延长小鼠存活时间[13],且瘦素缺乏则可增加Treg细胞、降低Th17细胞,并逆转狼疮鼠病情[14,15]。我们亦证实瘦素在狼疮患者及动物模型中显著增高,因此瘦素在狼疮发病及其发生发展过程中的作用值得我们深入探讨。
MSC是一种多潜能细胞,具有多向分化潜能,且表达CD105、CD90、CD73,缺乏造血细胞标记。MSC表达主要组织相容复合物(MHC)Ⅰ类分子,而不表达MHCⅡ类分子及共刺激分子(CD40、CD80、CD86),这决定了MSC的低免疫原性。MSC具备免疫调节作用,其通过可溶性细胞因子或细胞间接触等方式,能够抑制T细胞增殖、DC细胞分化、Treg细胞数量及功能以及B细胞增殖等。临床研究发现骨髓或脐带来源MSC移植治疗SLE患者或狼疮鼠模型能够获得良好的疗效[16]。我们前期研究证实了SLE患者自身骨髓来源MSC多种异常,主要表现为异常衰老、凋亡[8],其对T、B淋巴细胞的免疫调节亦明显受损[9]。此外,SLE患者血清已证实可加剧MSC的衰老,而在此过程中瘦素起至关重要的作用[11]。本研究则在异常升高的瘦素促进MSC细胞衰老的同时,发现其预处理MSC对免疫细胞数量及活化的调控功能亦受明显受损。
国内外研究均表明SLE患者循环Treg细胞减少,Foxp3表达降低,不能有效抑制效应T细胞的增殖及细胞因子分泌[17];而Th17细胞增多,在组织器官聚集浸润,产生大量IL-17,进而导致组织损伤[18];同时,Tfh细胞数量增加,促进B细胞过度活化,生发中心生成及自身抗体的异常增加,从而导致狼疮发病[19]。MSC则可通过细胞间接触及分泌可溶性细胞因子(如吲哚胺2,3双加氧酶、转化生长因子-β、白介素-10、前列腺素E2、肝细胞生长因子、人类白细胞抗原G5、一氧化氮等)的方式,增强Treg细胞免疫抑制功能[20]、抑制Th17细胞[21]及Tfh细胞的促炎作用[22]。而本研究则发现瘦素预处理明显损伤MSC对Treg细胞、Tfh细胞的免疫调控作用。瘦素作用的MSC对Tfh细胞抑制作用受到一定程度影响,但差异无明显统计学意义,可能与研究例数偏少有关,可增加样本量进一步探讨。
B淋巴细胞在SLE疾病发生发展中的作用尤其关键,主要表现为异常活化及产生自身抗体异常增多[23]。本研究发现MSC可下调B淋巴细胞比例、抑制其免疫活性,瘦素作用后MSC调节B细胞、抑制其活化等能力均减弱。与此同时,国内研究者亦发现SLE血浆培养条件可负性调控MSC对B细胞比例、增殖、成熟的抑制作用[24]。虽然Crop等提出某些炎症细胞因子可增强MSC免疫抑制功能,如干扰素-γ、肿瘤坏死因子-α、白介素-1a/b等[25],这可能导致上述促炎因子靶向阻断后狼疮鼠自体骨髓MSC功能受损,进而影响疗效;然而体外如以上述因子预处理MSC,再输注治疗狼疮可能一定程度上增强其免疫抑制作用。本研究首次发现瘦素在体外环境中作用可损伤MSC对免疫细胞的调控能力,此外,瘦素已有报道可直接作用于多种免疫细胞促进其免疫活化,因此我们认为靶向阻断瘦素可能成为SLE患者潜在的有效治疗方法,然而其疗效及安全性如何、对B细胞抗体分泌及调节性B细胞作用、相关信号及分子机制等有待进一步研究阐明。
综上,瘦素不仅促进MSC细胞衰老,还损伤其对免疫细胞的调控作用,故瘦素可能通过加剧MSC衰老、损伤其免疫调节功能而加重狼疮病情,为阐明SLE发病机制及可能的治疗靶点提供新的理论依据。
[1] Tsokos GC.Systemic lupus erythematosus [J].N Engl J Med,2011,365(22):2110-2121.
[2] Sun L,Akiyama K,Zhang H,etal.Mesenchymal stem cell transplantation reverses multiorgan dysfunction in systemic lupus erythematosus mice and humans [J].Stem Cells,2009,27(6):1421-1432.
[3] Liu Y,Yang R,Shi S.Systemic infusion of mesenchymal stem cells improves cell-based bone regeneration via upregulation of regulatory T cells [J].Tissue Eng Part A,2015,21(3-4):498-509.
[4] Ghannam S,Pene J,Moquet-Torcy G,etal.Mesenchymal stem cells inhibit human Th17 cell differentiation and function and induce a T regulatory cell phenotype [J].J Immunol,2010,185(1):302-312.
[5] Yang X,Yang J,Li X,etal.Bone marrow-derived mesenchymal stem cells inhibit T follicular helper cell in lupus-prone mice [J].Lupus,2018,37(1):49-59.
[6] Cho KA,Lee JK,Kim YH,etal.Mesenchymal stem cells ameliorate B-cell-mediated immune responses and increase IL-10-expressing regulatory B cells in an EBI3-dependent manner [J].Cell Mol Immunol ,2017,13:1-4.
[7] Sun LY,Zhang HY,Feng XB,etal.Abnormality of bone marrow-derived mesenchymal stem cells in patients with systemic lupus erythematosus [J].Lupus,2007,16(2):121-128.
[8] Li X,Liu L,Meng D,etal.Enhanced apoptosis and senescence of bone-marrow-derived mesenchymal stem cells in patients with systemic lupus erythematosus [J].Stem Cells Dev,2012,21(13):2387-2394.
[9] Che N,Li X,Zhang L,etal.Impaired B cell inhibition by lupus bone marrow mesenchymal stem cells is caused by reduced CCL2 expression [J].J Immunol,2014,193(10):5306-5314.
[10] Yao J Y,Chao K,Li M R,etal.Expression and significance of IL-21 in patients infected with hepatitis B virus at different stages[J].J Pract Med,31(7):1061-1064.
[11] Chen H,Shi B,Feng X,etal.Leptin and neutrophil-activating peptide 2 promote mesenchymal stem cell senescence through activation of the phosphatidylinositol 3-kinase/akt pathway in patients with systemic lupus erythematosus [J].Arthritis Rheumatol,2015,67(9):2383-2393.
[12] Xu WD,Zhang M,Zhang YJ,etal.Association between leptin and systemic lupus erythematosus [J].Rheumatol Int,2014,34(4):559-563.
[13] Lourenco EV,Liu A,Matarese G,etal.Leptin promotes systemic lupus erythematosus by increasing autoantibody production and inhibiting immune regulation [J].Proc Natl Acad Sci U S A,2016,113(38):10637-10642.
[14] Liu Y,Yu Y,Matarese G,etal.Cutting edge:fasting-induced hypoleptinemia expands functional regulatory T cells in systemic lupus erythematosus [J].J Immunol,2012,188(5):2070-2073.
[15] Yu Y,Liu Y,Shi FD,etal.Cutting edge:Leptin-induced RORgammat expression in CD4+T cells promotes Th17 responses in systemic lupus erythematosus [J].J Immunol,2013,190(7):3054-3058.
[16] Cras A,Farge D,Carmoi T,etal.Update on mesenchymal stem cell-based therapy in lupus and scleroderma [J].Arthritis Res Ther,2015,17:301.
[17] Valencia X,Yarboro C,Illei G,etal.Deficient CD4+CD25highT regulatory cell function in patients with active systemic lupus erythematosus [J].J Immunol,2007,178(4):2579-2588.
[18] Alunno A,Bartoloni E,Bistoni O,etal.Balance between regulatory T and Th17 cells in systemic lupus erythematosus:the old and the new [J].Clin Dev Immunol,2012,2012:823085.
[19] Blanco P,Ueno H,Schmitt N.T follicular helper (Tfh) cells in lupus:Activation and involvement in SLE pathogenesis [J].Eur J Immunol,2016,46(2):281-290.
[20] Engela AU,Baan CC,Dor FJ,etal.On the interactions between mesenchymal stem cells and regulatory T cells for immunomodulation in transplantation [J].Front Immunol,2012,3:126.
[21] Sun Y,Deng W,Geng L,etal.Mesenchymal stem cells from patients with rheumatoid arthritis display impaired function in inhibiting Th17 cells [J].J Immunol Res,2015,2015:284215.
[22] Liu R,Li X,Zhang Z,et al:Allogeneic mesenchymal stem cells inhibited T follicular helper cell generation in rheumatoid arthritis [J].Sci Rep,2015,5:12777.
[23] Anolik JH.B cell biology:implications for treatment of systemic lupus erythematosus [J].Lupus,2013,22(4):342-349.
[24] 聂瑛洁,罗利梅,査 艳,等.系统性红斑狼疮患者血浆降低间充质干细胞对B淋巴细胞的抑制作用 [J].南方医科大学学报,2016,36(8):1090-1093.
Nie YJ,Luo LM,Zha Y,etal.Plasma from patients with systemic lupus erythematosus inhibits suppressive activity of mesenchymal stem cells against lupus B lymphocytes[J].J South Med Univ,2016,36(8):1090-1093.
[25] Crop MJ,Baan CC,Korevaar SS,etal.Inflammatory conditions affect gene expression and function of human adipose tissue-derived mesenchymal stem cells[J].Clin Exp Immunol,2010,162(3):474-486.

