脑膜瘤组织中白血病相关蛋白16基因的表达变化及意义
任贺成,马晓东
(1天津市环湖医院,天津300350;2解放军总医院)
白血病相关蛋白16(LRP-16)基因是近年发现的一种新的雌激素反应基因,最早发现于白血病的相关研究中。基因表达序列分析(SAGE)谱分析发现LRP-16在增殖活跃的雌激素相关正常组织(如睾丸、卵巢等)中高表达[1]。后续研究发现在雌激素相关肿瘤组织中,如乳腺癌、宫颈癌、子宫内膜癌、胃癌、结肠癌、前列腺癌、肺癌等,LRP-16多呈高表达,并与肿瘤的恶性生物学行为及不良预后有关[1~13]。脑膜瘤是最常见的颅内肿瘤之一,起源于蛛网膜颗粒的脑膜上皮细胞。脑膜瘤大多数为良性(WHOⅠ级);不典型脑膜瘤(WHO Ⅱ级)占所有脑膜瘤的3%~7%;恶性脑膜瘤(WHO Ⅲ级)更少,占所有脑膜瘤的1%~3%。既往研究发现,性激素与脑膜瘤密切相关。研究发现性激素可促进体外培养的脑膜瘤细胞生长增殖,其中雌激素作用最明显;脑膜瘤患者血浆性激素水平也多异于正常。与孕激素(75%)、雄激素(63%)相比,虽然雌激素受体(ER)在脑膜瘤组织中的表达率不高(22%),但ER的表达与恶性脑膜瘤的不良预后相关[13]。与雌激素相关的LRP-16在脑膜瘤组织中的表达情况尚不明确。本研究旨在初步探讨LRP-16在脑膜瘤组织中的表达情况及其意义,为脑膜瘤发病机制及治疗研究提供一个新思路。
1 资料与方法
1.1 临床资料 2006年10月~2007年5月解放军总医院神经外科经手术治疗并经病理证实的脑膜瘤患者42例(实验组),其中男9例、女33例,年龄21~70(49.26±10.8)岁。病理分级:WHO Ⅰ级34例,WHO Ⅱ级3例,WHO Ⅲ级5例。按病理分级分为良性组34例,非良性组8例。以高颅压症状起病者25例,以局部功能障碍起病者17例;病程(7.5±2.3)个月。纳入标准:病理诊断为脑膜瘤患者;首次手术患者;年龄18~70岁。排除标准:复发后再次手术及术前行放、化疗者;术中电凝灼烧的患者;合并肿瘤性综合征的患者(如神经纤维瘤病)。脑外伤急症手术患者32例(对照组),男8例、女24例,年龄19~60(48.35±11.2)岁。纳入标准:闭合性颅脑损伤并行硬膜扩大修补手术患者;年龄18~70岁。排除标准:开放性颅脑损伤,合并脑膜疾病(如脑膜炎)或颅内肿瘤者。两组患者的年龄和性别有可比性。均取得患者及家属同意,并签署知情同意书。术中取实验组脑膜瘤组织及对照组正常脑膜组织,标本取下后,分两份,一份液氮保存供核酸与蛋白质抽提,另一份甲醛固定,切片蜡封供免疫组化检测。
1.2 组织雄激素受体(AR)、ER、孕激素受体(PR)及增殖细胞核抗原(PCNA)的检测 采用免疫组化SP法。石蜡切片脱蜡、水化、冲洗,修复;切片加过氧化酶阻断溶液(50 μL),室温下孵育(10 min),冲洗;加正常非免疫动物血清(50 μL),孵育(室温10 min);除去血清,加一抗(1∶50倍稀释,50 μL),4 ℃过夜; PBS冲洗,加生物素标记的二抗,室温下孵育10 min,冲洗;加链霉素抗生物素-过氧化酶溶液,孵育,冲洗;加新鲜配制的DAB溶液,显微镜下观察;苏木素复染,冲洗返蓝;经过梯度乙醇脱水干燥,二甲苯透明,中性树胶封片,显微镜下观察结果。以细胞内有棕黄色颗粒者为阳性细胞。显微镜(×400)下随机选4个视野,计算阳性细胞个数,取平均值。AR、ER、PR染色中阳性细胞数>10%记为阳性标本,统计阳性标本的个数用以统计学分析; 计算PCNA阳性细胞占肿瘤细胞的比例(PCNA-LI),用以表示脑膜瘤细胞的增殖活性。
1.3 组织LRP-16蛋白的检测 采用Western blotting法。主要步骤包括①组织总蛋白的提取:裂解液在4 ℃下12 000 r/min离心20 min,取上清再在4 ℃下12 000 r/min离心20 min。②样品蛋白含量的测定:标准品以0 μg调零在分光光度计上OD595比色,以测得的OD值为横坐标,对应的蛋白浓度为纵坐标制成标准曲线;样品在分光光度计上OD595比色,以测得的OD值计算蛋白浓度。③SDS-聚丙烯酰胺凝胶电泳:灌胶时,沿玻璃加入,分离胶的高度到玻璃板的2/3即可。上样时样品浓度与对照浓度相等,用微量进样器贴壁吸取样品,将样品吸出不要吸进气泡。电泳时电泳仪电压调至100 V,当染料溴酚兰进入分离胶后,将电压调高到130 V,继续电泳使溴酚兰至玻璃板下沿。④转膜。⑤封闭、抗体孵育及曝光:按说明书加入一抗、二抗。扫描结果保存为图片文件,用Image J软件测量LRP-16和内参 (β-actin)显影条带的灰度值,以二者灰度值比(LRP-16/β-actin)作为样本中LRP-16的相对表达水平。
1.4 组织LRP-16 mRNA的检测 采用RT-PCR法。主要步骤包括:①RNA抽提和纯化:RNA的浓度=OD260×稀释倍数×0.04 μg/μL,OD260/280 在1.8~2.1视为抽提的RNA的纯度很高。②逆转录反应:反应体系100 mL(上述RNA溶液38.5 mL,10×RT buffer 10 mL,MgCl2(25 mmol/L) 22 mL,dNTP mixture(2.5 mmol/L) 20 mL,random hexamers(50 mmol/L) 5 mL,Rnase抑制剂(20 U/mL) 2 mL,逆转录酶(50 U/mL) 2.5 mL。反应程序:25 ℃ 10 min,42 ℃ 45 min,95 ℃ 5 min,4 ℃保存。③引物设计和合成:以GAPDH的值校正特异扩增基因的量,各基因扩增所用的引物序列如下:LRP-16-165 F:5′-GCGGACCTCGGCGGGAGTTGG-3′;LRP-16-903 R:5′-CAGCCGGTCCACCTTGTCCTTGT-3′;GAPDH F:5′-GAAGGTGAAGGTCGGAGT-3′;GAPDH R:5′-GAAGATGGTGATGGGATTTC-3′。④荧光实时定量PCR反应体系和反应条件:SYBR®Green PCR Master Mix 12.5 μL,1 mmol/L正向、反向引物各2.5 μL,模板(RT产物1∶5稀释)2.0 μL,H2O 5.25 μL,总体积为25.0 μL;以NTC、NRTC为阴性对照。反应条件:95 ℃ 8.5 min,95 ℃ 15 s,60 ℃ 1 min,60~95 ℃ 20 min。⑤将不同浓度定量模板的对数和相应CT值作图,做标准曲线。用已知不同浓度的RNA反转录成cDNA制作标准曲线。浓度分别为10、20、30、40 ng/μL。以目的基因与GAPDH的比值(LRP-16/GAPDH)表示LRP-16 mRNA的相对表达量。
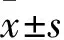
2 结果
2.1 两组LRP-16、AR、ER、PR、PCNA表达比较 实验组LRP-16灰度值为0.729±0.249,高于对照组(0.015±0.005)(P<0.01)。实验组LRP-16 mRNA的相对表达量为0.205±0.134,高于对照组(0.003±0.001)(P<0.01)。实验组PR阳性率为69.0%(29/42),PCNA-LI为88.1%(37/42),对照组未检测到PR和PCNA阳性标本。所有标本未检测到AR、ER染色。
2.2 脑膜瘤组织LRP-16 mRNA表达与患者PR、PCNA及WHO病理分级的关系 良性组LRP-16 mRNA的相对表达量为0.169±0.081,非良性组为0.361±0.200,两者比较,P<0.05。PR阳性患者及PR阴性患者LRP-16 mRNA相对表达量分别为0.216 ± 0.142、0.180 ± 0.115,差异无统计学意义(P>0.05)。实验组LRP-16 mRNA与PCNA-LI呈正相关(rs=0.769,P<0.01)。因所有标本未检测到AR、ER染色,LRP-16表达与AR、ER的相关关系未行探讨。
3 讨论
LRP-16基因是一种新的人类基因,1999年发现于白血病的相关研究中,故得名“白血病相关蛋白”。该基因定位于染色体11q12.1,含外显子11个,转录本长1 225 bp,编码325个氨基酸,翻译产物是一种核蛋白,属于macro domain家族。SAGE谱分析发现在各种人类细胞内LRP-16均有表达,增殖活跃的组织(睾丸、卵巢等)或肿瘤细胞中,该基因呈高表达[1]。LRP-16是一种雌激素反应基因,雌激素、雄激素可以上调其表达水平。
研究发现,LRP-16过表达可以促进乳腺癌MCF-7细胞增殖,抑制LRP-16表达可限制MCF-7细胞的增殖;同时LRP-16与MCF-7细胞的体外黏附、侵袭与迁移能力有关[11]。对人乳腺癌研究也发现,LRP-16 mRNA的表达量与乳腺癌直径呈正相关,同时LRP-16 mRNA与乳腺癌的临床分期、淋巴结转移等有关[4,9]。对于子宫内膜癌Ishikawa细胞,LRP-16过表达能提高其体外侵袭能力,可能通过下调E-钙黏着素起作用[12]。对于浆液性卵巢肿瘤的研究提示,LRP-16在卵巢癌中的表达高于交界性肿瘤,并与其临床分期呈正相关[2,5]。对于前列腺癌,LRP-16过表达能够促进前列腺癌DU145细胞的生长。LRP-16基因的表达与非小细胞肺癌的分化程度有关[10]。临床病理研究发现,LRP-16与肺部神经内分泌肿瘤的分型、临床分期和患者生存期有关[3]。对于消化系统恶性肿瘤,LRP-16在胃癌、结肠癌中均呈高表达,并与肿瘤的临床病理分期、大小、浸润深度、淋巴结转移和远处转移相关,过表达LRP-16提示不良预后[6,7]。
脑膜瘤是最常见颅内肿瘤之一,起源于蛛网膜颗粒的脑膜上皮细胞。虽然大多数为良性,但恶性者并不罕见。脑膜瘤与性激素密切相关。女性脑膜瘤患者多于男性,绝经期前后女性性激素变化,此时期是女性脑膜瘤的高发年龄。脑膜瘤常于妊娠期而生长加速,可能与妊娠期性激素增加有关。脑膜瘤可并发于其他性激素相关肿瘤,如乳腺癌。本研究结果显示,实验组LRP-16基因在mRNA及蛋白水平的表达均高于对照组;并且LRP-16 mRNA在非良性脑膜瘤中的表达高于良性肿瘤。提示LRP-16基因可能与脑膜瘤的发生发展有关,且可能与恶性的脑膜瘤关系更为密切。PCNA-LI是评价细胞增殖活性的良好指标。本研究显示LRP-16 mRNA在脑膜瘤中的表达与PCNA-LI呈正相关,提示LRP-16表达与脑膜瘤的细胞增殖呈正相关关系。这些结果与既往研究发现的LRP-16与性激素肿瘤相关、并与肿瘤的恶性生物学行为相关的特点相符合。虽然本研究显示PR阳性组脑膜瘤组织中的LRP-16 mRNA表达高于PR阴性组,但这一发现并无统计学意义。遗憾的是本文脑膜瘤标本中AR、ER均为阴性。阴性结果可能与下列因素有关:既往研究提示AR、ER在脑膜瘤组织中阳性率不高,ER与恶性脑膜瘤有关,而本组脑膜瘤例数较少,恶性脑膜瘤更少;实验试剂、实验方法和技术经验方面的因素造成假阴性结果。
总之,本研究结果提示,脑膜瘤组织中LRP-16基因的表达升高,LRP-16的表达与脑膜瘤的细胞增殖和病理分级有关。然而本研究仍有许多不足之处,如研究对象例数较少,实验设计简单等。LRP-16与脑膜瘤的关系有待于进一步深入研究。
参考文献:
[1] 邵云,赵坡.LRP16及与肿瘤的关系研究进展[J].诊断病理学杂志,2017,24(8):618-621.
[2] 田丽媛,赵亚力,韩为东,等.卵巢上皮肿瘤中LRP16蛋白表达的意义及其与ER、PR、E-cadherin的关系[J].现代肿瘤医学,2008,16(4):629-632.
[3] Shao Y, Li X, Lu Y, et al. Aberrant LRP16 protein expression in primary neuroendocrine lung tumors[J]. Int J Clin Exp Pathol, 2015,8(6):6560-6565.
[4] Yao DJ, Qiao S, Zhang Y, et al. Correlation between expression of LRP16, Ki67 and EGFR and breast cancer clinical pathologic factors and prognosis[J]. Eur Rev Med Pharmacol Sci, 2017,21(3 Suppl):47-51.
[5] Tian L, Wu Z, Zhao Y, et al. Differential induction of LRP16 by liganded and unliganded estrogen receptor alpha in SKOV3 ovarian carcinoma cells[J]. J Endocrinol, 2009,202(1):167-177.
[6] Xi HQ, Zhao P, Han WD. Clinicopathological significance and prognostic value of LRP16 expression in colorectal carcinoma[J]. World J Gastroenterol, 2010,16(13):1644-1648.
[7] Li YZ, Zhao P, Han WD. Clinicopathological significance of LRP16 protein in 336 gastric carcinoma patients[J]. World J Gastroenterol, 2009,15(38):4833-4837.
[8] 廖代祥,韩为东,赵亚力,等.LRP16基因在乳腺癌组织中的表达及其临床意义[J].癌症,2006,25(7):866-870.
[9] 汪保安,吕朝晖,母义明.高表达LRP16基因对前列腺癌细胞生物学行为的影响[J].中国现代医学杂志,2007,17(23):2832-2834.
[10] 孙晓雁,王英禹,张志培,等.非小细胞肺癌患者LRP16表达与其临床病理特征相关性的研究[J].临床肿瘤学杂志,2007,12(3):198-200.
[11] 韩为东,孟元光,廖代祥,等.LRP16通过调控E-钙黏着蛋白的表达促进MCF-7细胞的侵袭生长[J].中国生物化学与分子生物学报,2006,22(9):724-732.
[12] 孟元光,韩为东,黄柯,等.雌激素调控子宫内膜癌Ishikawa细胞中LRP16基因表达及其意义[J].第四军医大学学报,2006,27(11):980-983.
[13] 于丹,伍志强,梅倩,等.宫颈癌组织中 LRP16和 CIAP2的表达及其意义[J].现代肿瘤医学,2015,23(5):678-681.

