剪切波弹性成像技术对甲状腺微小乳头状癌的诊断价值
李拓,刘玉森,李夏,武中林
(1南阳医学高等专科学校第一附属医院,河南南阳473000;2河北医科大学第四医院)
甲状腺肿瘤是临床常见病,较大的肿块可通过触诊或超声检查发现,且根据肿块的超声特征可初步判断肿块的良恶性,但临床上对于体积较小的甲状腺微小乳头状癌却存在较高的漏诊率。微小乳头状癌是指最大径小于10 mm的甲状腺乳头状癌,其发病率和病死率呈逐年上升趋势[1],确诊甲状腺微小乳头状癌的金标准为病理诊断[2]。由于甲状腺微小乳头状癌体积较小,生长位置深,且易受周围正常组织、血流等因素的影响,因此触诊和常规超声很难检出甲状腺微小乳头状癌,且鉴别微小结节良恶性的敏感性和特异性不足。剪切波弹性成像技术是一种新兴的超声检测技术[3],可定量检测并记录皮下组织的弹性杨氏模量值(ME),对甲状腺微小结节的筛查及良恶性的鉴别诊断具有一定的价值[4],该技术在诊断甲状腺癌、肝癌[5]、乳腺癌[6]等方面均取得一定成果,但关于其在甲状腺微小乳头状癌方面的诊断价值还需要大量的研究证实。本研究以直径≤10 mm的微小甲状腺结节患者为观察对象,通过对比患者的甲状腺影像报告和数据系统(TI-RADS)、剪切波弹性成像技术及病理检查结果,来分析剪切波弹性成像技术诊断甲状腺微小乳头状癌的价值。
1 资料与方法
1.1 临床资料 选取2014年2月~2016年2月南阳医学高等专科学校第一附属医院收治的甲状腺结节患者125例,男47例、女78例,年龄20~81(48.75±6.72)岁。纳入标准:甲状腺结节最大径≤10 mm;超声检查下实性甲状腺结节表现为形状不规则,边缘不清,低回声,微钙化等特征。排除标准:结节最大径>10 mm者;伴有严重心肝肾功能不全或严重感染者;伴有免疫系统疾病或活动性出血等疾病者;孕产妇。本研究经本院伦理委员会批准,入选研究对象及家属均知情并签署同意书。
1.2 超声检查 嘱受试者采取仰卧位,暴露颈部,颈后置一枕头,保持颈部略微前伸。使用法国声科AXPLORER彩色超声仪对颈前甲状腺区域行常规超声检查,记录结节的位置、大小、纵横比值、回声、钙化、边界及边缘等情况,根据TI-RADS甲状腺影像报告和数据系统分级标准对结节进行分级。TI-RADS分级[7]:根据常规超声特征将结节分成1~5级。1级:正常或弥漫性增生的甲状腺组织;2级:恶性可能为0的甲状腺结节;3级:恶性可能<5%的甲状腺结节;4a级:恶性可能为5%~10%的甲状腺结节;4b级:恶性可能为>10%~80%的甲状腺结节;5级:恶性可能>80%的甲状腺结节。1~4a级为良性可能结节,4b~5级为恶性可能结节。
1.3 剪切波弹性成像检查 将超声切换到剪切波弹性成像技术模式,对甲状腺结节的ME进行测定。检测过程中探头尽可能轻地置于病变部位,以减少压缩伪影。图像采集过程中嘱受试者屏气几秒钟,以保持探头静止,减小对结果的影响。在记录一个稳定图像后,选择一个覆盖病变和部分正常甲状腺实质的区域来计算ME。记录病变部位与周围组织的最大、平均和最小ME(MEmax、MEmean、MEmin)值。每个区域测量3次计算其平均值为最终值。
1.4 病理检查 超声检测下行细针穿刺取结节组织进行病理检查。经过固定、脱水、浸腊、包埋、切片、封片等过程,将所收集的组织制作成病理切片,由两名以上的病理医师对所取组织的病理性质进行诊断。收集所有受试者的病理检查结果。根据受试者的病理切片中有无肿瘤细胞作为诊断依据,将所观察的甲状腺结节分为良性结节组和恶性结节组。
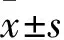
2 结果
2.1 甲状腺结节的病理分类 共检出甲状腺结节148个。病理诊断结果显示,良性结节占31.08%(46/148),其中结节性甲状腺肿12.84%(19/148)、腺瘤11.49%(17/148)、嗜酸性肉芽肿4.73%(7/148)、乔本结节2.03%(3/148);恶性甲状腺结节占68.92%(102/148),其中甲状腺乳头状癌占68.24%(101/148),甲状腺滤泡状癌占0.68%(1/148)。
2.2 两组甲状腺结节常规超声TI-RADS分级及剪切波弹性成像技术检测结果比较 良性结节组TI-RADS 1~4a级39例、TI-RADS 4b~5级7例,MEmean(32.05±21.01)kPa、MEmin(16.77±5.83)kPa、MEmax(51.53±11.41)kPa;恶性结节组分别为TI-RADS 1~4a级16例、TI-RADS 4b~5级86例,MEmean(51.73±12.83)kPa、MEmin(27.32±8.56)kPa、MEmax(68.66±17.06)kPa。良性结节组多为TI-RADS 1~4a级,而恶性结节组多为TI-RADS 4b~5级,两组比较,χ2=64.82,P<0.05。良性结节组与恶性结节组MEmean、MEmin、MEmax比较,t分别为-7.009、-7.595、-6.207,P均<0.05。
2.3 剪切波弹性成像技术诊断甲状腺微小乳头状癌的价值 见图1。MEmean、MEmin、MEmax预测微小乳头状癌的ROC曲线最佳切点分别为39.72 kPa、16.45 kPa及66.07 kPa,其对应的敏感性和特异性分别为86.27%、78.26%,96.08%、63.04%,57.84%、93.48%。
2.4 常规超声TI-RADS分级、剪切波弹性成像技术及两者联合诊断甲状腺微小乳头状癌的价值 常规超声TI-RADS分级、剪切波弹性成像技术及常规超声TI-RADS分级联合剪切波弹性成像技术诊断甲状腺微小乳头状癌的敏感性和特异性为84.31%、84.78%,86.27%、78.26%,92.16%、91.30%。常规超声TI-RADS分级联合剪切波弹性成像技术诊断甲状腺微小乳头状癌的敏感性和特异性均高于单用常规超声或剪切波弹性成像技术(P均<0.05)。
3 讨论
甲状腺微小乳头状癌具有早期表现不明显、恶性程度高和高侵袭性等特点[9],由于其直径较小,且易发生于甲状腺内部及后部,所以单靠触诊很难发现。目前临床诊断甲状腺结节主要靠常规超声检查[10],常规超声通过观察结节的低回声、边缘、纵横比、晕轮征、钙化及血管指数等来对结节进行分级,初步判断甲状腺结节的性质[11]。但甲状腺微小乳头状癌易受周围组织、血流及按压变形等影响,因此常规超声在检测甲状腺微小乳头状癌方面存在一定局限性[12]。寻找高灵敏度的检测技术,努力做到早发现、早治疗,对控制甲状腺微小乳头状癌的临床发展具有非常重要的意义[13,14]。剪切波弹性成像技术可定量地检测皮下组织的ME值[15],其结果更加客观、精确,在早期鉴别密度不同的良恶性结节方面可提供一定的辅助作用[16]。
Fukuhara等[4]研究提出,与正常组织及良性结节相比,甲状腺恶性结节由较多的纤维组织、实质细胞及脂肪组织组成,因此甲状腺恶性结节的ME值更高。本研究分析了剪切波弹性成像技术检测甲状腺良恶性结节的ME,发现恶性结节MEmean、MEmin、MEmax值均高于良性结节。提示甲状腺恶性结节的硬度增强,与Kim等[17]得出的甲状腺乳头状癌结节的MEmean值明显高于良性结节的结果相似。绘制ME值诊断甲状腺微小乳头状癌的ROC曲线,得出MEmean、MEmin、MEmax对微小乳头状癌均有一定的诊断价值,最佳切断点分别为39.72、16.45、66.07 kPa。比较常规超声、剪切波弹性成像技术及常规超声联合剪切波弹性成像技术诊断甲状腺微小乳头状癌的敏感性和特异性,结果为常规超声联合剪切波弹性成像技术诊断甲状腺微小乳头状癌的敏感性和特异性均高于单用常规超声或剪切波弹性成像技术,与Lin[16]及Liu等[3]研究提出的联合剪切波弹性成像技术检查有助于鉴别甲状腺良恶性结节的结论相似。此外,剪切波弹性成像技术诊断甲状腺微小乳头状癌的敏感性为86.27%与TI-RADS分级的84.31%相似,但其特异性78.26%低于TI-RADS分级的84.78%,提示剪切波弹性成像技术诊断可作为辅助诊断,提高常规超声对甲状腺微小乳头状癌的检出率。
本研究样本量较小,细针穿刺或手术取材过程存在一定的局限性,且只选取了微小乳头状癌为研究对象,只能初步推测剪切波弹性成像技术在预测甲状腺微小乳头状癌方面的价值。剪切波弹性成像技术具有客观、稳定、重复率高的特点,因此将其与原有的检测技术相结合则能更加准确、全面地测定甲状腺结节的性状,对早期识别并正确评价甲状腺结节的性质及预后具有重要意义。
综上所述,本研究结果提示,剪切波弹性成像技术能定量评估甲状腺结节的硬度,且能辅助提高常规超声对甲状腺微小乳头状癌的检出率。为进一步研究其诊断甲状腺微小乳头状癌的价值,开发其在甲状腺微小乳头状癌筛查方面的应用提供了理论依据。
参考文献:
[1] 孙荣华,潘先均,苏新良,等.甲状腺乳头状癌颈部淋巴结转移特点及清扫策略[J].中国癌症杂志,2016,26(1):80-87.
[2] 赵蕾,翟贺宁,王存川.甲状腺微小乳头状癌的术中冰冻病理诊断分析[J].深圳中西医结合杂志,2017,25(13):326-330.
[3] Liu B, Liang J, Zheng Y, et al. Two-dimensional shear wave elastography as promising diagnostic tool for predicting malignant thyroid nodules: a prospective single-centre experience[J]. Eur Radiol, 2015,25(3):624-634.
[4] Fukuhara T, Matsuda E, Endo Y, et al. Correlation between quantitative shear wave elastography and pathologic structures of thyroid lesions [J]. Ultrasound Med Biol, 2015,41(9):2326-2332.
[5] Honjo M, Moriyasu F, Sugimoto K, et al. Relationship between the liver tissue shear modulus and histopathologic findings analyzed by intraoperative shear wave elastography and digital microscopically assisted morphometry in patients with hepatocellular carcinoma [J]. J Ultrasound Med, 2014,33(1):61-71.
[6] Athanasiou A, Latorre-Ossa H, Criton A, et al. Feasibility of imaging and treatment monitoring of breast lesions with three-dimensional shear wave elastography[J]. Ultraschall Med, 2017,38(1):51-59.
[7] Horvath E, Majlis S, Rossi R, et al. An ultrasonogram reporting system for thyroid nodules stratifying cancer risk for clinical management[J]. J Clin Endocrinol Metab, 2009,94(5):1748-1751.
[8] 芦雪娇,张艳华,刘莹,等.TI-RADS 分级联合剪切波弹性成像对甲状腺微小癌的诊断价值[J].临床耳鼻咽喉头颈外科杂志,2016,30(2):118-122.
[9] Heller KS. Malignancy rate in thyroid nodules classified as Bethesda category Ⅲ (AUS/FLUS): is there a correct answer[J]. Thyroid, 2014,24(5):787-788.
[10] Zhang XL, Qian LX. Ultrasonic features of papillary thyroid microcarcinoma and non-microcarcinoma [J]. Exp Ther Med, 2014,8(4):1335-1339.
[11] Reddy A, Mayilvaganan S. Natural history of asymptomatic papillary thyroid microcarcinoma: time-dependent changes in calcification and vascularity during active surveillance[J]. World J Surg, 2016,40(11):2820.
[12] Mehanna H, Al-Maqbili T, Carter B, et al. Differences in the recurrence and mortality outcomes rates of incidental and nonincidental papillary thyroid microcarcinoma: a systematic review and meta-analysis of 21 329 person-years of follow-up[J]. J Clin Endocrinol Metab, 2014,99(8):2834-2843.
[13] Oda H, Miyauchi A, Ito Y, et al. Incidences of unfavorable events in the management of low-risk papillary microcarcinoma of the thyroid by active surveillance versus immediate surgery [J]. Thyroid, 2016,26(1):150-155.
[14] 张艳,罗渝昆,张明博,等.对比增强超声与常规超声在判断甲状腺乳头状癌颈部淋巴转移中的意义[J].中国医学科学院学报,2017,39(2):177-182.
[15] Liu BX, Xie XY, Liang JY, et al. Shear wave elastography versus real-time elastography on evaluation thyroid nodules: a preliminary study [J]. Eur J Radiol, 2014,83(7):1135-1143.
[16] Lin P, Chen M, Liu B, et al. Diagnostic performance of shear wave elastography in the identification of malignant thyroid nodules: a meta-analysis [J]. Eur Radiol, 2014,24(11):2729-2738.
[17] Kim H, Kim JA, Son EJ, et al. Quantitative assessment of shear-wave ultrasound elastography in thyroid nodules: diagnostic performance for predicting malignancy[J]. Eur Radiol, 2013,23(9):2532-2537.

