超声处理大豆分离蛋白与肌原纤维蛋白共混体系乳化性及凝胶性研究
江连洲,张潇元,潘 悦,李 杨,齐宝坤,綦欣玉,魏嘉禹,王莉涵,王中江
(东北农业大学食品学院,哈尔滨 150030)
大豆分离蛋白(SPI)是一种营养丰富的植物蛋白,其具有的良好功能特性使大豆蛋白在食品工业中得到了广泛的发展与应用[1]。肌原纤维蛋白(Myofibrillar protein,MP)是由多种蛋白形成的复合体,包括肌球蛋白、肌动蛋白、肌动球蛋白和调节蛋白等。近几年来,随着大豆蛋白经济价值与功能特性研究的不断深入,以及消费者对肉制品健康需求的增加,大豆分离蛋白已广泛应用于肉制品中。然而,由于低变性SPI的变性温度通常比低温肉制品常规加热温度低,极大阻碍了SPI与MP之间的交互作用,导致SPI对MP乳化性与凝胶性的积极作用不明显。因此,国内外学者开始研究改性后SPI对MP功能性质的影响,发现经过改性的SPI可以不同程度提高MP的功能性质。Feng等[2-4]曾报道经热处理后的SPI能够显著提高肌纤维蛋白凝胶的弹性和强度,但未经加热的天然SPI对肉凝胶没有较大贡献。欧阳艳华等[5]研究了经酶改性的SPI与鸡肉MP复配后的乳化性和凝胶性,结果表明,混合蛋白的凝胶性和乳化性明显改善。
本文系统探讨了经不同超声处理的SPI与MP复合体系的乳化性、流变特征及热诱导凝胶的质构性、持水性和作用力,并对其微观结构进行观察。其目的在于讨论经过怎样处理的大豆分离蛋白有利于肉蛋白的凝胶特性,从而应用于实际低温肉制品体系中,得以提高大豆分离蛋白在肉制品中的合理应用,提高肉制品品质。
1 材料与方法
1.1 材料与试剂
猪背部最长肌,哈尔滨家乐福超市;大豆分离蛋白(蛋白含量89.21%),山东省高唐蓝山集团;十二烷基硫酸钠(SDS)、β-巯基乙醇,美国Sigma公司;葵花籽油,中粮集团福临门;氢氧化钠、盐酸、磷酸二氢钠、磷酸氢二钠,分析纯试剂。
1.2 主要仪器设备
T18型高速分散机,德国IKA公司;Scientz-IID型超声波细胞破碎仪,宁波新芝生物科技股份有限公司;ALC-310.3型分析天平,德国艾科勒ACCULAB公司;PHSJ-4A型实验室pH计,中国上海雷磁公司;AR2000流变仪,英国TA Instrument公司;TA-XT Plus质构仪,英国Stable Micro Systems公司。
1.3 试验方法
1.3.1大豆分离蛋白的超声处理 实验室提取的大豆分离蛋白用20倍体积的水复溶,pH调节到7.0,将超声探头浸入SPI溶液液面以下2cm并位于液面中间,同时将盛放样品的烧杯置于冰水浴中,在20 Hz选定超声处理时间和功率进行超声处理(附表),每超声5 s,停止超声5 s,冷冻干燥后得到超声处理大豆分离蛋白。

附表 超声处理方法
1.3.2复合蛋白凝胶的制备 MP∶SPI=4∶1(W/W),溶解在0.6mol/L NaCl、50mmol/L磷酸盐缓冲溶液中,总蛋白浓度为40mg/mL,室温下搅拌90min,即得MP-SPI复合蛋白。复合蛋白在80℃条件下水浴30min制备凝胶,4℃隔夜。
1.3.3乳化性测定 用0.1mol/L、pH 7.0的磷酸盐缓冲溶液配制100mL、0.1g/mL的混合蛋白悬浮液,其中,MP∶SPI=4∶1(W/W)。向匀浆机中加入30mL蛋白悬浮液、10mL葵花籽油,在20 000r/min的条件下得到乳浊液,在0min与10min时从底部吸取100μL加入10mL质量浓度为0.1g/mL的SDS溶液中,测定波长为500nm时的吸光度(取3次测定的平均值),乳化性的计算公式为式(1)、(2):
乳化活性(EAI)=A0×100
(1)
乳化稳定性(ESI)=(A10/A0)×100
(2)
式(1)、(2)中,A0:0min的吸光值;A10:10min 的吸光值
1.3.4凝胶质构性的测定 将制备的复合蛋白凝胶在4℃冰箱中过夜后,利用质构仪测定凝胶硬度,测试前先将凝胶在25℃条件下水浴1 h。设定的主要参数是:探头类型为P/0.5、测前速度为1.0mm/s、测定速度0.5mm/s、测定距离为5.0mm、测后速度为1.0mm/s、触发类型为自动、触发力为5g,数据获得速度为200pps。
1.3.5凝胶持水性的测定 制备的复合蛋白凝胶在 4℃冰箱中过夜后,取凝胶块放入50mL的离心管中,离心(10 000g、15min、4℃)。除去水后,将离心管倒放在铺有吸水毛巾的桌面上,15min后称重[6-7]。

(3)
1.3.6流变性的测定 流变学性质测定采用剪切速率扫描模式[8]。将经过不同方式制备的大豆蛋白-磷脂酰胆碱纳米乳液加到流变仪平板上,流变仪平板直径为40mm,探头型号及尺寸:pp为20mm、板间距为0.5mm。采用石蜡油对两平行板间的缝隙封口,防止水分蒸发。测定参数:初始温度25℃,以5℃/min升温速率升温至90℃后保温20min,之后以5℃/min降温速率降温至25℃。角频率为0.63 rad/s,固定形变0.01,记录下弹性模量G′数值的变化。
1.3.7化学作用力的测定 复合蛋白凝胶的作用力根据Jiang等[9]的方法进行测定。2g凝胶样品溶解在18mL不同的溶解液中,然后将混合溶液于80℃加热30min,冷却到室温,5 000g离心15min。经溶解液处理后提取的蛋白含量被用来表明凝胶中的主要作用力。溶解液如下:8mol/L尿素、50mmol/L磷酸盐缓冲液(pH 7.0)(氢键);0.5% SDS、50mmol/L磷酸盐缓冲液(pH 7.0)(疏水交互作用);0.25% β-巯基乙醇、50mmol/L磷酸盐缓冲液(pH 7.0)(二硫键)。
1.3.8扫描电镜 将真空冷冻干燥后的粉末充氮气密封、避光储藏,测量时首先用导电双面胶将冻干粉末固定在金属样品平台上,轻吹去多余的粉末,置于离子溅射仪的样品舱中,在15mA的电流下喷金90 s,样品取出后,装入扫描电子显微镜(15 kV)观察室,进行观察。
1.4 数据统计及分析
单项实验重复3次。用SAS 8.12进行差异显著性(P<0.05)分析。采用Origin9.1软件进行图表处理。
2 结果与讨论
2.1 超声处理复合蛋白体系乳化性
如图1和2所示,与天然SPI与MP复合体系乳化性(EAI 8.97m2/g,ESI 66.7%)相比,经超声处理后的SPI与MP复合体系乳化性显著提高。而且经高功率、长时处理的SPI与MP复合体系乳化性最好,乳化活性和乳化稳定性分别为18.25m2/g和78.88%。
超声波能产生空穴效应、机械剪切作用以及热作用,能够破坏大豆分离蛋白分子中维持高级结构的次级键,使肽链变得疏松,在复合蛋白乳化均质过程中,利于吸附在油—水界面,提高SPI的溶解度[10-11],促进了其与MP能更好地溶解在缓冲液中,提高蛋白质—水之间的作用,提高复合体系的乳化性。另外,SPI经超声处理使更多疏水基团暴露,降低SPI表面张力,在与MP复合乳化均质过程中,使更多的蛋白质吸附在气/水界面上,降低蛋白膜的粘性度和刚性,提高乳化活性。SPI经超声处理后,蛋白质三级结构会被破坏掉,这有助于形成足够的界面来稳定油滴,所以MP与SPI复合体系的乳化稳定性增强[12]。
2.2 超声处理复合蛋白体系质构性
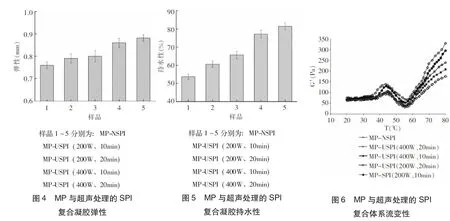
图3和图4表明,SPI经超声处理后能够改善SPI与MP复合凝胶的硬度和弹性,且经高功率超声处理的SPI与MP复合凝胶硬度及弹性值提高显著(P<0.05)。与MP-NSPI凝胶相比,凝胶2~5号样品的硬度分别提高了3.1%、8%、17.6%和21.5%,弹性的变化趋势与硬度的变化趋势相同,其中经功率400 W、超声20min的SPI与MP凝胶的弹性最大,为0.88mm。

超声波通过在固体颗粒的表面产生高速微射流,对固体颗粒表面进行剥离、凹蚀和粉碎,从而产生新的活性表面,提高蛋白质表面的亲水性[13]。SPI经超声处理后,疏水肽的分子数目增多,疏水基团暴露增加了蛋白质的疏水部分,促进胶束的形成[14],进而影响MP与SPI复合凝胶的凝胶性。超声功率增加后声能密度增大及声能转化为更多的化学能和物理能,SPI受机械剪切、搅拌空化作用增强。增加超声功率还会加快大豆蛋白构型的破坏,蛋白分子展开暴露出更多的疏水基团,进而提高了蛋白质的表面疏水性,降低了表面张力。这样,蛋白质—水之间的相互作用及蛋白质—蛋白质之间的交联作用增强,将间隙中的水分锁定在凝胶体系的同时网络结构会更加紧密,从而提高了SPI与MP复合凝胶的硬度及弹性。
2.3 超声处理复合蛋白体系持水性
如图5所示,超声处理后的SPI与MP复合凝胶持水性显著提高(P<0.05)。与天然SPI与MP复合凝胶持水性53.68%相比,MP-USPI(200W、10min)、MP-USPI(200W、20min)、MP-USPI(400W、10min)和MP-USPI(400W、20min)凝胶,持水性分别提高了6.91%、11.96%、23.69%和28.05%。这可能是因为SPI经超声处理后,能显著提高大豆分离蛋白的溶解性[15-16]。MP也是盐溶蛋白,SPI溶解性提高,使得溶解于溶剂中的总蛋白含量提高,加强蛋白质—蛋白质、蛋白质—水之间的作用,热诱导凝胶形成过程中能形成比较均匀的凝胶结构。已有研究表明,凝胶的微观结构与凝胶持水性密切相关。通常情况下蛋白质疏水区域一般在蛋白质分子内部,超声处理的SPI能将各种疏水基团接到蛋白质分子上,进而导致蛋白质的三级结构发生改变,形成可溶性蛋白聚集物,粒度及不溶蛋白的聚合程度降低。在MP与SPI复合蛋白凝胶形成过程中,SPI粒度的减小有益于产生更多蛋白质-水之间的相互作用,提高复合蛋白凝胶的持水性。
2.4 超声处理复合蛋白体系流变性
由图6可知,随着温度的上升(20~80℃),所有经过超声处理的SPI与MP混合蛋白的弹性模量G’明显高于未经超声处理的SPI与MP复合体系的弹性模量G’。在超声作用下,微流束作用和空穴效应促使分子运动速度加快,降低蛋白聚集程度,使SPI分子链展开,进而改变MP-SPI的流变性。
由图6可见,G’的变化呈现出双峰值,代表热诱导凝胶形成过程中经历两个热变性阶段,其中一个组分先发生变性,另一个组分需要在更高的温度下才发生变性[17]。有学者对稀溶液中肌球蛋白分子的热诱导凝胶形成机制进行了研究,认为热诱导凝胶的形成机制是肌球蛋白分子的头—头的凝聚、头—尾的凝聚和尾—尾的凝聚[18],因此就会引起两个峰值的出现。结果还表明,SPI经高功率超声处理后与MP复合最终的G’增加值更大,这可能是因为声能密度增大,并且能将声能转化为更多的化学能和物理能,SPI受机械剪切、搅拌空化作用增强,使得SPI变性程度越大,与MP能形成更好的凝胶,因此储能模量G’越大。此外,高功率超声处理使蛋白分子展开,暴露更多的疏水基团,能够提高SPI的表面疏水性,增强SPI与MP之间的疏水交互作用,使弹性增加,表现为高的G’值。
2.5 超声处理复合体系凝胶形成过程中的作用力
由图7可知,经β-巯基乙醇溶解后的蛋白含量无显著变化,经尿素和SDS溶解后的蛋白含量随着超声功率和超声时间的提高发生显著变化(P<0.05),并且还发现高功率的影响更为显著。说明经超声处理的SPI对复合凝胶的二硫键影响不显著,但对复合凝胶的氢键和疏水作用影响显著。还可发现,不论是未超声的SPI与MP的复合凝胶,还是经超声处理的SPI与MP复合凝胶,氢键和疏水交互作用都是稳定/形成凝胶最重要的力,二硫键也参与凝胶的形成,但不是稳定/形成凝胶最主要的力。为此可以推断不论超声与否,疏水交互作用、氢键和二硫键都对SPI与MP凝胶结构的维系起了作用,并且疏水交互作用和氢键作用远高于二硫键的作用。
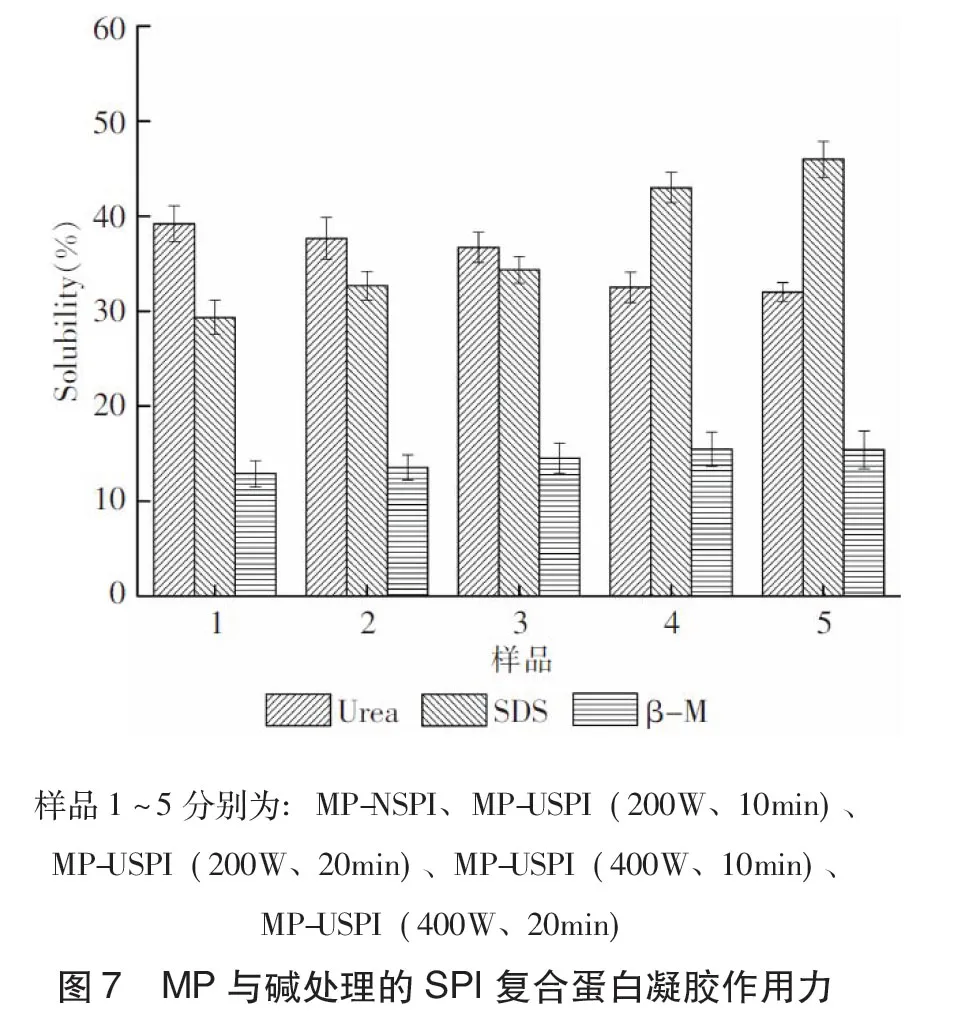
超声作用将疏水基团暴露至蛋白表面[19],疏水相互作用在凝胶的形成过程中起重要作用[20],特别是在热聚集的时候能够形成更好的蛋白-蛋白聚合物,提高SPI与MP的交互作用,表现为疏水交互作用的增强。Tian等[21]推断超声处理产生的空穴效应能增大水和空气之间的间距,从而使蛋白分子环境发生变化,降低氢键和疏水相互作用。本文SPI经超声空穴效应可能也会削弱氢键和疏水相互作用。SPI分子内/间氢键的减少,在随后的热诱导MP-SPI形成过程中,会继续减少,表现为用尿素提取的蛋白含量减少。而SPI疏水交互作用的减弱,能引起大豆分离蛋白溶液的游离巯基含量、表面疏水性和溶解性的增加,这会引起MP与SPI疏水交互作用的增强,使经SDS提取的蛋白含量显著提高。SPI蛋白分子间的非共价作用减少可能转化为静电相互作用,从而影响MP-SPI凝胶的持水性。已有研究表明,超声波导致溶解性和表面疏水性同时增加的现象,可能是蛋白粒度减小、其他分子相互作用力减弱的结果[22]。
2.6 超声处理复合体系凝胶观结构观察
通过对超声处理的SPI与MP复合蛋白凝胶扫描电镜图8观察发现,经过超声波处理的凝胶空间结构与未处理的样品有显著差异。MP-NSPI凝胶(图a)的SPI呈不规则形状充填在混合体系中,凝胶结构粗糙,有明显的断层感,没有发现明显的交联。经200W超声的SPI与MP复合凝胶(图b和c)能看到交联现象,生成了不规则、大的孔洞。经高场强超声的SPI与MP复合凝胶(图d和e)能观察到明显的粗丝、细丝交联现象,结构变得更加致密和均匀,不规则的孔洞变小。蛋白分子的大小和形状能影响凝胶的微观结构[23],SPI经超声作用会减小其粒度,增强蛋白质—蛋白质的相互作用,影响最终MP-SPI复合凝胶的微观结构。而且超声导致可溶性蛋白聚合物的形成[24],这种可溶性蛋白聚合物,在形成热凝胶时可能转变为难溶蛋白聚合物并有利于与MP通过疏水交互结合,起到使空间结构更加均一、致密的作用。Madadlou等[25]指出蛋白粒径减小后,再发生聚合可以使结合更紧密,空间结构更稳定,凝胶质构性更强。

3 结论
通过对超声处理MP-SPI复合体系乳化性质、凝胶性(持水性、流变性、质构性)的测定并对凝胶微观结构进行观察可知:SPI经过10/20min、200/400 W超声处理后会影响MP-SPI复合体系的乳化性、凝胶性。其中MP-USPI(400W、20min)复合体系乳化性及凝胶性最好,EAI和ESI分别为18.25m2/g 和78.88%;持水性提高了28.05%;硬度提高了21.5%;弹性为0.88mm。凝胶结构变得致密、均匀,不规则孔洞变小。随着SPI变性程度的升高,氢键都有下降趋势,疏水交互作用增加,二硫键变化不显著。◇
[1]李晓东.功能性大豆食品[M].北京:化学工业出版社,2006.
[2]Feng J,Xiong Y L.Interaction of myofibrillar and preheated soy proteins[J].Journal of Food Science,2002,67(8):2851-2856.
[3]Feng J,Xiong Y L.Interaction and functionality of mixed myofibrillar and enzyme-hydrolyzed soy proteins[J].Journal of Food Science,2003,68(3):803-809.
[4]Herrero A M,Carmona P,Cofrades S,et al.Raman spectroscopic determination of structural changes in meat batters upon soy protein addition and heat treatment[J].Food research international,2008,41(7):765-772.
[5]欧阳艳华,汪少芸,周红,等.鸡肉蛋白和大豆蛋白的相互作用和机理研究[J].中国食品学报,2011,11(4):90-95.
[6]Park D,Xiong Y L,Alderton A L,et al.Biochemical changes in myofibrillar protein isolates exposed to three oxidizing systems[J].Journal of Agricultural and Food Chemistry,2006,54(12):4445-4451.
[7]Kocher P N,Foegeding E A.Microcentrifuge-based method for measuring water-holding of protein gels[J].Journal of Food Science,1993,58(5):1040-1046.
[8]Samejima K,Samejima J.Trillium genus illustrated[M].北海道大学図書刊行会,1987.
[9]Jiang J,Xiong Y L.Extreme pH treatments enhance the structure-reinforcement role of soy protein isolate and its emulsions in pork myofibrillar protein gels in the presence of microbial transglutaminase[J].Meat science,2013,93(3):469-476.
[10]Chen L,Chen J,Ren J,et al.Effects of ultrasound pretreatment on the enzymatic hydrolysis of soy protein isolates and on the emulsifying properties of hydrolysates[J].Journal of Agricultural and Food Chemistry,2011,59(6):2600-2609.
[11]Jambrak A R,Lelas V,Mason T J,et al.Physical properties of ultrasound treated soy proteins[J].Journal of Food Engineering,2009,93(4):386-393.
[12]Arzeni C,Martinez K,Zema P,et al.Comparative study of high intensity ultrasound effects on food proteins functionality[J].Journal of Food Engineering,2012,108(3):463-472.
[13]朱建华,杨晓泉.超声物理改性对SPI功能特性的影响[J].中国油脂,2006,31(1):42-44.
[14]朱建华,杨晓泉,熊犍.超声处理对大豆蛋白表面性质的影响[J].食品与发酵工业,2005,31(3):16-20.
[15]Karki B,Lamsal B P,Grewell D,et al.Functional properties of soy protein isolates produced from ultrasonicated defatted soy flakes[J].Journal of the American Oil Chemists’ Society,2009,86(10):1021-1028.
[16]Tang C H,Wang X Y,Yang X Q,et al.Formation of soluble aggregates from insoluble commercial soy protein isolate by means of ultrasonic treatment and their gelling properties[J].Journal of Food Engineering,2009,92(4):432-437.
[17]陈海华,许时婴,王璋.亚麻籽胶与盐溶肉蛋白的作用机理的研究[J].食品科学,2007,28(4):42-47.
[18]杨振.魔芋粉,转谷氨酰胺酶和大豆分离蛋白对鲤鱼肌原纤维蛋白凝胶特性的影响[D].东北农业大学,2012.
[19]Hu H,Fan X,Zhou Z,et al.Acid-induced gelation behavior of soybean protein isolate with high intensity ultrasonic pre-treatments[J].Ultrasonicssonochemistry,2013,20(1):187-195.
[20]Kohyama K,Sano Y,Doi E.Rheological characteristics and gelation mechanism of tofu(soybean curd)[J].Journal of Agricultural and Food Chemistry,1995,43(7):1808-1812.
[21]Tian Z M,Wan M X,Wang S P,et al.Effects of ultrasound and additives on the function and structure of trypsin[J].UltrasonicsSonochemistry,2004,11(6):399-404.
[22]胡昊.利用高场强超声波增强大豆蛋白凝胶性及凝胶缓释效果[D].华中农业大学,2014.
[23]Renkema J,Knabben J,Van Vliet T.Gel formation by p-conglycinin and glycinin and their mixtures[J].Food Hydrocolloids,2001,15(4):407-414.
[24]Stathopulos PB,Scholz GA,Hwang YM,et al.Sonication of proteins causes formation of aggregates that resemble amyloid[J].Protein Science,2004,13(11):3017-3027.
[25]Madadlou A,Mousavi ME,Emam-Djomeh Z,et al.Comparison of ph-dependent sonodismption of re-assembled casein micelles by 35 and 130khz ultrasounds[J].Journal of Food Engineering,2009,95(3):505-509.
——以高中化学“氢键”的教学为例

