中芬沙棘果功能研究现状
刘芳丽
(中国教育科学研究院,北京 100088)
沙棘果因其含量丰富的营养素及独特的药用价值越来越受到全世界的关注。沙棘果不仅富含蛋白质、维生素、矿物质、植物化学因子、有机酸,还含有上百种生理活性成分[1],具有抗炎、杀菌、止痛和促进组织再生等特殊功效。其中,许多成分在杀死和抑制肿瘤细胞、抗衰老、抗疲劳、降“三高”、增强机体活力和免疫力等方面也显示出了独特的治疗效果,有学者甚至通过这些特性探索沙棘作为抗艾滋病药物的可能性[2]。本文旨在了解目前对沙棘果资源研究较多的中国和芬兰沙棘果功能性研究现状和差异,为未来深入合作奠定基础。
1 中芬研究进展
目前,芬兰对沙棘果功能性的研究主要集中在生物活性和临床药理等方面[3],如重金属解毒、放射性防护、肿瘤预防、血栓抑制、创伤组织的愈合及康复、抗氧化应激、细胞和体液免疫调节、改善特异性皮炎、降血脂、降血糖、肝纤维变性治疗、肝功能恢复以及对冠心病危险因子的预防作用等。
芬兰是世界上研究沙棘较为深入的国家之一,以Baoru Yang和Heikki Kallio领导的团队为代表,他们从1999—2017年12年间的实验性研究项目[4-29]进展见表1。以Baoru Yang和Heikki Kallio为代表的芬兰研究侧重于种质资源化学成分分析(尤其是比较中国产与芬兰产沙棘果油中脂肪酸、维生素、甾醇、糖类、有机酸等含量和种类的研究),沙棘不同部位提取物在抗炎症、控血脂、治皮肤病和防心血管等疾病的流行病学干预的研究,通过对比中国研究者的沙棘功能性研究发现,两国在沙棘种质资源、功能性和研究方法等方面存在较大差异。
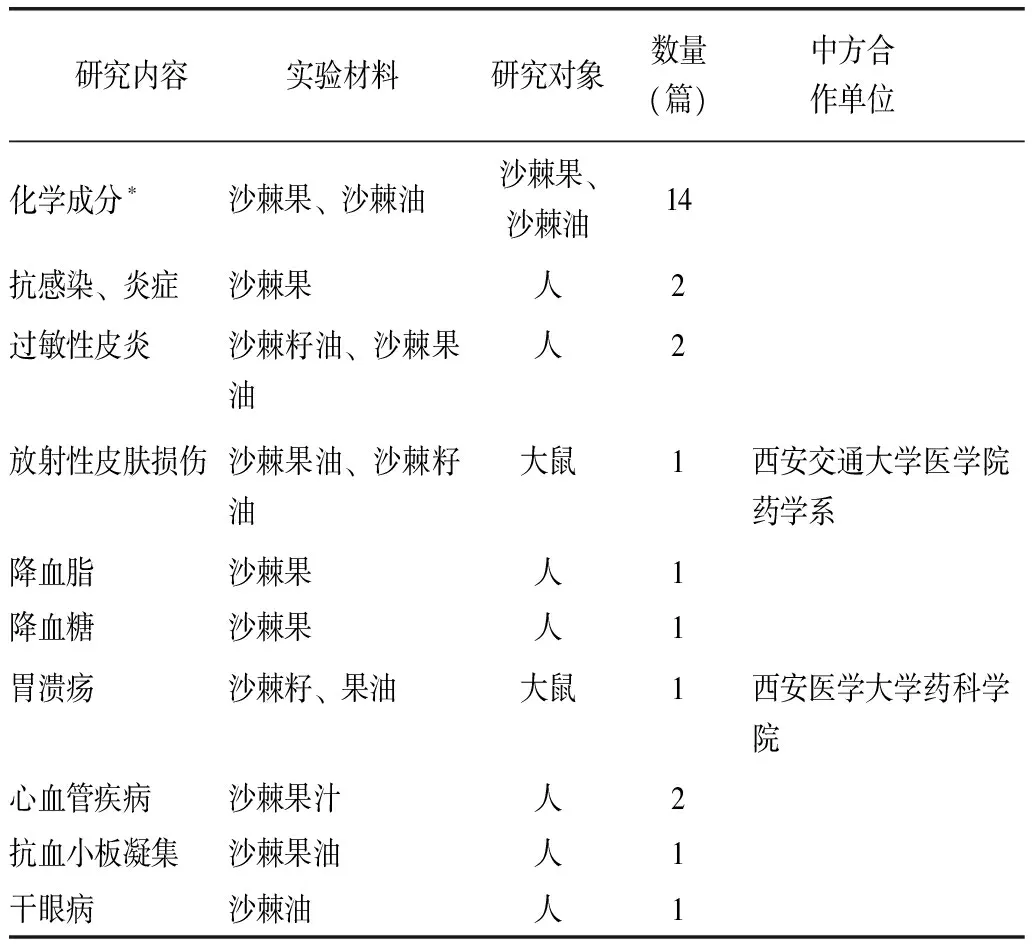
表1 实验性研究项目
*主要包括:不同地区沙棘果中果油含量和脂肪酸组成;收获时间对不同地区沙棘中三酰甘油和甘油磷脂的影响;不同地区和收获时间对维生素C、维生素E、生育三烯酚的影响;生育酚和生育三烯酚在两种沙棘亚种中的籽和果中的研究;植物甾醇在沙棘中:不同地区和收获时间的鉴别和作用;黄酮醇苷类在三种不同沙棘品种中的情况和在收获时节的变化;沙棘种的肌醇和甲基肌醇;地区、收获时间和气候条件对沙棘肌醇和甲基肌醇含量的影响;糖、糖醇、果酸和维C在中国野生沙棘中的情况;三个沙棘亚种果实中的生物活性成分分析等
1.1 种质资源
1.1.1维生素 沙棘富含多种维生素[30],但不同品种、产地、收获时间的沙棘亚种之间所含各类化学成分的量也有较大差别,同一品种的沙棘果实因部位不同维生素含量也不同。遗传背景和收获时间是决定维生素C在沙棘果中含量的2个基本因素。不同亚种的杂交在一定程度上影响维生素C的量。Yang等[16]对中国产野生中国亚种(sinensis)、欧洲产鼠李亚种(rhamnoides)和俄罗斯产蒙古亚种产自不同产地和收获期的野生及栽培沙棘采用HPLC法测定浆果中维生素C、生育酚和生育三烯酚的含量。原产于中国的野生中国亚种浆果果汁中维生素C含量较欧洲产鼠李亚种和俄罗斯产蒙古亚种多5~10倍(4~13:0.02~2g/L果汁)。中国亚种的沙棘种子中比鼠李亚种(平均290mg/kg)和蒙古亚种(平均250mg/kg)含较少的生育酚和生育三烯酚(平均130mg/kg),而在中国亚种的新鲜果实中所含有的生育酚和生育三烯酚(120mg/kg)却3倍于鼠李亚种(40mg/kg)、2倍于蒙古亚种(50mg/kg)。并且,果实中的此类物质的含量在9月上旬至中旬达最高水平,而在种子中的量则持续增加到11月底。中国亚种的新鲜果实无疑是总生育酚和生育三烯酚的最优良的资源。Kallio等[12]对1997年10—11月采集的中国沙棘果(CH)、8月底采集的芬兰沙棘果(Fl)和俄罗斯沙棘果(RU)的各种成分分别进行比较,发现中国沙棘果汁中的维生素C含量极高,平均8g/L(4.2~13.2g/L),是芬兰沙棘果汁中含量的5倍。
1.1.2矿物质 据报道,沙棘果中含有27种矿物质元素,其中钾的含量最为丰富[12]。在中国沙棘中,钾的含量(果肉或果汁中)大于钼和铁(果汁和干沙棘中)的10倍还要多。Kallio等[12]比较了中国和芬兰沙棘中的8种成分,表明芬兰的沙棘果肉中比中国沙棘含较少的铁、钙和铅,但却含有更多的镉,原因可能是水果的成熟度和自然环境中的矿质元素含量都会直接影响植物中氮、钙、钾、钠、镁、铜、铁、锌和锰的含量[31],在一些样品中铅和镉含量的增加表明存在轻微的污染[12]。1.1.3脂类 沙棘的果皮、果肉和种子中都含有大量甘油三酯、磷脂和游离脂肪酸,这在植物界中较为罕见。沙棘果肉和果皮中主要含单不饱和脂肪酸,沙棘籽中主要含多不饱和脂肪酸。不同部位的含油量与油的脂肪酸组成随沙棘产地、品种的不同而有所差异。Yang等[11]对比了鼠李亚种与中国亚种果油的含量和脂肪酸组成,鼠李亚种比中国亚种的含油量更高,在种子中为11.3%∶7.3%(P<0.01)、在果实中为3.5%∶2.1%(P<0.001)、在无籽部分的组织中为2.8%∶1.7%(P<0.01)。亚油酸和α-亚麻酸约占沙棘籽油总脂肪酸的70%。棕榈油酸在籽油中特别贫乏,但在果肉或果皮油中占12.1%~39.0%,在整个浆果中占8.9%~31.0%。中国亚种较鼠李亚种的籽油含更多的亚油酸(40.9% VS 39.1%)和更少的亚麻酸(26.6% VS 30.6%);鼠李亚种比中国亚种果油中棕榈油酸的量高(26.0% VS 21.5%),但α-亚麻酸的量则反之(8.8% VS 11.2%)。
1.1.4糖类、挥发油类 据报道,中国沙棘可溶性糖类在粗榨果汁中含量为5.6%~22.7%[12,32]。这个数值比俄罗斯的高[12,33],同时也比芬兰的高[12]。中国和俄罗斯亚种中葡萄糖和果糖加起来占总糖量的90%,但在芬兰亚种中仅占60%[12]。中、芬沙棘汁中含量最多的糖类均为葡萄糖,果糖含量次之。而中国沙棘果中含糖量高于芬兰沙棘果,Kallio等[12]在1997年分别从中国的山西太原和芬兰的Kokemäki收集了15、5个样品,经过解冻及一系列处理后测得中国沙棘果压榨的果汁中总糖量为5.6%~20.1 %,次高值是12.9%,而芬兰沙棘果中含糖量为0.9%~3.2 %。挥发性油类主要对沙棘的口感和气味形成影响,其成分很大程度上依赖于收获时间[34]。中国亚种比起芬兰亚种含更多的3-甲基丁酸乙酯、戊酸丁酯、2-甲基丙酯、3-甲基丁酸和3-甲基丁酸戊酯。另外,中国亚种中也富含2-甲基丁酸乙酯、3-甲基丁酸乙酯和己酸乙酯等[12]挥发性物质。
1.1.5有机酸 酸类能明显增加血管的柔韧性和可塑性,并有明显降压效果。沙棘中含有苹果酸、柠檬酸、酒石酸、草酸和琥珀酸等,其中,苹果酸和奎宁酸加起来共占90%的总酸[12]。酸的总量因品种和产地而异,例如俄罗斯产的总酸为2.1~3.2g/100mL,芬兰产的为4.2~6.5g/100mL,而中国产沙棘中有机酸含量最高,可达3.5~9.1g/100mL[12,32]。
1.1.6植物甾醇 沙棘果中的植物甾醇也受产地和收获时间的影响较大。Yang等[18]测得芬兰鼠李亚种和中国的中国亚种中种子、果肉/果皮和果实的总甾醇量差异较大,分别为1 200~1 800、240~400、340~520mg/kg;在所提取的油中相应值分别为12~23、10~29、13~33g/kg。但在亚种和采集点之间,甾醇量和组成变化较小,说明产地、基因背景是甾醇水平的重要影响因素。
1.2 功能性研究
1.2.1黄酮类物质与调控血脂 Larmo等[9]在229位健康志愿者中进行了双盲随机试验,持续使用3个月28g/d的沙棘果,并将试验开始和结束时收集的空腹血液样本进行分析,从而得到血液脂肪标记物和黄酮含量的数值。在与安慰剂组相比较后发现,使用沙棘果的志愿者在血液中的槲皮素和异鼠李素显著增加,但血清中HDL、LDL 胆固醇总量或血清甘油三酯浓度却无变化。由此证明,沙棘是一种良好的黄酮类化合物的膳食来源,但它在本实验条件下并不会影响健康人体血液中各种脂肪标记物的水平。
1.2.2抗感染、炎症和心血管疾病 Larmo P等[5]通过一个由254位健康志愿者参与的双盲随机试验研究了沙棘果在感染、炎症以及心血管危险因子调控中所发挥的作用。实验发现,志愿者中普通感冒感染的数量和时间长度(CC)以及消化系统感染(DTI)指标在沙棘果组和安慰剂组之间无明显差别,泌尿系统指标(UTI)也因太小而无法得出可靠结论,但作为人类炎症和心血管疾病危险因素指标的血浆CRP浓度却明显降低。因此,虽然沙棘果不会降低感染或炎症的发生率,但却对CRP有反向作用,不失为一种预防和辅助治疗心血管疾病的健康食品。
1.2.3乙醇提取物与调控血糖 Lehtonen等[10]研究沙棘果及其溶于乙醇的代谢产物对餐后高血糖和胰岛素响应的影响。本研究为10位拥有标准体重的健康男性志愿者随机分配4种实验早餐,A餐为控制组,其余3种(B1、B2、B3)为沙棘果膳食组。所有膳食均包含等量酸奶和葡萄糖(50g)。B1餐采用干燥粉碎了的整体浆果;B2餐采用超临界二氧化碳流体提取的无油浆果;B3餐采用乙醇二氧化碳提取的沙棘果成分,收集分析前及实验期间6h内的血液样本,测定全部志愿者的血糖、胰岛素和肿瘤坏死因子-α三项指标。结果发现,与控制组A餐相比,B1餐不仅能抑制餐后胰岛素响应峰值,而且能稳定餐后高血糖和随后的低血糖;B2餐比控制组A餐更能控制一个稳定的胰岛素响应状况;B3餐中可溶于乙醇的沙棘成分对胰岛素和葡萄糖响应表现出了较强的控制力。结果提示,沙棘果可以降低由持续的餐后高血糖引起的2型糖尿病的风险。
1.2.4皮肤病 沙棘油因使用安全、性质稳定和对黑变病、衰老性皮肤皱纹及雀斑有一定治愈率[35],而被用作某些护肤品的主要成分[36]。王养正等[8]在为受放射性皮肤损伤的大鼠给药l0d后,光学显微镜观察结果表明,沙棘果油(SBPO)组、沙棘籽油(SBSO)组及Solcoseryl—Jelly软膏组的红斑、水肿等局部症状明显减轻,创面分泌物明显减少,与阴性对照组比较,明显好转;电子显微镜观察结果表明,阴性对照组的超微结构明显受损,而SBPO组、SBSO组及Solcoseryl—Jelly组的损伤明显减轻。
1.2.5胃溃疡 沙棘果肉油能明显降低大鼠水浸应激性以及利血平型胃溃疡模型的溃疡指数,能明显降低大鼠幽门结扎型以及乙酸型胃溃疡模型的溃疡指数,能抑制大鼠胃酸及胃蛋白酶的分泌,促进胃粘液的分泌[37]。原因可能与沙棘果肉油抑制胃酸分泌、促进胃粘液分泌及镇痛作用有关。Xing等[22]也证明了用CO2萃取的沙棘籽油和沙棘果油对预防和治疗胃溃疡有显著效果。
1.3 研究方法
以沙棘的降血糖功能为例,中国的研究中较少以“人”为实验对象,主要以动物实验为主,一般以小鼠或大鼠作为研究对象。引发小鼠糖尿病的药物有所不同,常见的如链脲佐菌素、肾上腺素、葡萄糖和四氧嘧啶等,但几乎所有作者均未表明以上试剂所引发的糖尿病的类型(Ⅰ型糖尿病或2型糖尿病)。分组方式一般为高剂量组、低剂量组、对照组各一,另外,也有实验附加一个降糖药组。给药方式分为腹腔注射和混入饲料2种。沙棘有效成分提取方法差异较大:有的采用水提取浓缩干燥物,有的采用乙醇提取,有的直接采用干果研粉等——共同点是提取物都为混合物,但也有个别学者采用纯化了的单一的材料[38],比如沙棘多糖、槲皮素。测量指标主要有 TG、TC、HDL-C、SOD、GSH-PX,但根据不同实验目的也有附加检测MDA、BUN、CAT、胰岛素含量和肝(肌)糖元含量等项目。最后推导出的结论也较为一致,即沙棘提取物具有明显降血糖、增加机体内源性SOD水平和谷胱甘肽的作用。
相反,芬兰学者近几年多选择“人”作为沙棘降血糖功能的研究对象,采用不同提取方法、不同物理状态的沙棘作为人群膳食干预实验的材料,所得到的结果并不完全一致,沙棘提取物疗效有一定差异。例如Lehtonen等[10]提出沙棘果及其溶于乙醇的代谢产物可以明显降低由持续的餐后高血糖引起的2型糖尿病的风险。而在Lehtonen等[9]的另一实验中,110个超重或肥胖的女性志愿者被随机分配到4种膳食组(包括覆盆子组BB、沙棘组SB、沙棘酚类提取物组SBe以及沙棘油组Sbo),30~39d后测量志愿者血液样本和身体指标,结果显示,莓类果实或其某些成分对代谢性疾病有多样而微小的正面的影响。
2 目前存在的问题
总体上,目前针对沙棘的基础研究虽然涉及面广,但深度不够,包括对沙棘果中活性成分的数量、种类、作用机理等信息的掌握并未做到完整准确[37]。实验关注的是沙棘提取物的功效,而真正探究机理、靶部位、有效剂量、作用时间、对不同性别人群和动物的作用差异[39]的研究则非常少,更没有深入到分子水平。这些问题的出现,一方面由于沙棘生长地域条件的局限与人们缺乏普遍认知等原因使得人们对沙棘的认识需求相比其他药用植物少,沙棘的现代医学研究也仅发展了近30年的时间,人们的认识水平有待逐层深入;另一方面,由于沙棘成分复杂多样,不同亚种、不同部位、不同提取方法和条件,甚至不同状态(鲜果、干粉或油)下有多种可能性,这就对定位有效成分产生了阻碍。
2.1 机理不明、有效成分定位不清
目前,有学者专做分离提纯实验,也有专做药理实验,但是能够把分离后的单体应用到药理实验研究的则很少。以沙棘黄酮为例,大量沙棘黄酮药理实验采用的是直接从沙棘不同部位提取的“总黄酮(TFH)”,TFH也被认为是治疗缺血性心脏病、心肌缺血、慢性心功能不全、高血脂症、呼吸系统疾病、消化系统疾病、治疗烧伤、烫伤和其他皮肤病、预防和治疗多种肿瘤、动脉粥样硬化、心肌梗塞、脑血栓等疾病的纯天然药物[40-41]。然而,TFH是一个集合概念,包含多种组分,最主要的为槲皮素、异鼠李素、异鼠李素-3-β-D-葡萄糖苷、异鼠李素-3-β-D-芸香糖苷、山萘酚及其苷类和芦丁等[42],此外,还包括已被鉴定了的杨梅酮、猪草苷、五倍子酸、儿茶酸、齐墩果酸、谷甾醇、豆甾醇、洋地黄皂苷、黄芪苷等30余种[43],如此众多的黄酮类物质共同作用于实验生物体,很难建立起药理作用与单一组分的对应关系,一些基于不明事实的对于机理的推断也显得不够严谨可靠。例如有学者提出沙棘油具有抗实验性胃溃疡的作用[37],但沙棘油中何种物质能抑制胃蛋白酶活性和降低游离酸而抑制胃溃疡并不清楚。王养正[8]与芬兰土尔库大学合作的研究沙棘果油及沙棘籽油对大鼠放射性皮肤损伤的影响也仅证明了疗效,至于机理,笔者仅推断是由于沙棘果油和沙棘籽油中所含的丰富的维生素A、维生素E、不饱和脂肪酸以及磷酯、甾醇类、甜菜碱等多种生物活性成分作用的结果,并未给出单方或复配以上组分进行机理验证实验的确凿证据。Wen Zhang等[33]用沙棘籽残渣水提取物对链脲霉素引发的糖尿病大鼠的降血糖作用中声明该水提取物是含有蛋白质、碳水化合物、皂甙、酚类化合物和黄酮类化合物的混合物,结果证明,此混合物具有降低患糖尿病大鼠血糖、血脂及一氧化氮水平的功效,同时可以增强血清超氧化物歧化酶活性和谷胱甘肽水平,然而这一结论也未能解决有效成分定性定量的问题。因此,单一成分的药理作用由于其目前的稀缺性,理应值得业界学者关注,同时对药理作用机理的研究也需要长期、大量、重复性的实验来证明。
2.2 研究深度不足
中国是沙棘种质资源最丰富的国家,可以利用自身资源优势在提取方法、分离、提纯等层面与国际上先进技术相结合进行提取分析实验,以便得到各亚种成分定性定量的身份信息;另外,获得单一成分后,针对其可能的药理作用进行机理研究,对应到靶部位,考察其有效作用量、作用效果、作用时间等;最后深入到细胞水平、DNA水平,验证其药理作用。但目前单一成分做到DNA水平的极少,大多采用的是混合成分——沙棘提取物来验证对实验对象DNA的影响,例如黄晶等[44]就利用沙棘提取物对老龄大鼠SOD活力及SOD mRNA表达进行了实验,并证明了沙棘提取物在基因及蛋白质水平上促进SOD的表达。
综上所述,沙棘研究中对药理作用机理的探讨、对有效提取物中单一物质的探索以及中芬两国在人群干预实验上的合作在未来可以深入发展。◇
[1]Suomela JP,Ahotupa M,Yang B,et al.Absorption of flavonols derived from sea buckthorn(Hippophae rhamnoides L.)and their effect on emerging risk factors for cardiovascular disease in humans[J].J Agric Food Chem,2006,54(19):7364-7369.
[2]Fuheng W.Seabuckthorn medicine in Russia[J].Seabuckthorn,1991,4(2):38-41.
[3]陈学林,马瑞君,孙坤,等.中国沙棘属种质资源及其生境类型的研究[J].西北植物学报,2003,23(3):451-455.
[4]Kallio H,Yang B,Wang B,et al.Animal experiments on the anti-inflammatory and analgesic effects of sea buckthorn(HippophaerhamnoidesL.)oils[J].Biologically-active phytochemicals in food:analysis,metabolism,bioavailability and function.Proceedings of the EUROFOODCHEM XI Meeting,Norwich,UK,26-28 September,2001:69-73.
[5]Larmo P,Alin J,Salminen E,et al.Effects of sea buckthorn berries on infections and inflammation:a double-blind,randomized,placebo-controlled trial[J].Eur J Clin Nutr,2008,62(9):1123-30.
[6]Yang B,Kalimo KO,Mattila LM,et al.Effects of dietary supplementation with sea buckthorn(Hippophae rhamnoides)seed and pulp oils on atopic dermatitis[J].J Nutr Biochem,1999,10(11):622-630.
[7]Yang B,Kalimo KO,Tahvonen RL,et al.Effect of dietary supplementation with sea buckthorn(Hippophae rhamnoides)seed and pulp oils on the fatty acid composition of skin glycerophospholipids of patients with atopic dermatitis[J].J Nutr Biochem,2000,11(6):338-340.
[8]王养正,吴英,Heikki Kallio,等.沙棘果油及沙棘籽油对大鼠放射性皮肤损伤的影响[J].西安交通大学学报(医学版),2008,29(6):705-709.
[9]Lehtonen HM,Suomela JP,Tahvonen R,et al.Different berries and berry fractions have various but slightly positive effects on the associated variables of metabolic diseases on overweight and obese women[J].Eur J Clin Nutr,2011,65(3):394-401.
[10]Lehtonen HM,Jarvinen R,Linderborg K,et al.Postprandial hyperglycemia and insulin response are affected by sea buckthorn(Hippophae rhamnoides ssp.turkestanica)berry and its ethanol-soluble metabolites[J].Eur J Clin Nutr,2010,64(12):1465-1471.
[11]Yang B,Kallio HP.Fatty acid composition of lipids in seabuckthorn berries of different origins[J].Journal of Agricultural and Food Chemistry,2001,49(4):1939-1947.
[12]Kallio K,BR Yang,R Tahvonen,et al.Composition of sea buckthorn berries of various origins[J].Proceeding of International Symposium on Sea Buckthorn (HippophaerhamnoidsL.).
[13]Baoru Yang,Heikki Kallio.Composition and physiological effects of seabuckthorn(hippophae)lipids[J].Trends in Food Science&Technology,2002,13(5):160-167.
[14]Kallio H,Yang B,Peippo P,et al.Tag,gpl,tocopherols and tocotrienols in berries and seeds of two subspecies(ssp.Sinensis and,mongolica)of sea buckthorn(Hippophae rhamnoides)[J].J Agric Food Chem,2002,50(10):3004-3009.
[15]Yang B,Halttunen T,Raimo O,et al.Flavonol glycosides in wild and cultivated berries of three major subspecies ofHippophaerhamnoidesand changes during harvesting period[J].Food Chemistry,2009,115(2):657-664.
[16]Yang B,Kallio H.Effects of harvesting time on triacylglycerals and glycerophospholipids of sea buckthorn(Hippophaerhamnoids)berries of different origins[J].J Food Composition Analysis,2002,15(2):143-157.
[17]Kallio H,Yang B,Peippo P.Effects of different origins and harvesting time on vitamin C,tocopherols,and tocotrienols in sea buckthorn(Hippophaerhamnoids)berries[J].J Agric Food Chem,2002,50(21):6136-6142.
[18]Yang B,Karlsson R M,Oksman P H.Phytosterols in seabuckthorn(Hippophaerhamnoids)berries:identification and effects of different origins and harvesting times[J].J Agric Food Chem,2001,49(11):5620-5629.
[19]Yang B,Kallio H.Lipophilic components of seabuckthorn(HippophaerhamnoidesL.)seeds and berries[M].Seabuckthorn(HippophaeL.).A multipurpose wonder plant.Vol II:Biochemistry and pharmacology,2006:70-97.
[20]Yang B,Zheng J,Kallio H.Influence of origin,harvesting time and weather conditions on content of inositols and methylinositols in sea buckthorn(Hippophaerhamnoides)berries[J].Food Chemistry,2011,2(15):388-396.
[21]Zheng J,Kallio H,Linderborg K,et al.Sugars,sugar alcohols,fruit acids,and ascorbic acid in wild Chinese sea buckthorn(Hippophaerhamnoidesssp.sinensis)with special reference to influence of latitude and altitude[J].Food Research International,2011,44(7):2018-2026.
[22]Xing J,Yang B,Dong Y,et al.Effects of sea buckthorn(hippophae rhamnoides L.)seed and pulp oils on experimental models of gastric ulcer in rats[J].Fitoterapia,2002,73(7-8):644-650.
[23]Yang EC,Tahvonen B,Kallio R,et al.Effects of an antioxidant—rich juice(sea buckthom)on risk factors for coronary heart disease in humans[J].Journal of Nutritional Bio—chemistry,2002,13(6):346-354.
[24]Suomela JP,Ahotupa M,Yang B,et al.Absorption of flavonols derived from sea buckthorn(Hippophae rhamnoides L.)and their effect on emerging risk factors for cardiovascular disease in humans[J].J Agric Food Chem,2006,54(19):7364-7366.
[25]Larmo PS,Järvinen RL,Setälä NL,et al.Oral sea buckthorn oil attenuates tear film osmolarity and symptoms in individuals with dry eye[J].J Nutr,2010,140(8):1462-1468.
[26]Kortesniemi M,Sinkkonen J,Yang B,et al.NMR metabolomics demonstrates phenotypic plasticity of sea buckthorn(Hippophae rhamnoides)berries with respect to growth conditions in Finland and Canada[J].Food Chem,2017,219:139-147.
[27]Yang W,Laaksonen O,Kallio H,et al.Effects of latitude and weather conditions on proanthocyanidins in berries of Finnish wild and cultivated sea buckthorn(Hippophae rhamnoides L.ssp.rhamnoides)[J].Food Chem,2017(216):87-96.
[28]Ma X,Laaksonen O,Zheng J,et al.Flavonol glycosides in berries of two major subspecies of sea buckthorn(Hippophae rhamnoides L.)and influence of growth sites[J].Food Chem,2016(200):189-198.
[29]Yang W,Laaksonen O,Kallio H,et al.Proanthocyanidins in sea buckthorn(Hippophaё rhamnoides L.)berries of different origins with special reference to the influence of genetic background and growth location[J].J Agric Food Chem,2016,64(6):1274-1282.
[30]Lu R.Sea buckthorn-A multipurpose plant species for fragile mountains.ICIMOD Occasional Paper No.20.1992.Katmandu,Nepal,62p.
[31]Bounous G,E Zanini.The variability of some components and biometric characteristics of fruits of six tree and shrub species.Hort[J].Abst.,1988(60):4153.
[32]Ma Z,Cui Y and Feng G.Studies on the fruit character and biochemical compositions of some forms within Chinese sea buckthorn (Hippophaerhamnoidssubsp.sinensis)in Shanxi,China[M].Proceeding of International Symposium on Sea Buckthorn (H.rhamnoidsL.),Xian,China,1989.
[33]Zhang W,Zhao J,Wang J,et al.Hypoglycemic effect of aqueous extract of seabuckthorn(Hippophae rhamnoides L.)seed residues in streptozotocin-induced diabetic rats[J].Phytother Res,2010,24(2):228-232.
[34]Yang B.Lipophilic components of sea buckthorn(Hippophae.Rhamnoids)seeds and berries and physiological effects of sea buckthorn oils[M].PhD dissertation,Finland,Turku University,2001.
[35]徐汉卿,孙科峰,吕爱林.中华沙棘油的成分及其治疗黄褐斑的应用研究[J].沙棘,2004,17(2):25-26.
[36]仲崇菊,束瑞信.沙棘的活性成分及在化妆品中的应用[J].日用化学工业,1988(1):23-26.
[37]邢建峰,董亚琳,王秉文.沙棘果肉油对大鼠胃液分泌的影响及抗胃溃疡作用[J].2003,14(8):461-463.
[38]张颖,张立木,高永峰.泰山沙棘果成分含量测定及降血糖与免疫增强作用[J].中国医院药学杂志,2009,29(19):1604-1607.
[39]何志勇,夏文水.沙棘果汁营养成分及保健作用[J].食品科技,2002(7):69-71.
[40]曹竑,陈广仁,王爱国.沙棘黄酮类化合物及其生理功能探究[J].饮料工业,2003(6):5-8.
[41]Ercisli S,Orhan E,Ozdemir O,et al.The geno-typic effects on the chemical composition and antioxidant activity of sea buckthorn berriesgrown in Turkey[J].Scientia Horticulturae,2007(115):27-33.
[42]吴素林.反相HPLC法同时测定沙棘果肉异鼠李素、榭皮素及沙棘总黄酮的含量[J].沙棘,1998,11(4):31.
[43]顾关云.沙棘的化学成分、生物活性与临床研究[J].国外医药·植物药分册,2007,22(4):139-149.
[44]黄晶,刘志婷,刘晓东.沙棘提取物对老龄大鼠SOD活力及SOD mRNA表达的影响[J].吉林大学学报(医学版),2003,29(5):613-615.
——和田盘羊

