分子靶向治疗哮喘的研究进展
赵欣媛
哮喘是一种以慢性气道炎症为主要特征的异质性疾病,其主要临床表现为喘息、呼吸急促、胸闷,强度随时间变化[1]。哮喘可发生于任何年龄段,通常在童年发病,可持续到成年。据统计数据显示,全球范围内罹患哮喘人数约为3亿,年死亡人数约为25万,欧洲地区年龄<45岁人群中哮喘人数约为10万。过去10年,自吸入性皮质类固醇用于治疗哮喘以来,哮喘发病率逐渐趋于平缓,致死患者数量逐渐减少,大多数哮喘患者经治疗后控制良好,但仍有约5%的哮喘患者经治疗后控制不佳[2]。近年有研究结果显示,分子靶向治疗可能成为哮喘患者新的治疗方案[3]。本文旨在综述分子靶向治疗哮喘的研究进展。
1 哮喘的发病机制
哮喘的发病机制存在异质性[4],其主要发病机制是不同程度气道炎症、气道高反应性、黏液分泌过量及气道重塑,主要病理学改变是呼吸道上皮细胞和几种重要的效应器免疫细胞介导的炎性反应,包括树突状细胞、B淋巴细胞、T淋巴细胞、嗜酸粒细胞、肥大细胞及先天性免疫细胞,上述细胞通过信号分子(细胞因子)相互联系。
既往有关哮喘患者炎性反应机制的研究报道较多,如发现气道上皮在应对外部刺激〔如过敏原、污染物和感染因子(如病毒)〕时可引起先天性和适应性细胞(如树突状细胞、肥大细胞和先天性淋巴样细胞)募集和/或激活及辅助性T细胞2(Th2)因子途径激活[5]。当机体接触病原体或过敏原时,呼吸道上皮细胞和树突状细胞可促进初始T淋巴细胞分化为辅助性T细胞1(Th1)/Th2,而Th1分泌的细胞因子〔如白介素2(IL-2)和干扰素γ(IFN-γ)〕可抑制Th2分化及激活细胞免疫反应,包括自然杀伤细胞/T淋巴细胞、单核细胞/巨噬细胞和中性粒细胞的募集和/或激活;Th2分泌的细胞因子〔如白介素4(IL-4)、白介素5(IL-5)及白介素13(IL-13)〕可抑制Th1分化及体液免疫反应激活,进而导致组胺释放、平滑肌收缩、黏液细胞分泌及气道纤维化等哮喘反应,以上属于经典的Th1/Th2免疫应答模式[6]。目前,Th2介导的炎性反应是治疗哮喘的主要靶点之一[4],尤其是过敏性哮喘的重要细胞—Th2和2型先天性淋巴样细胞,其可分泌IL-4、IL-5、IL-13及促进免疫球蛋白E(IgE)生成、增强嗜酸粒细胞性炎性反应,而先天性免疫细胞因子〔如白介素1(IL-1)、白介素25(IL-25)和白介素33(IL-33)及气道上皮细胞释放的胸腺基质淋巴细胞生成素(TSLP)〕可激活Th2或2型先天性淋巴样细胞[7]。
此外,还有其他T淋巴细胞亚群参与哮喘的病理生理学改变,如辅助性T细胞9(Th9)和辅助性T细胞17(Th17)。白介素9(IL-9)是Th9分泌的主要细胞因子之一,其可影响对哮喘发病机制至关重要的许多造血细胞,如刺激活化T淋巴细胞增殖、促进肥大细胞增殖和分化及促使B淋巴细胞分泌IgE[8]。Th17可产生白介素17A(IL-17A)。既往研究结果显示,与健康对照者相比,抗类固醇性哮喘患者IL-17A水平较高,表明Th17可能参与抗类固醇性哮喘的发生发展[9]。
2 哮喘表型与分子靶向治疗
表型是一个有机体实际观察到的特性,如形态、发育和行为,根据临床表现和/或病理生理学特征、触发物、炎症表型及分子表型等可将哮喘分为不同哮喘表型[10],其中根据临床表现和/或病理生理学特征可将哮喘分为重型哮喘、易恶化哮喘、气流受限哮喘、治疗抵抗哮喘及早发迟发哮喘,根据触发物可将哮喘分为阿司匹林哮喘、过敏性哮喘、职业性哮喘及运动性哮喘,根据炎症表型可将哮喘分为嗜酸粒细胞型哮喘、中性粒细胞型哮喘及粒细胞缺乏型哮喘,根据分子表型可将哮喘分为Th2高表达表型和Th2低表达表型[11]。
靶向治疗是在细胞分子水平上针对已经明确的致病位点进行的治疗。随着近年医学技术发展,哮喘的病理生理学变化越来越明确,故靶向治疗可能成为哮喘新的治疗方案[12-13]。
3 哮喘患者分子靶向治疗药物
众所周知,Th2介导的气道炎症在哮喘发病过程中发挥着重要作用。因此,近年来大多数T h 2特异性细胞因 子〔如 IL-4[14-15]、白介素 5(IL-5)[16-17]、IL-9[18]、IL-13[14-15,19-20]〕开始直接或间接地用于靶向生物疗法;此外,IgE[21]、白介素 2(IL-2)[22]、C5[23]、白介素 17(IL-17)[22]、TSLP[24]、M1[25]、肿瘤坏死因子 α(TNF-α)[26]在内的其他因子正在开发中或已被用于哮喘靶向治疗的早期试验,详见表1。因此,与哮喘其他治疗措施相比,未来可能会对特定类型的哮喘患者使用抗白介素类治疗和其他靶向治疗[4]。
4 分子靶向治疗的可行性
气道炎症是哮喘的主要发病机制已得到临床认可,故抑制驱动气道炎症的细胞因子和递质将成为新的治疗靶点。目前,哮喘患者的分子靶向治疗仍处于起步阶段,需深入了解分子对哮喘潜在的作用机制[31]。目前研究结果显示,使用抗IgE抗体、抗IL-5抗体和抗IL-13抗体似乎是最有前途的;TNF-α和IL-4在严重哮喘中的作用相对令人失望;而针对TSLP和IL-9的靶向分子治疗正在研究;未来研究的重点可能是非Th2途径,即针对中性粒细胞的治疗策略,如Th17和IL-17[32]。WALSH 等[33]发现 Mepolizumab和雷曲珠单抗治疗有持续性糖皮质激素抵抗的嗜酸粒细胞增多症的严重哮喘患者有效,但需要大规模临床试验进一步证实。总之,上述药物代表了新型生物制剂的潜在发展目标,希望未来开发靶向多种细胞因子的生物制剂取得重大进展。
5 分子靶向治疗的安全性
目前,奥马珠单抗是被批准用于临床治疗哮喘的唯一抗体[34],其适应证是难以控制的严重哮喘及血IgE浓度为30~1 500 kU/L、体质量为50~120 kg的哮喘患者。既往研究结果显示,奥马珠单抗的常见不良反应是局部不良反应(如注射部位硬结或刺激)和全身性不良反应(如头痛、咽炎、眼睑炎),发生率<10%[35-37]。近期一项大型前瞻性研究评估了奥马珠单抗的长期(5年)应用安全性,包括恶性肿瘤和其他严重不良事件,结果显示,尽早采用奥马珠单抗长期治疗存在持续性症状的哮喘患者安全性较高[38]。有研究结果显示,采用奥马珠单抗治疗的哮喘患者恶性肿瘤的发生率与普通人群预期无差异[39-40]。
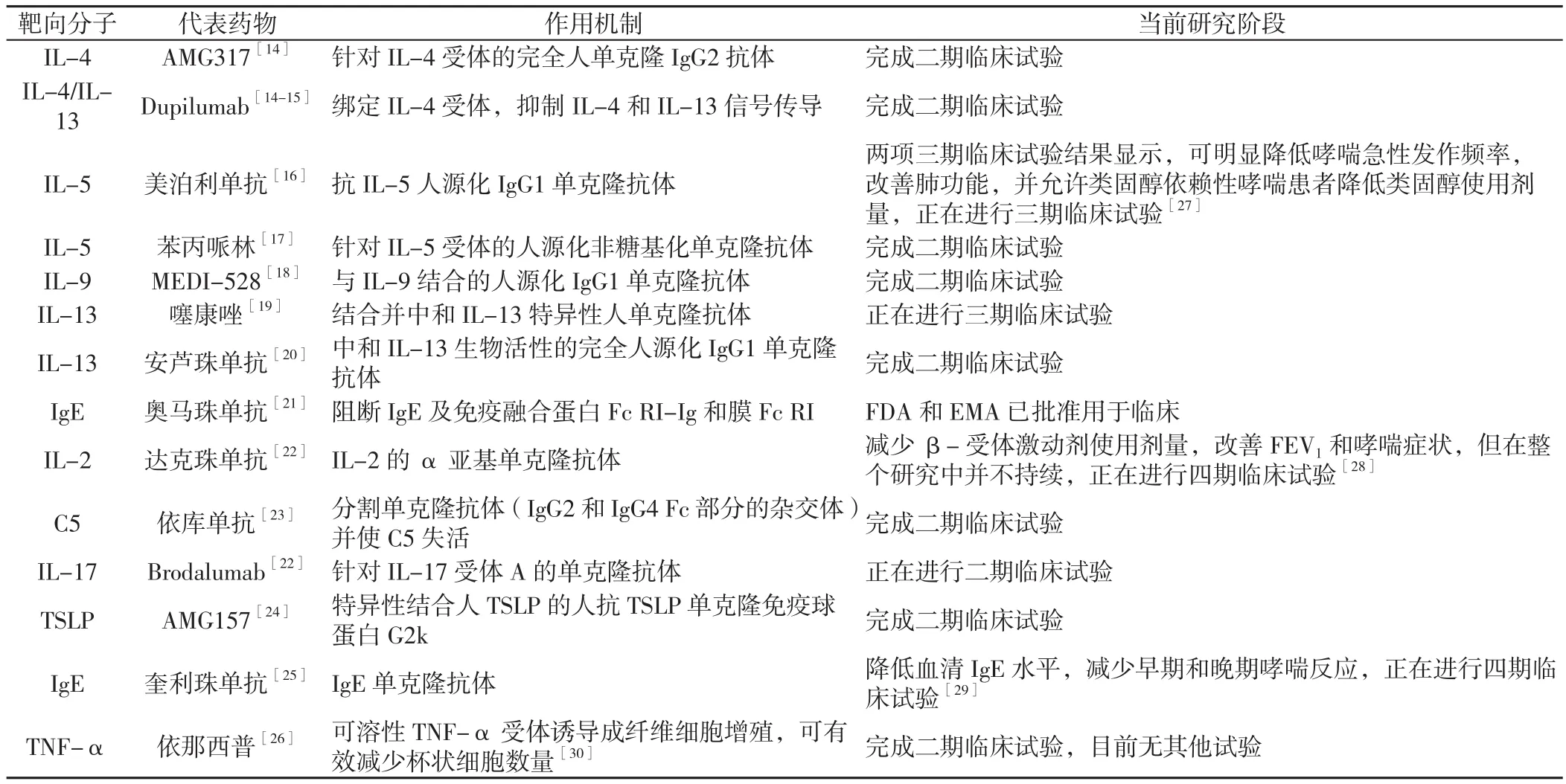
表1 哮喘患者分子靶向治疗药物Table 1 Molecular targeted drugs for asthma
据美国最近进行的一项调查报道,采用奥马珠单抗治疗的哮喘患者过敏反应或过敏反应事件发生率约为0.09%,其中部分患者不良反应发生在给药后2 h后,故过敏反应并不确定[41]。回顾超过15年的临床试验和现实生活中的临床应用,奥马珠单抗的安全性非常令人满意,虽然轻度不良事件可能发生,但系统和/或严重不良事件非常罕见[42]。未来我们仍需进一步评价奥马珠单抗的临床应用效果:(1)探索如何和何时减少或停止使用奥马珠单抗及停药后是否继续获益;(2)评估奥马珠单抗治疗严重哮喘时的类固醇作用;(3)评估奥马珠单抗是否适用于治疗儿童哮喘;(4)评价奥马珠单抗治疗多发性过敏性疾病(如过敏性哮喘和湿疹)的临床疗效;(5)评价奥马珠单抗治疗血清IgE水平极端升高者(如过敏性支气管肺曲霉病)和极端降低者(如非特应性个体)的临床疗效[37]。
6 小结
单克隆抗体不会经过肝脏和肾脏快速代谢,t1/2较长,故无需频繁给药。近年来,单克隆抗体已完成从鼠和嵌合化到人源化、完全人类化的过渡[17]。目前,其他几种与单克隆抗体类似的生物制剂正在进行评估,但一些针对IL-4、IL-5和IL-13的生物制剂治疗哮喘仍存在许多未知,如最佳治疗持续时间、最佳给药剂量、原型表型分离等。虽然对于新的疗法需要评估其长期有效性和安全性,但未来对于难治性哮喘患者的治疗方法将带来新希望[43]。
[1]BECKER A B,ABRAMS E M.Asthma guidelines:the Global Initiative for Asthma in relation to national guidelines[J].Curr Opin Allergy Clin Immunol,2017,17(2):99-103.DOI:10.1097/ACI.0000000000000346.
[2]ACCORDINI S,CORSICO A G,BRAGGION M,et al.The cost of persistent asthma in Europe:an international population-based study in adults[J].Int Arch Allergy Immunol,2013,160(1):93-101.DOI:10.1159/000338998.
[3]BRAIDO F.Failure in asthma control:reasons and consequences[J].Scientifica(Cairo),2013,5(2):54-92.DOI:10.1155/2013/549252.
[4]DUNN R M,WECHSLER M E.Anti-interleukin therapy in asthma[J].Clin Pharmacol Ther,2015,97(1):55-65.DOI:10.1002/cpt.11.
[5]CHUNG K F.Asthma phenotyping:a necessity for improved therapeutic precision and new targeted therapies[J].J Intern Med,2016,279(2):192-204.DOI:10.1111/joim.12382.
[6]HARPER R W,ZEKI A A.Immunobiology of the critical asthma syndrome[J].Clin Rev Allergy Immunol,2015,48(1):54-65.DOI:10.1007/s12016-013-8407-6.
[7]CHUNG K F,ADCOCK I M.How variability in clinical phenotypes should guide research into disease mechanisms in asthma[J].Ann Am Thorac Soc,2013,10(Suppl):S109-117.DOI:10.1513/AnnalsATS.201304-087AW.
[8]KEARLEY J,ERJEFALT J S,ANDERSSON C,et al.IL-9 governs allergen-induced mast cell numbers in the lung and chronic remodeling of the airways[J].Am J Respir Crit Care Med,2011,183(7):865-875.DOI:10.1164/rccm.200909-1462OC.
[9]JIN Y,DENG Z,CAO C,et al.IL-17 polymorphisms and asthma risk:a meta-analysis of 11 single nucleotide polymorphisms[J].J Asthma,2015,52(10):981-988.DOI:10.3109/02770903.2015.1044251.
[10]WENZEL S E.Asthma phenotypes:the evolution from clinical to molecular approaches[J].Nat Med,2012,18(5):716-725.DOI:10.1038/nm.2678.
[11]GARCIA G,MAGNAN A,CHIRON R,et al.A proof-ofconcept,randomized,controlled trial of omalizumab in patients with severe,difficult-to-control,nonatopic asthma[J].Chest,2013,144(2):411-419.DOI:10.1378/chest.12-1961.
[12]DAHLEN S E.Asthma phenotyping:noninvasive biomarkers suitable for bedside science are the next step to implement precision medicine[J].J Intern Med,2016,279(2):205-207.DOI:10.1111/joim.12466.
[13]MITCHELL P D,EL-GAMMAL A I,O'BYRNE P M.Emerging monoclonal antibodies as targeted innovative therapeutic approaches to asthma[J].Clin Pharmacol Ther,2016,99(1):38-48.DOI:10.1002/cpt.284.
[14]WENZEL S,FORD L,PEARLMAN D,et al.Dupilumab in persistent asthma with elevated eosinophil levels[J].N Engl J Med,2013,368(26):2455-2466.DOI:10.1056/NEJMoa1304048.
[15]GOUR N,WILLS-KARP M.IL-4 and IL-13 signaling in allergic airway disease[J].Cytokine,2015,75(1):68-78.DOI:10.1016/j.cyto.2015.05.014.
[16]BEL E H,WENZEL S E,THOMPSON P J,et al.Oral glucocorticoid-sparing effect of mepolizumab in eosinophilic asthma[J].N Engl J Med,2014,371(13):1189-1197.DOI:10.1056/NEJMoa1403291.
[17]LAVIOLETTE M,GOSSAGE D,GAUVREAU G,et al.Effects of benralizumab on airway eosinophils in asthmatic patients with sputum eosinophilia[J].J Allergy Clin Immunol,2013,132(5):1086-1096.e1085.DOI:10.1016/j.jaci.2013.05.020.
[18]OH C K,LEIGH R,MCLAURIN K K,et al.A randomized,controlled trial to evaluate the effect of an anti-interleukin-9 monoclonal antibody in adults with uncontrolled asthma[J].Respir Res,2013,14:93.DOI:10.1186/1465-9921-14-93.
[19]HANANIA N A,NOONAN M,CORREN J,et al.Lebrikizumab in moderate-to-severe asthma:pooled data from two randomised placebo-controlled studies[J].Thorax,2015,70(8):748-756.DOI:10.1136/thoraxjnl-2014-206719.
[20]BRIGHTLING C E,CHANEZ P,LEIGH R,et al.Efficacy and safety of tralokinumab in patients with severe uncontrolled asthma:a randomised,double-blind,placebo-controlled,phase 2b trial[J].Lancet Respir Med,2015,3(9):692-701.DOI:10.1016/S2213-2600(15)00197-6.
[21]HAMS E,ARMSTRONG M E,BARLOW J L,et al.IL-25 and type 2 innate lymphoid cells induce pulmonary fibrosis[J].Proc Natl Acad Sci U S A,2014,111(1):367-372.DOI:10.1073/pnas.1315854111.
[22]BUSSE W W,HOLGATE S,KERWIN E,et al.Randomized,double-blind,placebo-controlled study of brodalumab,a human anti-IL-17 receptor monoclonal antibody,in moderate to severe asthma[J].Am J Respir Crit Care Med,2013,188(11):1294-1302.DOI:10.1164/rccm.201212-2318OC.
[23]SMITH S G,WATSON B,CLARK G,et al.Eculizumab for treatment of asthma[J].Expert Opin Biol Ther,2012,12(4):529-537.DOI:10.1517/14712598.2012.668517.
[24]GAUVREAU G M,O'BYRNE P M,BOULET L P,et al.Effects of an anti-TSLP antibody on allergen-induced asthmatic responses[J].N Engl J Med,2014,370(22):2102-2110.DOI:10.1056/NEJMoa1402895.
[25]GAUVREAU G M,HARRIS J M,BOULET L P,et al.Targeting membrane-expressed IgE B cell receptor with an antibody to the M1 prime epitope reduces IgE production[J].Sci Transl Med,2014,6(243):243ra285.DOI:10.1126/scitranslmed.3008961.
[26]HOLGATE S T,NOONAN M,CHANEZ P,et al.Efficacy and safety of etanercept in moderate-to-severe asthma:a randomised,controlled trial[J].Eur Respir J,2011,37(6):1352-1359.DOI:10.1183/09031936.00063510.
[27]CHUPP G L,BRADFORD E S,ALBERS F C,et al.Efficacy of mepolizumab add-on therapy on health-related quality of life and markers of asthma control in severe eosinophilic asthma(MUSCA):a randomised,double-blind,placebo-controlled,parallelgroup,multicentre,phase 3b trial[J].Lancet Respiratory Medicine,2017,5(5):390-398.DOI:10.1016/s2213-2600(17)30125-x.
[28]BUSSE W W,ISRAEL E,NELSON H S,et al.Daclizumab improves asthma control in patients with moderate to severe persistent asthma:a randomized,controlled trial[J].Am J Respir Crit Care Med,2008,178(10):1002-1008.DOI:10.1164/rccm.200708-1200OC.
[29]HARRIS J M,ROMEO M,BRADLEY M S,et al.A randomized trial of the efficacy and safety of quilizumab in adults with inadequately controlled allergic asthma[J].Respir Res,2016,17(1):29-33.DOI:10.1186/s12931-016-0347-2.
[30]YILMAZA O,KARAMAN M,BAGRIYANIK H A,et al.Comparison of TNF antagonism by etanercept and dexamethasone on airway epithelium and remodeling in an experimental model of asthma[J].Int Immunopharmacol,2013,17(3):768-773.DOI:10.1016/j.intimp.2013.08.021.
[31]FAJT M L,WENZEL S E.Asthma phenotypes and the use of biologic medications in asthma and allergic disease:the next steps toward personalized care[J].J Allergy Clin Immunol,2015,135(2):299-310.DOI:10.1016/j.jaci.2014.12.1871.
[32]CHARRIOT J,GAMEZ A S,HUMBERT M,et al.Targeted therapies in severe asthma:the discovery of new molecules[J].Rev Mal Respir,2013,30(8):613-626.DOI:10.1016/j.rmr.2013.02.018.
[33]WALSH G M.An update on biologic-based therapy in asthma[J].Immunotherapy,2013,5(11):1255-1264.DOI:10.2217/imt.13.118.
[34]ARYAN Z,COMPALATI E,CANONICA G W,et al.Allergenspecific immunotherapy in asthmatic children:from the basis to clinical applications[J].Expert Rev Vaccines,2013,12(6):639-659.DOI:10.1586/erv.13.45.
[35]LAI T,WANG S,XU Z,et al.Long-term efficacy and safety of omalizumab in patients with persistent uncontrolled allergic asthma:a systematic review and meta-analysis[J].Sci Rep,2015,5:8191.DOI:10.1038/srep08191.
[36]TSABOURI S,TSERETOPOULOU X,PRIFTIS K,et al.Omalizumab for the treatment of inadequately controlled allergic rhinitis:a systematic review and meta-analysis of randomized clinical trials[J].J Allergy Clin Immunol Pract,2014,2(3):332-340.DOI:10.1016/j.jaip.2014.02.001.
[37]NORMANSELL R,WALKER S,MILAN S J,et al.Omalizumab for asthma in adults and children[J].Cochrane Database Syst Rev,2014,13(1):CD003559.DOI:10.1002/14651858.CD003559.
[38]STORMS W,BOWDISH M S,FARRAR J R.Omalizumab and asthma control in patients with moderate-to-severe allergic asthma:a 6-year pragmatic data review[J].Allergy Asthma Proc,2012,33(2):172-177.DOI:10.2500/aap.2012.33.3527.
[39]LONG A,RAHMAOUI A,ROTHMAN K J,et al.Incidence of malignancy in patients with moderate-to-severe asthma treated with or without omalizumab[J].J Allergy Clin Immunol,2014,134(3):560-567,e4.DOI:10.1016/j.jaci.2014.02.007.
[40]BUSSE W,BUHL R,FERNANDEZ VIDAURRE C,et al.Omalizumab and the risk of malignancy:results from a pooled analysis[J].J Allergy Clin Immunol,2012,129(4):983-989,e6.DOI:10.1016/j.jaci.2012.01.033.
[41]COX L,LIEBERMAN P,WALLACE D,et al.American Academy of Allergy,Asthma & Immunology/American College of Allergy,Asthma & Immunology Omalizumab-Associated Anaphylaxis Joint Task Force follow-up report[J].J Allergy Clin Immunol,2011,128(1):210-212.DOI:10.1016/j.jaci.2011.04.010.
[42]PASSALACQUA G,MATUCCI A,VULTAGGIO A,et al.The safety of monoclonal antibodies in asthma[J].Expert Opin Drug Saf,2016,15(8):1087-1095.DOI:10.1080/14740338.2016.1186641.
[43]KIM A S,DOHERTY T A.New and emerging therapies for asthma[J].Ann Allergy Asthma Immunol,2016,116(1):14-17.DOI:10.1016/j.anai.2015.08.001.

