新鱼腥草素钠对小鼠鲍曼不动杆菌肺感染模型的保护作用
张怡敏,周雪宁,张宏方,环 诚,叶峥嵘
(1.陕西中医药大学病原微生物及检验教研室,陕西 咸阳 712046;2.陕西中医药大学第一附属医院检验科,陕西 咸阳 712000)
鲍曼不动杆菌为非发酵革兰阴性杆菌,广泛存在于自然界,属于条件致病菌[1-2]。研究[3]表明,鲍曼不动杆菌已经成为医院获得性感染的重要病原菌,主要存在于重症监护病房和呼吸科,常引起呼吸系统感染,也可引发菌血症、手术部位感染等。鲍曼不动杆菌感染致死率接近50%。此外,由于细菌耐药的现象愈发严重,鲍曼不动杆菌的治疗变得愈加困难[4]。因此,临床上迫切需要发展针对鲍曼不动杆菌的新疗法和干预策略。
鱼腥草是一种传统中药,其性味辛寒,具有清热解毒、消肿排脓、利尿通淋等功效,可用于治疗肺脓溃疡、肺热咳喘、热痢热淋、水肿、脚气、尿路感染、痈肿疮毒等症,因此鱼腥草往往用于治疗肺病、泌尿系统疾病[5-6]。鱼腥草素是传统中药鱼腥草的主要活性成分,化学名称为癸酰乙醛,现代医学认为其具有抗菌、增强机体免疫力等多种作用[7]。由于该物质不稳定,目前临床上常使用十二酰乙醛的亚硫酸氢钠加成物,即新鱼腥草素钠。本研究通过制备小鼠鲍曼不动杆菌感染的肺炎模型,预先给予新鱼腥草素钠治疗,观察鱼腥草素对鲍曼不动杆菌性肺炎的防治效果。
1 材料
1.1 动物 80只雄性C57BL/6小鼠,8~12周龄,购自空军军医大学实验动物中心(小鼠合格证编号:20150073),饲养于12 h光照/12 h黑暗的环境中,能够自由摄取食物和饮水。
1.2 菌株 陕西中医药大学第一附属医院重症监护病房分离的鲍曼不动杆菌菌株,经过法国生物梅里埃API鉴定系统常规鉴定。
1.3 试剂 小鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素-1β(interleukin-1β, IL-1β) ELISA检测试剂盒:上海润裕生物科技有限公司;新鱼腥草素钠注射液:江西瑞金三九药业有限公司。
1.4 仪器 BX53M光学显微镜:日本奥林巴斯公司;Appliskan 多功能读数仪:美国赛默飞世尔公司。
2 方法
2.1 菌液制备 将临床分离的鲍曼不动杆菌接种至琼脂糖培养板,放置于37 ℃细菌培养箱中培养过夜,用灭菌牙签挑取单个菌落转接至含5~8 mL LB培养液的摇菌管中,置于摇床中37 ℃、180 r/min振荡培养12 h,取5 mL细菌液4 000 r/min离心10 min,收集沉淀,采用1 mL无菌生理盐水重悬,用比浊法测定并调整菌液浓度为1×108集落形成单位(colony-forming units, CFU)/mL。
2.2 模型制备 80只C57BL/6雄性小鼠,体质量为18~20 g,根据随机数字表进行完全随机化分组,分为对照组、肺炎模型组、低剂量(5 mg/kg)新鱼腥草素钠组和高剂量(10 mg/kg)新鱼腥草素钠组,每组20只,各组小鼠于模型制备前4 d和前1 d,通过腹腔注射环磷酰胺(50 mg/kg) ,以抑制小鼠免疫功能,其中低剂量新鱼腥草素钠组和高剂量新鱼腥草素钠组在手术前4 d开始每天通过腹腔注射给予新鱼腥草素钠注射液,持续至实验结束。小鼠经4%戊巴比妥钠(40 mg/kg)腹腔注射麻醉,用注射器将100 μL菌液注入气道,对照组注射等量生理盐水,注射完毕,待小鼠复苏后正常饲养,观察小鼠生存状态,根据文献[8]介绍的方法进行,若小鼠接种后出现明显的呼吸急促、活动减少、反应迟钝、毛发杂乱等表现,表明模型复制成功。
2.3 细菌学定量 在接种后24、72 h每组分别用颈椎脱臼方式处死5只小鼠,摘除肺组织,加入适量无菌生理盐水后匀浆,通过70 μm孔径的滤膜过滤,用无菌生理盐水10倍稀释后取100 μL样品接种至琼脂培养板进行37 ℃培养过夜,计数鲍曼不动杆菌的菌落数量。
2.4 小鼠肺组织病理学观察 每组各取小鼠5只,在接种后72 h处死小鼠,收集右侧肺组织,经4%多聚甲醛固定,石蜡包埋,切片,苏木精-伊红(hematoxylin-eosin,HE)染色,观察比较各组小鼠肺组织病理学变化。
2.5 支气管肺泡冲洗液(bronchoalveolar lavage fluid,BALF)炎性细胞检测 每组各取小鼠5只,同样方法麻醉小鼠,切开气管,注入0.5 mL PBS溶液进行支气管肺泡灌洗,反复3次。将回收到的液体混匀,收集BALF中全部细胞,用血细胞计数仪计数,Hema-3染色后用细胞涂片进行细胞分类。
2.6 ELISA检测 每组各取小鼠5只,小鼠处死前通过心脏采血方法收集1 mL血液,分离血清,检测血清中细胞因子TNF-α和IL-1β水平。

3 结果
3.1 各组小鼠状态观察 在麻醉、插管、接种等操作过程中无小鼠死亡,对照组小鼠活动、进食无异常。肺炎模型组小鼠接种鲍曼不动杆菌后6 h,出现明显的呼吸急促、活动减少、反应迟钝的表现;接种后24 h,上述症状进一步加重,并出现摄食减少、毛发杂乱、蜷缩、浑身颤抖等病变加重的征象;72 h后小鼠出现严重的呼吸困难、反应迟钝、浑身颤抖、体质量减轻等表现。新鱼腥草素钠组小鼠接种鲍曼不动杆菌后也出现呼吸急促、活动减少的现象,但是与肺炎模型组相比,症状较为轻微。
3.2 各组小鼠肺内和血液中细菌计数比较 在检测的各个时间点中,对照组小鼠肺组织中未检出细菌,肺炎模型组小鼠肺内和血液中细菌数量显著增加(P<0.05)。新鱼腥草素钠组小鼠肺内和血液中细菌数量明显少于肺炎模型组(P<0.05),其中高剂量新鱼腥草素钠组治疗效果优于低剂量新鱼腥草素钠组(P<0.05)。见表1。

表1 各组小鼠接种鲍曼不动杆菌后肺内和血液中细菌计数
注:与肺炎模型组比较,*P<0.05;与低剂量新鱼腥草素钠组比较,#P<0.05
3.3 各组小鼠肺组织病理观察 肺炎模型组小鼠术后72 h肺组织呈现严重的炎症变化,包括支气管管壁增厚、支气管扩张、单核细胞渗出,肺间质重度充血等典型的肺炎病理改变。在给予新鱼腥草素钠治疗后,小鼠肺部炎症明显减轻,表现为少量的间质充血、水肿和白细胞渗出。而高剂量新鱼腥草素钠治疗的效果更为明显。见图1。
3.4 各组小鼠BALF中炎性细胞水平比较 与对照组相比,肺炎模型组小鼠BALF中炎性细胞明显增加(P<0.05);与肺炎模型组相比,经过新鱼腥草素钠治疗的小鼠BALF中炎性细胞明显增加(P<0.05),其中中性粒细胞占白细胞的比例也更高(P<0.05)。见表2。
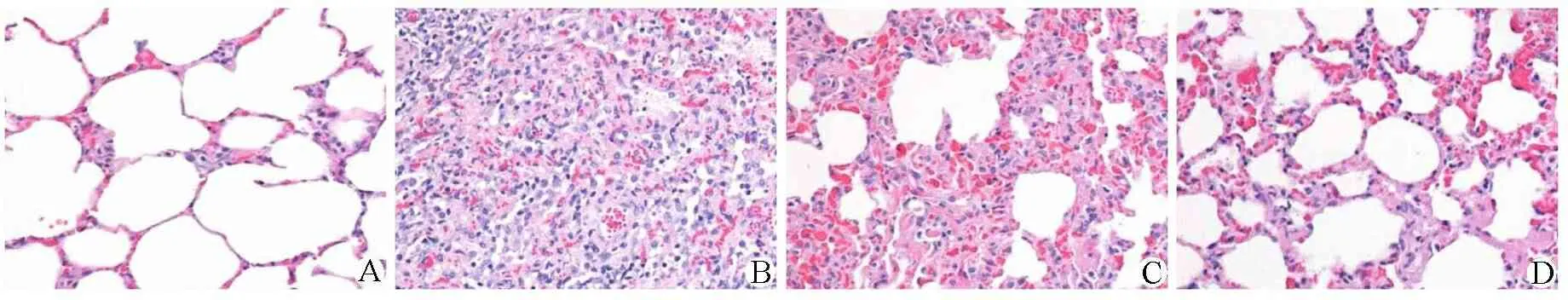

注:A.对照组;B.肺炎模型组;C.低剂量新鱼腥草素钠组;D.高剂量新鱼腥草素钠组
注:与对照组比较,△P<0.05;与肺炎模型组比较,*P<0.05
3.5 各组小鼠BALF中TNF-α和IL-1β水平比较 与对照组比较,肺炎模型组小鼠TNF-α、IL-1β水平显著升高(P<0.05);在给予新鱼腥草素钠治疗后,治疗组BALF中TNF-α、IL-1β水平均高于肺炎模型组(P<0.05),其中高剂量新鱼腥草素钠组又明显高于低剂量新鱼腥草素钠组(P<0.05)。结果提示新鱼腥草素钠对小鼠免疫功能的促进作用具有剂量依赖性。见表3。
4 讨论
随着临床大量抗生素的应用,鲍曼不动杆菌的耐药性愈加严重,鲍曼不动杆菌感染已经成为临床难控制的感染性疾病之一[9-11]。开发新的有效药物控制鲍曼不动杆菌感染是目前研究的重要方向。由于鲍曼不动杆菌是机会致病菌,通常情况下不会导致免疫力正常的人和动物致病。针对这一问题,在本实验中预先给予小鼠环磷酰胺处理。环磷酰胺是常用的烷化剂类免疫抑制剂,常用于器官移植或者自身免疫性疾病[12],经过环磷酰胺预处理的小鼠体内免疫功能下降,使得鲍曼不动杆菌能够成功感染小鼠。在本研究中,笔者利用临床分离的鲍曼不动杆菌菌株通过呼吸道接种的方式制备了小鼠肺炎模型。鲍曼不动杆菌可以在小鼠肺内增殖并在肺外快速传播,导致小鼠发生菌血症和肺炎。这种模型一定程度上模拟了临床鲍曼不动杆菌感染导致肺炎的病理过程。

表3 各组小鼠BALF中TNF-α和IL-1β水平比较
注:与对照组比较,△P<0.05;与肺炎模型组比较,
*P<0.05;与低剂量新鱼腥草素钠组比较,#P<0.05
新鱼腥草素钠在临床上作为重要的辅助用药常用于呼吸系统感染性疾病的治疗,对卡他球菌、流感杆菌、肺炎球菌、金黄色葡萄球菌等有明显抑制作用[13-17]。研究表明,其能够增强机体免疫力,具有抑制病原微生物以及抗肿瘤作用[18-19]。在本研究中,小鼠接种大量鲍曼不动杆菌后,肺和血液中细菌增加,由于自身免疫功能受到抑制,白细胞数量不足,不能够充分激活固有免疫反应,表现为白细胞升高受限,释放细胞因子不足,其结果是不能够快速清除体内细菌,造成肺严重的炎性反应和组织损伤,而经过新鱼腥草素钠治疗的小鼠,肺内和血循环中细菌的数量显著减少,肺组织损伤程度较轻微,BALF中白细胞数量显著高于未给予新鱼腥草素钠治疗的小鼠,TNF-α和IL-1β作为急性炎症过程中重要细胞因子,主要由单核巨噬细胞和中性粒细胞分泌产生,因此这两种细胞因子水平反映炎性反应程度以及单核巨噬细胞和中性粒细胞的功能。肺炎模型组小鼠经过环磷酰胺处理,其炎性反应受到一定程度的抑制,但仍能够增生和活化,而新鱼腥草素钠治疗后,小鼠体内免疫反应能力显著提高,表现为细胞因子水平增加更为明显,说明新鱼腥草素钠能够提高机体免疫力,促进白细胞活化,增加细胞因子分泌。
综上,本次研究结果表明,新鱼腥草素钠能够显著改善鲍曼不动杆菌感染小鼠的免疫力并抑制鲍曼不动杆菌在体内增殖,针对这一现象进行深入研究可望为鲍曼不动杆菌的防治提供更多的实验基础。
[1] YANG J J,WANG J T,CHENG A,et al.Impact of broad-spectrum antimicrobial treatment on the ecology of intestinal flora[J].J Microbiol Immunol Infect,2017.DOI: 10.1016/j.jmii.2016.12.009.
[2] SMILJANIC M,KAASE M,AHMAD-NEJAD P,et al.Comparison of in-house and commercial real time-PCR based carbapenemase gene detection methods inEnterobacteriaceaeand non-fermenting gram-negative bacterial isolates[J].Ann Clin Microbiol Antimicrob,2017,16(1):48.
[3] TORRES R M C,CRUZ M M D,PÉRISSÉ A R S,et al.High HIV infection prevalence in a group of men who have sex with men (MSM)[J].Braz J Infect Dis,2017,21(6):596-605.
[4] 袁吕江,李学刚,何红梅.辛酰乙醛亚硫酸钠抗菌和对小鼠免疫影响的研究[J].中医药信息,2004,21(6):51-53.
[5] 袁吕江,李学刚,何红梅.鱼腥草素同系物对小鼠免疫影响的研究[J].中医药学报,2004,32(5):25-28.
[6] MATHLOUTHI N,BEN LAMINE Y,SOMAI R,et al.Incidence of OXA-23 and OXA-58 carbapenemases coexpressed in clinical isolates of acinetobacter baumannii in tunisia[J].Microb Drug Resist,2017.DOI: 10.1089/mdr.2016.0306.
[7] YANG H,WANG W S,TAN Y,et al.Investigation and analysis of the characteristics and drug sensitivity of bacteria in skin ulcer infections[J].Chin J Traumatol,2017,20(4):194-197.
[8] 肖舒心,赵旭,郭蓓宁.采用耳窥镜直视下气管插管法构建小鼠鲍曼不动杆菌肺炎模型[J].中华感染与化疗杂志,2015,15(1):51-56.
[9] TSACHOURIDOU O,GEORGIOU A,NANOUDIS S,et al.Prolonged and high dosage of tigecycline-successful treatment of spondylodiscitis caused by multidrug-resistantAcinetobacterbaumannii: a case report[J].Med Case Rep,2017,11(1):186.
[10] 邵兰,于庆海,徐静华,等.合成鱼腥草素对环磷酰胺模型小鼠免疫功能的影响[J].沈阳药科大学学报,2000,17(2):133-135.
[11] 邵兰,于庆海,吴红艳,等.合成鱼腥草素对小鼠免疫功能的影响[J].沈阳药科大学学报,1999,16(3):56-58.
[12] CHENG A,CHUANG Y C,SUN H Y,et al.Should we treat patients with only one set of positive blood cultures for extensively drug-resistantAcinetobacterbaumanniithe same as multiple sets?[J].PLoS One,2017,12(7):e0180967.
[13] LARCHER R,PANTEL A,ARNAUD E,et al.First report of cavitary pneumonia due to community-acquiredAcinetobacterpittii,study of virulence and overview of pathogenesis and treatment[J].BMC Infect Dis,2017,17(1):477.
[14] HENDRA R,KELLER P A.Phytochemical studies on two Australian Anigozanthos plant species[J].J Nat Prod,2017,80(7):2141-2145.
[15] 宋莎莎,杨乐,俞令凯,等.合成鱼腥草素对溃疡性结肠炎小鼠的保护作用[J].长江大学学报(自然科学版),2014,11(18):67-69.
[16] 楼希文,栾洋,姜宝红,等.鱼腥草素钠对BALB/c小鼠的急性毒性及其对细胞的损伤[J].中国药理学与毒理学杂志,2012,26(5):653-657.
[17] 吴海芬,叶玉娣.鱼腥草素抗菌活性的实验研究[J].中国中医药科技,2012,19(5):418-419.
[18] 杜爱芳,胡松华,鲍伟华.合成鱼腥草素对单核-巨噬细胞吞噬功能的影响[J].中兽医医药杂志,1998(3):7-9.
[19] RODRIGO-TROYANO A,SIBILA O.The respiratory threat posed by multidrug resistant gram-negative bacteria[J].Respirology,2017,22(7):1288-1299.

