艾灸对腹泻型肠易激综合征模型大鼠血清白细胞介素-6水平和结肠组织β-防御素-2及其mRNA表达的影响
储浩然,吴立斌,程红亮,吴生兵,蔡荣林,龙小娜,李 难,夏焕娟,吴克宇
(1.安徽中医药大学第二附属医院,安徽 合肥 230061;2.安徽中医药大学研究生院,安徽 合肥 230012;3.安徽中医药大学科研实验中心,安徽 合肥 230038;4.安徽中医药大学针灸经络研究所,安徽 合肥 230038)
肠易激综合征(irritable bowel syndrome,IBS)是一种慢性的肠道功能疾病,并存在多种亚型,其中以腹泻型肠易激综合征(diarrhea predominant irritable bowel syndrome, D-IBS)最为常见[1]。IBS对患有该病人群的身心和经济造成了巨大压力[2-3],这使得有关IBS的治疗与发病机制近年来一直被人们所关注,而其发病机制至今说法不一,如肠-脑轴功能紊乱、肠道炎性反应[4-5]。有研究表明,IBS发病与肠道黏膜炎性反应关系密切[6]。
对于D-IBS的治疗,现代医学目前主要以对症治疗为主。临床研究发现,艾灸疗法对于D-IBS疗效明确,且相对于现代医学的常规方法,能更大程度地缓解症状,有更高的治愈率[7]。也有动物实验证实,艾灸可促进D-IBS大鼠肠道黏膜功能修复,从而使症状缓解[8],但其作用途径与机制仍不明确,需要进一步探究。
本研究通过观察艾灸对D-IBS大鼠血清白细胞介素-6(interleukin-6, IL-6)水平和结肠组织β-防御素-2(beta-defensin-2, BD-2)蛋白及其mRNA表达的影响,以IL-6、BD-2与Toll样受体-4(Toll like receptor 4,TLR4)/核因子-κB(nuclear factor kappaB,NF-κB)信号通路的关系为依据,判断艾灸天枢、上巨虚治疗D-IBS的机制是否与TLR4/NF-κB通路有关联,初步揭示艾灸抑制D-IBS炎性反应的机制。
1 材料
1.1 实验动物与分组 选取SPF级成年雄性SD大鼠30只,体质量(190±15)g,购自安徽医科大学实验动物中心,生产许可证号为SCXK(皖)2011-002。实验动物房由安徽中医药大学实验中心提供,室温(26±1)℃,湿度50%~60%,12 h明暗交替环境。大鼠适应性饲养1周后,随机选取10只作为空白对照组,另20只复制D-IBS模型。模型复制完成后,按随机数字表法分为模型组和艾灸组,每组10只。
1.2 主要试剂 IL-6 ELISA试剂盒(批号 E20170101A):上海源叶生物科技有限公司;β-actin(批号 16AV0210):北京中杉金桥生物科技有限公司;BD-2试剂盒(批号 AC09102356):Bioss公司;电化学发光试剂盒(批号 QE218149):Thermo公司;Trizol试剂(批号 101002):Invitrogen公司;逆转录试剂盒(批号 00287813):Thermo公司。
1.3 主要仪器 酶标仪(型号 Multiskan FC)、荧光定量PCR仪(型号PIKOREAL 96):Thermo公司;电泳仪(型号 EPS 300):Tanon公司。
2 方法
2.1 模型复制方法与模型评价 采用番泻叶灌胃结合局部束缚的方法复制大鼠D-IBS模型[9]。将随机选取的10只大鼠作为空白对照组,仅予以生理盐水灌胃(剂量与番泻叶水煎剂保持一致),其余20只大鼠予以番泻叶(0.3 g/mL)灌胃。灌胃1 h后用宽透明胶带缠住大鼠上肢和肩部,限制其上肢活动,持续1 h,灌胃与束缚每日1次,持续2周。模型复制结束后通过统计并对比空白对照组(10只)与其他大鼠(20只)稀便率评价模型复制效果。即将每组大鼠分开放置于铁笼中,铁笼下放置垫有滤纸的托盘,6 h后,对各组大鼠总排便粒数和稀便数进行计数,最后计算稀便率(稀便数/总排便粒数×100%)。将各组大鼠稀便率进行统计分析比较,若稀便率较空白对照组显著升高(P<0.05),则D-IBS模型复制成功,可进行下一步处理,若稀便率与空白对照组的差异无统计学意义(P>0.05),则模型复制不成功,分析失败原因后重新复制模型。
2.2 干预方法 模型复制结束后对艾灸组大鼠进行干预,空白对照组与模型组不采取干预措施。选取双侧天枢、上巨虚穴进行艾灸,使用直径为0.7 cm的无烟艾条,定位参考《实验针灸学》[10],每穴10 min,每日1次,持续1周。
2.3 大鼠结肠组织取材 大鼠使用10%水合氯醛(3 mL/kg)腹腔注射麻醉后,在距离肛门8 cm左右处截取一段长度约1 cm的肠道组织,用预冷生理盐水冲洗,并用滤纸吸干后迅速放入液氮罐中保存,随后存入-80 ℃冰箱,用时取出。
2.4 观察指标与检测方法
2.4.1 ELISA法测定大鼠血清IL-6浓度 以10%水合氯醛腹腔注射将大鼠麻醉后,抽取腹主动脉血,用冷冻离心机制备血清,完成后放置于-20 ℃冰箱中储存备用。按照IL-6 ELISA试剂盒说明书步骤测定样本OD值,根据标准孔OD值和标准品浓度绘制回归曲线,将样本OD值代入回归方程中计算每组大鼠血清IL-6浓度。
2.4.2 Western blot法检测大鼠结肠组织BD-2蛋白表达 取约100 mg组织样品,加入含PMSF裂解液进行裂解,在高速冷冻离心机中12 000 r/min离心15 min后收集上清液,将稀释的待测样本及内参蛋白β-actin加入SDS-PAGE胶加样孔内,完成电泳后,依次进行转膜、封闭,按说明书进行一抗和二抗的孵育,再使用电化学发光试剂盒处理PVDF膜,胶片条带使用北京科创锐新生物凝胶成像系统进行灰度分析,最后得出每组样本BD-2蛋白相对表达水平。
2.4.3 实时荧光定量PCR测定大鼠结肠组织BD-2 mRNA的表达 按照Trizol试剂和逆转录试剂盒说明书步骤,进行大鼠结肠组织总RNA的抽提纯化和cDNA的合成。β-actin上游引物为5′-CCCATCTATGAGGGTTACGC-3′,下游引物为5′-TTTAATGTCACGCACGATTTC-3′,长度为150 bp;BD-2上游引物为5′-GTAATTAGTGGGGTTCTACT-3′,下游引物为5′-ACCACGACGACAGCGGAGAA-3′,长度为167 bp。本次实验使用相对定量实验的分析方法,计算出目的基因相对表达倍数2-ΔΔCt。

3 结果
3.1 3组大鼠血清IL-6水平比较 与空白对照组比较,模型组大鼠血清IL-6含量显著升高(P<0.05);与模型组比较,艾灸组大鼠血清IL-6水平显著下降(P<0.05)。见图1。
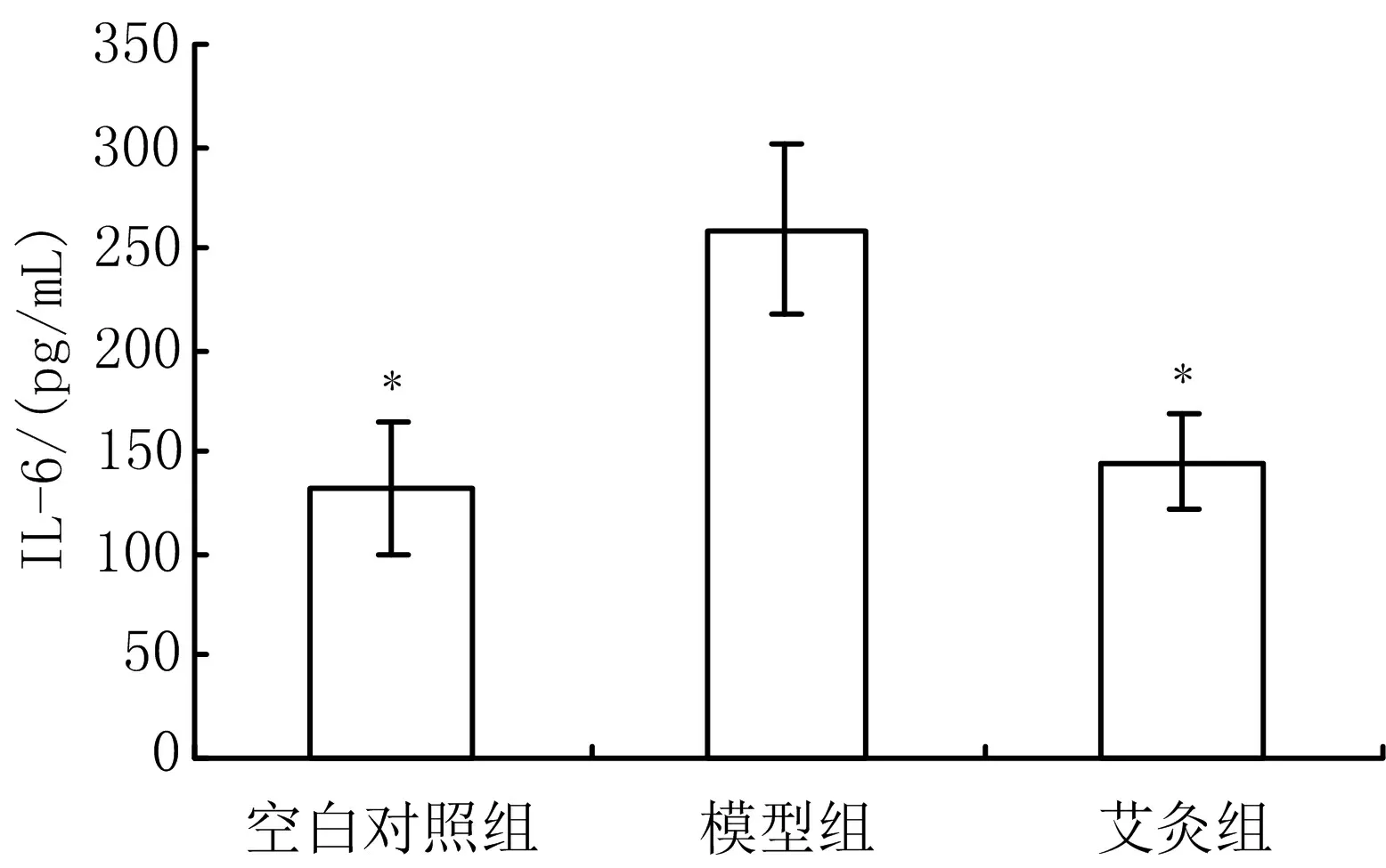
注:与模型组比较,*P<0.05
3.2 3组大鼠结肠组织BD-2蛋白表达水平比较 与空白对照组比较,模型组大鼠结肠组织BD-2表达水平显著升高(P<0.05);与模型组比较,艾灸组大鼠结肠组织BD-2水平显著下降(P<0.05)。见图2、图3。
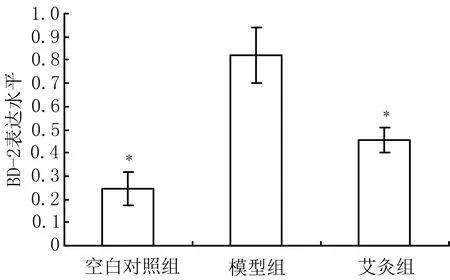
注:与模型组比较,*P<0.05
3.3 3组大鼠结肠组织BD-2 mRNA表达水平比较 与空白对照组比较,模型组大鼠结肠组织BD-2 mRNA表达水平显著升高(P<0.05);与模型组比较,艾灸组大鼠结肠组织BD-2 mRNA表达水平显著下降(P<0.05)。见图4。

图3 3组大鼠结肠组织BD-2蛋白表达水平

注:与模型组比较,*P<0.05
4 讨论
TLR4是一种可识别脂多糖信号并实现跨膜信号转导的受体。脂多糖信号通过D-IBS模型大鼠肠道黏膜细胞中TLR4被转导至细胞膜内,随后通过髓样分化因子88依赖途径使静息状态的NF-κB与其抑制蛋白解离并活化,NF-κB进入细胞核并诱导多种炎性因子表达,而其诱导产生的TNF-α、IL-6等炎性因子又可以激活静息状态的NF-κB,这样就形成了一系列级联反应参与的正反馈调节,炎性因子的过量表达使局部炎症不断加重,肠道黏膜结构和功能被破坏[11-12],最终产生腹痛、腹泻等症状。BD-2广泛存在于各种多细胞生物体内,是一种天然的抗菌肽,具有抗微生物活性[13],由NF-κB活化后进入细胞核与BD-2基因启动子区域结合诱导产生。因此,BD-2可受TLR4/NF-κB通路调节,BD-2在IBS患者结肠黏膜细胞中往往呈现高表达[14]。
D-IBS可归属于中医学“泄泻”“腹痛”等病范畴,其中不同的证候分型有不同的病机,如肝气乘脾证是由于肝失疏泄、木旺乘脾,使脾主运化功能失司,也有肾阳虚衰、脾失温煦形成的肾阳虚衰证,这些都可以导致大肠传化糟粕、主津的功能受影响,形成泄泻或腹痛。本次实验选取的天枢穴为大肠募穴,上巨虚为大肠下合穴,两者合募配用治疗腑病,可以调整大肠腑气机,止泻止痛,使其恢复正常功能。前期临床随机对照实验中,选用天枢、上巨虚配合其他辨证取穴方法治疗D-IBS,疗效确切[15]。对于该病的治疗,西医通常使用止泻剂、肠道解痉剂等药物对症治疗,中医对该病有多种治疗方法,艾灸为其中一种,通过临床实验发现,艾灸治疗D-IBS,相对于常规对症治疗,能更有效地控制症状且不易复发[16]。
本研究结果显示,艾灸天枢、上巨虚可以显著降低D-IBS模型大鼠血清IL-6和结肠组织BD-2蛋白及其mRNA的表达水平,而TLR4/NF-κB信号通路是IL-6和BD-2被诱导产生的重要途径之一,对IL-6高表达的小鼠细胞使用TLR4抑制剂(抗TLR4抗体)后,IL-6表达水平有所下降[17],BD-2蛋白及其mRNA的表达也受NF-κB抑制剂(咖啡酸苯乙酯)的影响而被抑制[18]。由此可以看出,艾灸天枢、上巨虚可能有类似于抑制TLR4/NF-κB信号通路的作用,其治疗D-IBS的过程可能是通过抑制TLR4/NF-κB通路降低IL-6以及BD-2的表达,与此同时,IL-6水平的下降本身也缓解了NF-κB激活后参与的正反馈调节,进一步使BD-2及其mRNA的表达降低,使炎性反应更有效地得到控制,促进机体恢复正常。
本研究初步探明,艾灸天枢、上巨虚对D-IBS大鼠血清IL-6水平和结肠组织BD-2的表达均有降低的作用,可能艾灸使TLR4/NF-κB信号通路受到抑制是这一作用产生的机制,但IL-6和BD-2的表达也受到TLR2介导的NF-κB或p38 MAPK信号通路等途径的影响[19-20],所以这一推测仍需要进一步的实验去验证。本实验为临床上艾灸天枢、上巨虚治疗D-IBS提供了部分理论依据,也为今后继续探索艾灸治疗D-IBS的机制提供实验依据。
[1] 崔立红,李超,王晓辉,等.肠易激综合征临床症状学及分型研究[J].解放军医药杂志,2014,26(2):1-2,6.
[2] LEE C, DOO E, CHOI J M, et al. The increased level of depression and anxiety in irritable bowel syndrome patients compared with healthy controls: systematic review and meta-analysis[J].J Neurogastroenterol Motil,2017,23(3):349-362.
[3] ZHANG F, XIANG W, LI C Y, et al. Economic burden of irritable bowel syndrome in China[J]. World J Gastroenterol,2016,22(47):10450-10460.
[4] STASI C, BELLINI M, GAMBACCINI D,et al. Neuroendocrine dysregulation in irritable bowel syndrome patients: a pilot study[J]. J Neurogastroenterol Motil,2017,23(3):428-434.
[5] 郭文涛,刘萍,董丽娜,等.腹泻型肠易激综合征患者肠黏膜优势菌的改变与Toll样受体2和4基因表达的相关研究[J].中华内科杂志,2016,55(7):541-543.
[6] LIU L, LIU B N, CHEN S, et al. Visceral and somatic hypersensitivity, autonomic cardiovascular dysfunction and low-grade inflammation in a subset of irritable bowel syndrome patients[J]. Journal of Zhejiang University-Science B(Biomedicine & Biotechnology),2014,15(10):907-914.
[7] 储浩然,黄学勇,李学军,等.艾灸治疗腹泻型肠易激综合征临床研究[J].安徽中医学院学报,2011,30(6):33-36.
[8] 周次利,吴璐一,吴蓓玲,等.艾灸及其生成物对腹泻型肠易激综合症模型大鼠内脏痛和结肠水液代谢的影响[J].世界科学技术:中医药现代化,2014,16(6):1261-1267.
[9] 赵妍,罗丹妮,陈颖,等.慢性束缚应激联合番泻叶灌胃法制备IBS-D大鼠模型的量效及时效关系评价[J].世界华人消化杂志,2017,25(15):1360-1367.
[10] 李忠仁.实验针灸学[M].北京:中国中医药出版社,2011:255-257.
[11]ZHANG H, CHEN W. Interleukin-6 inhibition by triptolide prevents inflammation in a mouse model of ulcerative colitis[J].Exp Ther Med,2017,14(3):2271-2276.
[12] FUJII M, NISHIDA A, IMAEDA H,et al.Expression of interleukin-26 is upregulated in inflammatory bowel disease[J].World J Gastroenterol,2017,23(30):5519-5529.
[13] MANKO A, MOTTA J P, COTTON J A,et al.Giardia co-infection promotes the secretion of antimicrobial peptides beta-defensin-2 and trefoil factor 3 and attenuates attaching and effacing bacteria-induced intestinal disease[J].PLoS One,2017,12(6):e0178647.
[14] SUNG J, MORALES W, KIM G,et al. Effect of repeated Campylobacter jejuni infection on gut flora and mucosal defense in a rat model of post infectious functional and microbial bowel changes [J].Neurogastroenterol Motil,2013,25(6):529-537.
[15] 储浩然,李难,程红亮.温针灸治疗肝郁脾虚型肠易激综合征疗效观察[J].上海针灸杂志,2015,34(5):424-425.
[16] 张蕊,徐亚莉,赵爱玲.铺灸电联治疗腹泻型肠易激综合征临床观察[J].针灸临床杂志,2012,28(5):41-43.
[17] OHTSU A, SHIBUTANI Y, SENO K, et al. Advanced glycation end products and lipopolysaccharides stimulate interleukin-6 secretion via the RAGE/TLR4-NF-κB-ROS pathways and resveratrol attenuates these inflammatory responses in mouse macrophages[J]. Experimental and Therapeutic Medicine,2017,14(5):4363-4370.
[18] CHEN L, SUN B B, WANG T, et al. Cigarette smoke enhances β-defensin 2 expression in rat airways via nuclear factor-κB activation[J]. European Respiratory Society,2010,36(3):638-645.
[19] HOJO K, TAMAI R, KOBAYASHI-SAKAMOTO M, et al. Etidronate down-regulates Toll-like receptor (TLR) 2 ligand-induced proinflammatory cytokine production by inhibiting NF-κB activation[J].Pharmacological Reports,2017,69(4):773-778.
[20] LEE H Y, TAKESHITA T, SHIMADA J, et al. Induction of beta defensing-2 by NTHi requires TLR2 mediated MyD88 and IRAK-TRAF6-p38MAPK signaling pathway in human middle ear epithelial cells [J/OL]. BMC Infectious Diseases, 2008,8:87[2017-9-28]. https://doi.org/10.1186/1471-2334-8-87. DOI:10.1186/1471-2334-8-87.

