胃上皮细胞经亚硝基化合物MNNG短时刺激后细胞形态、功能特性的变化
蔡洁,王梅
(1江阴市人民医院,江苏江阴214400;2江苏大学医学院)
肿瘤是一个全球性的重大公共卫生问题,目前在中国乃至世界,恶性肿瘤仍旧是第二大死亡原因,且发病率还在不断上升[1]。胃癌是最常见的恶性肿瘤之一,尤其在我国其新发病率已升至第2位,仅次于肺癌[2]。许多因素导致了胃癌的发生与发展,如饮食、吸烟、肥胖、环境、家族遗传以及慢性感染等都是主要的影响因素[3,4]。在中国,胃癌的发病率和病死率居高不下与中国人的饮食习惯息息相关,中国人偏爱腌制食品,而腌制品中含有大量致癌物质(如亚硝酰胺类化合物),这是胃癌发生的关键因素[5]。N-甲基-N′-硝基-N-亚硝基胍(MNNG)是一种人工合成的亚硝基化合物(NOCs),科研中经常用MNNG代替自然界中的亚硝酰胺类化合物来探究其在胃癌形成中的作用[6]。GES-1细胞系是永生化的胃上皮细胞系,是经SV40病毒转化人胃上皮细胞得到的,能在体外长期传代,因此被广泛用于胃上皮细胞恶性转化以及胃癌发生的相关研究中[7]。2014年3~ 8月,我们用MNNG短时刺激GES-1细胞,观察GES-1细胞形态和特性的变化,探讨其可能的原因,进一步了解MNNG在胃癌发生发展中的作用。
1 材料与方法
1.1 主要材料与试剂 GES-1细胞购自北京肿瘤防治研究所,化学致癌物MNNG(美国Sigma公司);GAPDH抗体(中国康为公司),E-cadherin抗体(美国Santa Cruz公司),N-cadherin抗体(美国Abcam公司),抗鼠Goat anti-mouse IgG (HRP,美国Santa Cruz公司),抗兔Goat anti-rabbit IgG (HRP,美国Santa Cruz公司),曝光液(美国Millipore公司);RPMI1640培养基(美国Gibco公司),胎牛血清(FBS,美国Gibco公司),0.25%胰蛋白酶T+E(美国Sigma公司),RIPA+PMSF(美国Vazyme公司),二甲基亚砜(DMSO,美国Sigma公司),蛋白预染Marker(美国MBI公司),结晶紫染料(中国艾然公司)。
1.2 实验方法
1.2.1 细胞培养 将GES-1细胞接种于含10% FBS的RPMI1640培养基,在37 ℃、5% CO2培养箱中培养,根据生长情况每隔2~3 d换培养液1次;当细胞融合度达到近80%时,按1∶3比例传代,然后继续培养。
1.2.2 MNNG短时刺激GES-1细胞 用适量DMSO溶解MNNG粉末,配成0.2 mol/L的MNNG溶液;用含10% FBS的RPMI1640培养液稀释MNNG溶液至1×10-5mol/L,滤器过滤。预先将适量的GES-1细胞种于6孔板中,培养24 h;加入1×10-5mol/L的MNNG溶液避光刺激0、4、8、12 h,接着撤去MNNG;用PBS缓冲液洗涤至少3次,用于后续实验。
1.2.3 细胞形态学观察 分别取GES-1细胞和经MNNG作用不同时间点的GES-1细胞,在倒置相差显微镜下观察细胞的形态,并拍照保存。
1.2.4 细胞增殖活性观察 采用平板克隆形成实验。将GES-1细胞和MNNG短时刺激的GES-1细胞消化计数,按1 000个细胞尽量均匀地种于直径3.5 cm细胞培养皿中;培养12 d后,PBS缓冲液洗涤至少3次;加4%多聚甲醛固定30 min,PBS缓冲液再洗涤3次;加结晶紫染色15 min,继续用PBS缓冲液洗涤干净;最后用照相机拍照,数出每个细胞培养皿中的细胞克隆数。实验至少重复3次。
1.2.5 细胞迁移能力观察 采用Transwell迁移实验。将GES-1细胞和MNNG短时刺激的GES-1细胞同时用胰酶消化,离心后用无血清RPMI1640培养液悬浮,计数后配成5×105/mL的细胞悬液。在24孔Transwell板下室加600 μL含10% FBS的RPMI1640营养液,上室内加入200 μL已配好的均匀细胞悬液,放入培养箱中培养12 h;取出上室,用4%多聚甲醛固定,棉签擦拭小室内未迁出的细胞;结晶紫染色15 min,PBS缓冲液洗净染液;在倒置显微镜的低倍镜下拍照,每孔随机拍摄6个视野,计数每个视野的细胞。实验至少重复3次。以穿膜细胞数表示细胞迁移能力,数量越多迁移能力越强。
1.2.6 细胞中上皮-间质转化(EMT)相关蛋白E-cadherin和N-cadherin检测 采用Western blotting法。收集GES-1细胞和经MNNG作用不同时间点的GES-1细胞,离心后弃去上清;在细胞沉淀中加入适量蛋白裂解液RIPA和蛋白酶抑制剂PMSF(250∶1),每5 min在振荡器上剧烈震荡1 min,共5次;置于预先预冷至4 ℃的高速离心机中,以12 000 r/min离心15 min;吸取上清液并记录其具体体积,用核酸蛋白测定仪检测每组上清的总蛋白浓度。再向上清中加入是其总体积1/4的Loading Buffer,混匀,沸水煮5 min,使蛋白变性。配置8%的聚丙烯酰胺凝胶,根据所测各组蛋白的浓度,计算出上样体积;按顺序加样后,恒压电泳,恒流转膜2 h,封闭1 h;用特异性单克隆抗体(E-cadherin、N-cadherin和GAPDH)孵育,4 ℃过夜。次日,用TBST洗膜液洗膜,孵育二抗;GAPDH用HRP标记抗鼠二抗孵育,E-cadherin和N-cadherin用HRP标记的抗兔二抗;37 ℃孵育1 h,再洗膜。最后,以曝光液为介质,用化学发光成像系统成像,保存图片;用Photoshop分析条带的灰度值,以灰度值大小来表示蛋白的相对表达量。实验至少重复3次。
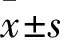
2 结果
2.1 MNNG短时刺激对GES-1细胞形态的影响 与正常GES-1细胞相比,MNNG刺激后的细胞更大,更扁平,边缘不清晰,形状不一,有些细胞成团块状生长;并且随着刺激时间的延长,部分细胞呈纺锤形或不规则形,比未刺激细胞更加细长。
2.2 MNNG短时刺激对GES-1细胞增殖能力的影响 GES-1细胞经MNNG刺激0、4、8、12 h时,其克隆数分别为(82.00±1.16)、(89.67±3.28)、(81.33±1.76)、(85.67±1.45)个,各时点GES-1细胞克隆数比较差异无统计学意义。
2.3 MNNG短时刺激对GES-1细胞迁移能力的影响 GES-1细胞经MNNG刺激0、4、8、12 h时,其穿膜细胞数分别为(83.00±2.89)、(149.00±5.20)、(265.70±6.06)、(491.00±8.74)个,刺激时间越长穿膜细胞数越多(P均<0.05)。
2.4 MNNG短时刺激对GES-1细胞E-cadherin、N-cadherin表达的影响 随着MNNG刺激时间延长,GES-1细胞E-cadherin表达逐渐降低而N-cadherin表达逐渐升高(P均<0.05)。见表1。
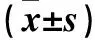
表1 MNNG短时刺激对GES-1细胞E-cadherin、N-cadherin表达的影响
注:与刺激0 h时相比,*P<0.05。
3 讨论
研究认为,胃癌的病因非常复杂,至今其发生的具体病因和相关机制仍不清楚,但饮食习惯一定是一个相当重要的影响因素。NOCs被认为是强有力的致癌物质,也是胃癌发生的重要危险因素之一,人工合成的MNNG是NOCs中典型的代表。在国内外的实验研究中,该化合物是常用于动物模型的诱导剂和致癌物,并已成功用MNNG在动物体内建立胃癌模型[6]。研究[8]发现,将一定浓度的MNNG避光作用于GES-1细胞,24 h后撤去MNNG溶液,这样高浓度长时间受刺激的GES-1细胞发生大量死亡,少量残存的细胞继续培养增殖,成为经MNNG诱导恶性转化后GES-1细胞株,即MC细胞株。MC细胞常被作为胃癌癌前病变细胞的体外模型,被广泛用于胃癌发生机制的研究[9]。但是,在实际生活或模拟实验中,一次性接受高浓度、长时间NOCs刺激的可能性比较小,通常都是低浓度短时间的刺激,而这类研究并不多。所以,本研究降低了MNNG浓度和刺激时间,侧重于低浓度短时处理GES-1细胞。在该浓度和时间作用下,GES-1细胞的活性基本不受影响,胞体变大扁平,轮廓不清,周边多呈毛刺状;有些细胞两端变细长,甚至呈纺锤形;大部分细胞生长无序,排列紊乱,成团块状生长,有类似肿瘤细胞的生长和形态学特点。但是,通过平板克隆实验,比较刺激后的GES-1细胞与正常GES-1细胞的增殖能力,发现并无明显差别。这可能是因为刺激力度有限,还未达到影响细胞增殖能力的程度。以上结果表明,低浓度短时MNNG刺激的GES-1细胞形态发生了一定变化,有恶性转化的趋势,但是其增殖能力还未有显著变化。
EMT是指在特定的生理或病理条件下,上皮细胞向间质细胞转化的现象[10]。在此过程中,上皮细胞发生质变,细胞失去极性,细胞间黏附性减弱,但获得能动性和侵袭性[11]。EMT表型的获得可促进细胞的迁移,破坏上皮样结构体系,是肿瘤发生发展乃至肿瘤干性获取的重要特征[12]。因此,EMT的异常活化在许多肿瘤的发生、侵袭和转移中起关键作用,如胃癌、乳腺癌、结肠癌、肺癌等。有报道[13]称,MNNG预处理的GES-1细胞和MC细胞形态向间质样变化,且迁移能力增强;经CCl2刺激后变化加剧,且获得了EMT表型。本研究结果显示,经MNNG低浓度短时刺激的GES-1细胞迁移能力增强,再结合考虑细胞形态学的变化,大胆提出MNNG使GES-1细胞发生了EMT转化的假设。
在EMT转化过程中,E-cadherin是关键的传递者,能通过加强细胞间黏附性来维持细胞极性并且组织上皮细胞排列[14],还参与细胞内信号传递,从而控制细胞成熟、分化、生长和能动性,故而可作为侵袭抑制基因。EMT异常活化会使E-cadherin表达下调,而向间质样蛋白N-cadherin转化;N-cadherin在EMT过程中表达上调[14],其依赖于细胞环境,促进黏附和迁移;但这两种特性受N-cadherin基因的不同部位调控,故而是相互独立的。本研究结果显示,MNNG短时刺激GES-1细胞后,细胞E-cadherin表达骤减,而N-cadherin表达急剧升高。这与假设相符,本研究所结果表明MNNG的确使GES-1细胞发生了EMT。
越来越多的证据显示,肿瘤的各级进程都可能触发EMT表型;胃癌的发生及其恶性特征就与E-cadherin突变相关,而N-cadherin表达与侵袭性胃癌相关[15],通过抑制EMT转化能增强化疗药物的疗效[16]。因此,EMT在肿瘤发生、转移、耐药、预后以及复发等阶段都起到关键作用。目前,引起肿瘤进程中EMT发生的机制有很多,比较被认可的是细胞因子发挥关键性作用,细胞因子通过调节转录因子的表达或者激活各种信号通路来诱导EMT发生。前列腺癌细胞受可溶性因子人胰岛素样生长因子(IGF1)刺激后,细胞中转录因子E盒结合锌指蛋白(ZEB1)表达上调,从而引起EMT转化[17]。白细胞介素6和转化生长因子β通过上调转录因子Snail和p-Smad3,同时活化JAK/STAT3通路来增强肺癌中EMT转化[18]。另外,Wnt/β-catenin信号通路和PI3K/AKT信号通路在胃癌的EMT发生中也扮演重要角色[15]。本研究中MNNG促使胃上皮细胞发生EMT转化的机制还不清楚,今后也可以从细胞因子或转录因子着手进行下一步研究。
综上所述,本研究发现化学致癌物MNNG短时刺激胃上皮细胞后,胃上皮细胞形态发生明显变化,细胞迁移能力增强,并且发生EMT转化,但诱导EMT发生的具体原因和机制还不清楚,这是今后需继续探索和研究的方向。
:
[1] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018[J]. CA Cancer J Clini, 2018,68 (1): 7-30.
[2] Chen W, Zheng R. Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115.
[3] Aggarwal BB, Gehlot P. Inflammation and cancer: how friendly is the relationship for cancer patients[J]. Curr Opin Pharmacol, 2009,9(4):351-369.
[4] Crew KD, Neugut AI. Epideiology of gastric cancer[J]. World J Gastroenterology,2006,12 (3):354-362.
[5] Abe M, Yamashita S, Kuramoto T, et al. Global expression analysis of N -methyl- N′ -nitro- N -nitrosoguanidine-induced rat stomach carcinomas using oligonucleotide microarrays[J]. Carcinogenesis, 2003,24(5):861-867.
[6] Raphael KR, Sabu M, Kumar KH, et al. Inhibition of N-Methyl N′-nitro-N-nitrosoguanidine (MNNG) induced gastric carcinogenesis by Phyllanthus amarus extract[J]. Asian Pac J Cancer Prev, 2006,7 (2):299.
[7] 柯杨,宁涛,王冰,等.人胃黏膜上皮细胞系GES-1的建立及其生物学特性[J].中华肿瘤杂志,1994,16(1):7-9.
[8] 孙振卿,闫慧明,贾彬,等.从形态及功能研究MNNG诱导GES-1永生化细胞的恶性转化[J].中国现代医学杂志,2012,22(22):14-18.
[9] 李军祥,王志斌,朱陵群,等.三七提取物含药血清对MNNG转化后GES-1细胞凋亡相关基因蛋白表达的影响[J].中西医结合学报,2008,6(8):817-820.
[10] Savagner P. The epithelial-mesenchymal transition (EMT) phenomenon [J]. Ann Oncol, 2010,21(7):89.
[11] Savagner P. Epithelial-mesenchymal transitions: from cell plasticity to concept elasticity[J]. Curr Top Dev Biol, 2015,112:273.
[12] Voulgari A, Pintzas A. Epithelial-mesenchymal transition in cancer metastasis: mechanisms, markers and strategies to overcome drug resistance in the clinic[J]. Biochim Biophys Acta, 2009,1796(2):75.
[13] Cai J, Wang M, Zhu M, et al. N-methyl-N-nitro-N′-nitrosoguanidine induces the expression of CCR2 in human gastric epithelial cells promoting CCl2-mediated migration[J]. Mol Med Rep, 2016,13(2):1083-1090.
[14] Zhang H, Liu L, Wang Y, et al. KLF8 involves in TGF-beta-induced EMT and promotes invasion and migration in gastric cancer cells[J]. J Cancer Res Clin Oncol, 2013,139 (6):1033-1042.
[15] Peng Z, Wang CX, Fang EH, et al. Role of epithelial-mesenchymal transition in gastric cancer initiation and progression[J]. World J Gastroenterol, 2014,20(18):5403.
[16] Jiang JH, Liu C,Cheng H, et al. Epithelial-mesenchymal transition in pancreatic cancer: Is it a clinically significant factor[J]. Biochim Biophys Acta, 2015,1855(1): 43-49.
[17] Chen CL, Mahalingam D, Osmulski P, et al. Single-cell analysis of circulating tumor cells identifies cumulative expression patterns of emt-related genes in metastatic prostate cancer [J]. Prostate, 2013,73(8): 813-826.
[18] Liu RY, Zeng Y, Lei Z, et al. JAK/STAT3 signaling is required for TGF-β-induced epithelial-mesenchymal transition in lung cancer cells[J]. Int J Oncol, 2014,44 (5):1643-1651.

