超声诊断在老年原发性肝癌切除术围术期的应用价值
施 唯 莫凌莉 毕磊磊 洪 丹 张晓燕 赵婷婷
原发性肝癌、食管癌和胃癌是临床上常见且高发的三大恶性肿瘤[1]。肝癌在我国的发病率极高,占世界总发病率的50%以上,我国每年约10万人死于肝癌,而且肝癌的发病率仍呈上升趋势[2-3]。由于原发性肝癌的发病不受年龄限制,而且肝脏的强代偿性使得肝癌早期临床病征和肝脏功能的生化水平变化不显著,增加了早期原发性肝癌诊断难度。随着我国人口老龄化的发展,原发性肝癌在老年群体中发病率有增高趋势。虽然老年患者手术耐受性差,但是到目前为止,病灶手术切除仍是治疗肝癌最有效的方法,根治性切除术可以明显提高原发性肝癌患者三年生存率[4-5]。超声诊断是原发性肝癌的常规影像学检测项目,其具有价格便宜、无创、方便快捷且无辐射等优点。超声诊断可以提供原发性肝癌的分期,恶化程度、肿瘤病灶大小、肝脏血流分布等多样信息,便于临床手术的进行[6]。而且超声诊断也被广泛用于术中指导医生顺利进行切除手术,用于术后进行癌灶查漏,减少原发性肝癌的复发[7]。本文中我们以老年原发性肝癌患者为研究对象,探究超声诊断在老年肝癌切除术围术期的应用价值。
1 资料与方法
1.1 一般资料
选取2009年1月至2013年12月我院收治的原发性肝癌患者79例,所有患者经临床表现、CT及甲胎蛋白等检测确诊为原发性肝癌。其中男性患者62例,女性患者17例;年龄为65~83岁,平均年龄为(72.7±11.4)岁。另取30例肝脏良性肿块患者为对照组,对照组患者中男性患者22例,女性患者8例;年龄为63~79岁,平均年龄为(70.6±9.5)岁。排除手术切除不适应症患者,排除有转移性肝癌患者,排除有凝血功能障碍或消化道出血史患者。
1.2 研究方法
术前对所有患者均进行超声检查,患者空腹至少8 h后取平卧位和侧卧位察看患者肝脏各切面,常规二维超声(探头频率3.5~5.0 MHz)观测患者肿瘤形态、病灶数、肿瘤大小,然后叠加彩色多普勒超声(探头频率3.5 MHz,探查深度10~12 mm)检测患者肿瘤内部及周边血管形态等。
由外科医生行肝脏肿块切除术,术中将超声仪器探头包裹在灭菌袋内,将探头置于肝脏表面进行接触扫查,检测肝脏实质和肝脏内血管,观测患者肿瘤形态、病灶数、肿瘤大小、肿瘤内部及周边血管形态及其分布,确定手术切除范围。术后再次进行超声检查,察看是否有遗漏病灶。
对患者术后3个月进行超声复查及甲胎蛋白检测。以手术患者肿瘤病理和术后超声复查结果为标准,统计分析超声诊断的准确性、特异性、灵敏性。超声复查结果与甲胎蛋白水平进行比较。
1.3 统计学数据分析

2 结果
2.1 两组老年患者的一般情况
原发性肝癌组患者79例,其中男性患者62例,女性患者17例;年龄为65~83岁,平均年龄为(72.7±11.4)岁。对照组患者30例,其中男性患者22例,女性患者8例;年龄为63~79岁,平均年龄为(70.6±9.5)岁。两组患者中,乙肝患者63例,丙肝患者11例;合并肝硬化患者57例;甲胎蛋白AFP升高患者75例;合并高血压患者40例,糖尿病患者23例,冠心病患者5例。一般资料比较P>0.05,见表1。
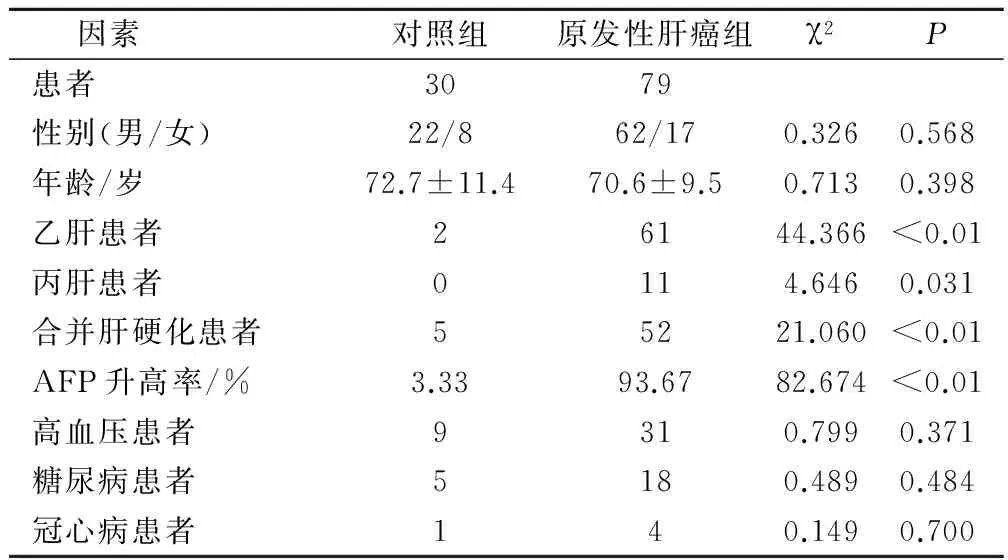
表1 两组患者的一般情况/例
2.2 两组老年患者切除术前后超声诊断结果的比较
原发性肝癌组患者超声图像多表现为病灶处为近似圆形的低回声;且回声随肿瘤体积增大而变强,病灶直径为(0.5~17.5)cm;病灶周围可见暗晕,但边界比较清晰;肝硬化患者图像中实质回声增粗,分布不均匀;彩色多普勒超声检查病灶内部有短节状或星点状血流信号,且血流走形弯曲、不自然;病灶周围有血流包绕。对照组患者多表现为病灶处为中、高回声,但无明显占位效应;病灶的形态较为规则,但边界清晰;彩色多普勒超声检查病灶内部无血流信号,病灶周围血管分布自然。
术前经超声诊断原发性肝癌组患者共有124个病灶,对照组患者共有43个病灶;167个病灶中肝细胞癌113例,肝内胆管癌11例,良性肿瘤43例。术后行超声诊断原发性肝癌组患者共145个病灶,对照组患者共有50个病灶;195个病灶中肝细胞癌133例,肝内胆管癌12例,良性肿瘤50例。
对所有患者进行切除术手术,检查切除病灶病理并对所有患者进行术后3个月超声复查,通过对两组患者进行统计发现,原发性肝癌组患者共发现153个病灶,对照组患者共54个病灶;207个病灶中肝细胞癌140例,肝内胆管癌13例,良性肿瘤54例,见表2。
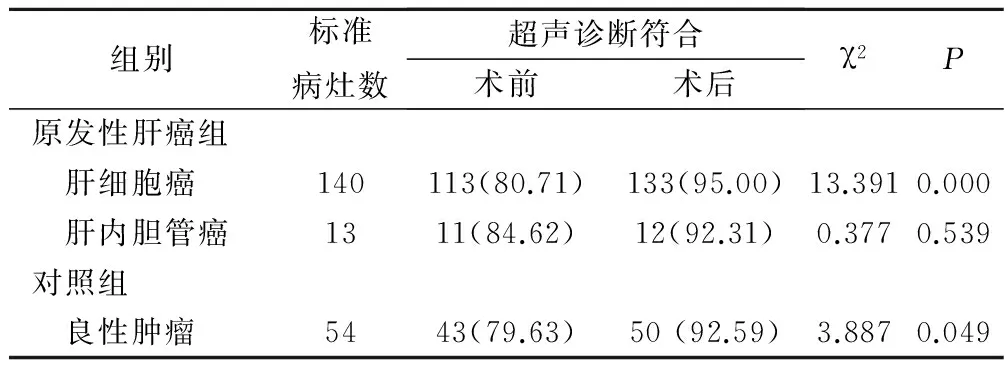
表2 两组老年患者切除术前后超声诊断结果(例,%)
2.3 超声诊断原发性肝癌的准确性、特异性和灵敏性
切除手术前后超声诊断与肿瘤病理结果的关系,见表3。

表3 超声诊断与肿瘤病理结果比较/例
通过上述数据计算超声诊断的准确度、特异度和灵敏度。与术前超声诊断相比较,术后超声诊断的准确度更高(χ2=17.243,P<0.01)、灵敏度更高(χ2=13.558,P<0.01),术后诊断的特异性要优于术前诊断(χ2=3.793,P=0.051)。
2.4 超声诊断肝细胞肝癌和肝胆管细胞癌的肿瘤分布及诊断准确率
肝细胞肝癌患者超声诊断率高于肝胆管细胞癌患者,肝细胞肝癌单发与多发差异并不明显,而胆管细胞癌主要以单发为主,结果见表4。

表4 超声诊断肝细胞肝癌和肝胆管细胞癌的肿瘤分布及诊断准确率(例,%)
2.5 超声诊断原发性肝癌预测值结果
结果显示,术后诊断敏感性、特异性、阳性预测值高于术前诊断,而阴性预测值低于术前诊断,差异均具有统计学意义,诊断结果比较见表5。
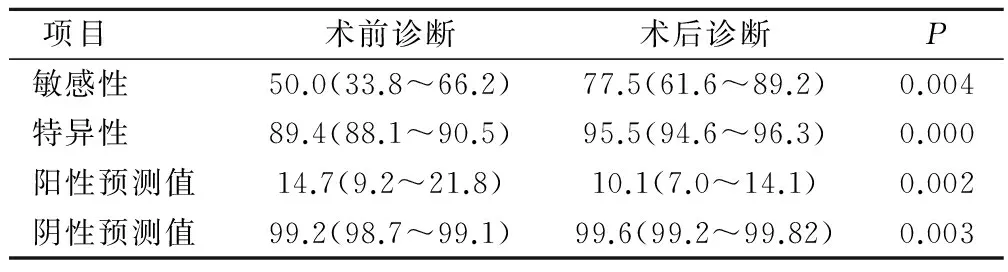
表5 超声诊断原发性肝癌预测值结果比较(95%CI)
3 讨论
原发性肝癌是临床上常见的恶性肿瘤之一,由于肝脏具有较强的代偿能力,肝癌的确诊往往已错过了最佳治疗期,不宜行切除术治疗,而外科根治性切除术是目前原发性肝癌最有效的治疗手段。临床统计发现,原发性肝癌患者在无治疗情况下的平均生存期不超过6个月[8]。所以,对原发性肝癌的早确诊,早治疗是提高患者生存率的重要方法[9]。临床研究发现,原发性肝癌分期为Ⅰ至Ⅲ期时,其手术切除率为100%~76.3%,其根治切除率为88.9%~32.6%[10],这说明越早对原发性肝癌确诊,根治性手术的可能越大,患者的生存率越高。超声诊断是临床上检查原发性肝癌最常用的影像学手段,叠加上彩色多普勒超声诊断,超声诊断可以判定癌灶的位置,癌灶的大小、肿瘤的分期、是否存在转移、癌灶内血流情况、癌灶周边肝脏血管的走向等,为外科切除手术方案的制定和其操作的进行提供了参考依据[11-13]。但是术前超声诊断也存在一定局限性,如超声仪器存在癌灶大小的检出现肋骨和腹壁的干扰等[14]。本文中通过与解剖病理和术后超声复查结果比较发现,术前超声诊断共发现恶性肿瘤病灶124个,良性病灶为43个,其准确度为80.68%、特异度为79.63%、灵敏度为81.05%。解剖病理发现,术前超声漏诊多为直径<2 cm的病灶或因病灶位置特殊图像不清晰缘故。
超声诊断越来越多的应用于原发性肝癌切除术中或介入性治疗术中。术中辅助进行超声诊断,不但可以查找出术前遗漏的病灶,而且可以指导外科医生顺利进行切除手术。这是因为术中超声是仪器探头直接接触肝脏表面,增加了仪器探测的深度并减少了肋骨和腹壁等的干扰,提高了超声的检测限和超声图像清晰度。研究中我们通过比较术后超声诊断与标准发现,两组老年患者术中辅助超声诊断共发现新病灶28个,恶性肿瘤病灶21个、良性肿瘤病灶7个。其检测的准确度为94.20%、特异度为92.59%、灵敏度为94.77%。与术后超声诊断水平相比,准确性和灵敏性明显提高(P<0.01)。通过与解剖病理及术后超声复查结果比较发现,术后超声漏诊多为直径<0.5 cm的病灶或原发性肝癌卫星灶。说明术中行超声诊断可以显著地提高其准确性和灵敏性,达到尽可能根除癌灶的目的。
总之,超声诊断具有便宜便捷、诊断无创性、无辐射等优点,应作为原发性肝癌高危人群的普查项目,有利于原发性肝癌的早期发现。围术期对患者行超声诊断有利于外科医生手术方案的定制,引导切除手术的顺利进行和提高诊断准确率,有助于病灶的彻底根除,提高患者术后生存期和生存率。
[1] Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics,2002〔J〕.CA Cancer J Clin,2005,55(2):74-108.
[2] 钦伦秀,孙惠川,汤钊猷.原发性肝癌研究进展--2006沪港国际肝病大会纪要〔J〕.中华外科杂志,2006,44(15):1070-1075.
[3] Yuen MF,Hou JL,Chutaputti A.Hepatocellular carcinoma in the Asia pacific region 〔J〕.J Gastroenterol Hepatol,2009,24(3):346-353.
[4] Yang JD,Roberts LR.Hepatocellular carcinoma:A global view〔J〕.Nat Rev Gastroenterol Hepatol,2010,7(8):448-458.
[5] 刘景丰,池闽辉,曾金华,等.861例巨大原发性肝癌的手术切除治疗〔J〕.中华普外科手术杂志,2009,3 (4):16-18.
[6] Vilana R,Forner A,Bianchi L,et al.Intrahepatic peripheral cholangiocarcinoma in cirrhosis patients may display a vascular pattern similar to hepatocellular carcinoma on contrast-enhanced ultrasound〔J〕.Hepatology,2010,51(6):2020-2029.
[7] 高军喜,姚兰辉.术中超声在原发性肝癌手术以及射频消融中的应用〔J〕.中国介入影像与治疗学,2008,5(1):34-38.
[8] Ji YB,Ling N,Zhou XJ,et al.Schedule-dependent effects of kappa-selenocarrageenan in combination with epirubicin on hepatocellular carcinoma〔J〕.Asian Pac J Cancer Prev,2014,15(8):3651-3657.
[9] Flores A,Marrero JA.Emerging Trends in Hepatocellular Carcinoma:Focus on Diagnosis and Therapeutics〔J〕.Clin Med Insights Oncol,2014,8:71-76.
[10] 杨冬华,房殿春.消化系肿瘤诊断与治疗〔M〕.人民卫生出版社,2002:308-309.
[11] Davila JA,Morgan RO,Richardson PA,et al.Use of surveillance for hepatocellular carcinoma among patients with cirrhosis in the United States〔J〕.Hepatology,2010,52(1):132-141.
[12] Singal A,Volk ML,Waljee A,et al.Meta-analysis:surveillance with ultrasound for early-stage hepatocellular carcinoma in patients with cirrhosis〔J〕.Aliment Pharmacol Ther,2009,30(1):37-47.
[13] Cabibbo G1,Craxì A.Epidemiology,risk factors and surveillance of hepatocellular carcinoma〔J〕.Eur Rev Med Pharmacol Sci,2010,14(4):352-355.
[14] Malek NP,Schmidt S,Huber P,et al.The diagnosis and treatment of hepatocellular carcinoma〔J〕.Dtsch Arztebl Int,2014,111(7):101-106.

