卵巢癌细胞株SKOV3在人脐带间充质干细胞培养液中的增殖、凋亡和迁移情况观察
袁晓凤,袁修凯,周芳
(1中国人民解放军第97医院,江苏徐州 221000;2睢宁中医院)
脐带间充质干细胞(hUC-MSCs)是一类具有自我更新和多向分化潜能的多能干细胞[1,2]。hUC-MSCs取材方便,易于分离培养,低免疫原性低,且遗传性状稳定[3,4],故被认为是组织工程的理想种子细胞。越来越多的研究发现,间充质干细胞(MSCs)和肿瘤之间具有密切的联系[5,6],卵巢癌是妇产科最常见的恶性肿瘤之一,由于该肿瘤起病比较隐匿,缺乏特异表现,在临床上确诊时大多已经晚期,是女性生殖系统肿瘤中病死率最高的肿瘤。本研究以卵巢癌细胞株SKOV3为研究对象,观察了卵巢癌细胞株SKOV3在hUC-MSCs培养液hUC-MSCs培养液中的增殖、凋亡和迁移情况。现报告如下。
1 材料与方法
1.1材料低糖DMEM和高糖DMEM购自Gibco公司;血清购自Excell公司;小鼠抗大鼠GAPDH单克隆抗体(mAb)、小鼠抗大鼠Bcl-2 mAb和小鼠抗大鼠Bax mAb购自Immuway公司;MTT四甲基偶氮唑蓝试剂购自碧云天生物技术公司;成骨、成脂诱导液以及碱性磷酸酶(ALP)和油红O染色液购自广州赛业公司;凋亡试剂盒购自Sigma公司;Transwell小室、6孔板、25 cm2细胞培养瓶购自Corning公司;倒置显微镜购自Nikon公司;二氧化碳孵育箱购自Thermo公司。
1.2hUC-MSCs的分离、培养及hUC-MSCs细胞培养液的制备在超净工作台中无菌操作,用PBS冲洗掉脐带表明残留的血液,在含双抗(青/链霉素,终浓度为100 U/mL)的营养液中浸泡约15 min,随后去掉脐带组织中的动脉和静脉,将脐带组织剪成约1 mm3的小块,小心均匀的贴在10 mm×35 mm小皿中并加入含有双抗的L-DMEM培养液,放在37 ℃、5%CO2孵箱内培养,每3 d换液1次。培养7~10 d可见纤维样的细胞从脐带组织块中爬出,待细胞融合到80%时消化传代。经过3次传代纯化后收集细胞备用。将hUC-MSCs细胞以5×105个细胞密度,接种于培养瓶中,待细胞融合度达到80%时,更换无血清的L-DMEM培养液,24 h后提取培养液,0.22 μm滤膜过滤。-20 ℃保存备用。
1.3 SKOV3细胞分组及hUC-MSC细胞培养液应用 将体外培养的SKOV3细胞分为观察1组、观察2组和对照组。观察1、2组分别用10%、20%的hUC-MSC培养,对照组用正常培养基培养。
1.4各组SKOV3细胞增殖情况观察 ①MTT法。取对数期生长的SKOV3接种于96孔板,每孔2 000个细胞,然后每孔加入200 μL H-DMEM营养液,37 ℃、5%CO2培养过夜后,次日换10%、20%的hUC-MSCs培养液(分别计为观察1组、观察2组)继续培养24 h,每孔加入20 μL MTT,37 ℃、5%CO2孵育箱培养4 h后弃掉上清培养基,每孔加入150 μL DMSO溶液,避光振荡15 min,酶标仪检测490 nm处的吸光度值。每个观察组设4个复孔。以未经hUC-MSCs培养液处理的SKOV3细胞作为对照组。实验重复3次。②细胞平板克隆实验。取对数期生长的SKOV3细胞按500/孔接种于小皿中,用H-DMEM营养液培养过夜后,换10%、20%的hUC-MSCs培养液(分别计为观察1组、观察2组),每3天换液1次,第7天弃去培养液,用PBS洗涤3遍后4%多聚甲醛固定15 min,PBS洗涤3遍,结晶紫染色30 min后PBS冲洗3遍,拍照并记录细胞克隆个数。以未经hUC-MSCs培养液处理的SKOV3细胞作为对照组。实验重复3次。
1.5各组SKOV3细胞凋亡情况观察 采用流式细胞术。收集对数生长期的SKOV3细胞,0.25%胰酶消化计数,按每孔加入3×104个细胞于6孔板内,次日弃去培养液,换10%、20%的hUC-MSCs培养液继续培养24 h,收集细胞并计数每管1×106个细胞,然后滴加PI和Annexin-V-FITC进行双染,在4 ℃避光染色30 min,过滤后用流式细胞仪检测细胞凋亡率。以未经hUC-MSCs培养液处理的SKOV3细胞为对照组。
1.6各组SKOV3细胞迁移情况观察 ①划痕实验。取对数期生长的SKOV3细胞按1×105/孔接种于小皿中,置于37 ℃、5%CO2孵育箱培养到细胞融合度>80%,弃去培养液,用无血清的H-DMEM营养液冲洗3遍,用200 μL移液枪枪头在小皿中划出1条直线,再用无血清的H-DMEM营养液冲洗,换10%、20%的hUC-MSCs培养液(分别为观察1组、观察2组),在显微镜下观察并拍照记录0 h和48 h细胞迁移情况,计算0 ~48 h划痕愈合率。划痕愈合率=(0 h宽度-48 h宽度)/0 h宽度×100%。以未经hUC-MSCs培养液处理的SKOV3细胞为对照组。②Transwell迁移实验。用10%、20%的hUC-MSCs培养液预处理SKOV3细胞24 h,分别为观察1组、观察2组。以未经hUC-MSCs培养液处理的SKOV3细胞为对照组。收集各组SKOV3细胞,用无血清H-DMEM营养液培养液重悬后,在Transwell小室中加入细胞悬液按200 μL,在下室中加入800 μL含10%NBS的H-DMEM营养液。置于37 ℃、5% CO2孵箱内培养12 h后,取出Transwell小室,吸去上室内的液体,棉签擦去小室内未迁移的细胞,用PBS洗3遍,4%多聚甲醛固定15 min,PBS洗涤3遍,结晶紫染色30 min后PBS冲洗3遍,显微镜下随机选取视野拍照,计数每个视野下的细胞数。
1.7各组SKOV3细胞Bcl-2和Bax蛋白检测采用Western blotting法。用10%、20%的hUC-MSCs培养液预处理SKOV3细胞24 h,分别计为观察1组、观察2组。以未经hUC-MSCs培养液处理的SKOV3细胞为对照组。收集各组SKOV3细胞在RIPA缓冲液中裂解并收集蛋白,用12%SDS-PAGE电泳分离(最佳分离范围12~60 kD),随后电转移到PVDF膜上,5%脱脂奶粉室温封闭2 h,分别加入抗小鼠抗大鼠Bcl-2 mAb(1∶200)和Bax mAb(1∶200)以及内参照GAPDH抗体(1∶5 000),4 ℃孵育过夜,用TBS/T洗3遍,加入HRP标记的羊抗小鼠IgG(1∶2 000),室温孵育1 h,用TBS/T洗3遍,最后加入ELC试剂,拍照分析。Bcl-2、Bax蛋白表达量以Bcl-2和Bax条带灰度值与GAPDH条带灰度值的比值表示。
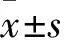
2 结果
2.1各组细胞增殖活性比较①观察1组、观察2组、对照组吸光度值分别为0.50±0.09、0.80±0.06、0.21±0.04。观察1、2组吸光度值均大于对照组(P均<0.05),且观察2组大于观察1组(P<0.05)。②观察1组、观察2组、对照组细胞克隆数分别为(311.00±17.52)、(476.33±20.60)、(147.00±9.17)个,观察1、2组细胞克隆数明显高于对照组(P均<0.05),且观察2组高于观察1组(P<0.05)。
2.2各组细胞凋亡率比较 观察1组、观察2组、对照组细胞凋亡率分别为10.98%±1.28%、5.50%±0.67%、17.97%±1.50%。观察1、2组细胞凋亡率低于对照组(P均<0.05),且观察2组低于观察1组(P<0.05)。
2.3各组细胞迁移能力比较 ①观察1组、观察2组、对照组细胞划痕愈合率分别为114.50%±19.09%、138.50%±0.71%、108.50%±14.85%。观察1、2组细胞划痕愈合率高于对照组(P均<0.05),且观察2组高于观察1组(P<0.05)。②观察1组、观察2组、对照组穿膜细胞数分别为155.00±151.50、335.67±344.50、151.33±145.50。观察1、2组穿膜细胞数高于对照组(P均<0.05),且观察2组高于观察1组(P<0.05)。
2.4各组细胞Bcl-2、Bax表达比较观察1组、观察2组、对照组细胞Bcl-2相对表达量分别为0.48±0.47、0.62±0.63、0.84±0.86,Bax相对表达量分别为0.75±0.78、0.64±0.63、0.58±0.56。观察1、2组细胞Bcl-2相对表达量高于对照组(P均<0.05),且观察2组高于观察1组(P<0.05);观察1、2组细胞Bax相对表达量低于对照组(P均<0.05),且观察2组低于观察1组(P<0.05)。
3 讨论
hUC-MSCs具有取材方便来源广泛、免疫原性低、分泌多种细胞因子和免疫调节能力强等特点,是目前研究最多最深入的干细胞之一[7,8],hUC-MSCs有望成为理想的细胞工程“种子细胞”。hUC-MSCs获取的主要方法是贴壁法和酶消化法,但由于酶消化法操作步骤多,污染风险大以及对细胞有伤害。本研究通过脐带组织贴壁法分离hUC-MSCs,传代培养获得纯化的hUC-MSCs。
越来越多研究[9~11]表明肿瘤微环境在肿瘤的发生发展中起到了重要作用。MSCs能够受到炎症因子的趋化迁移到炎症组织处并对其进行修复[12],目前研究发现肿瘤的微环境与炎症周围的微环境有许多相似之处,MSCs同样能够被招募到实质肿瘤部位构成其微环境,微环境中的MSCs能够进一步成为肿瘤相关成纤维细胞,并参与肿瘤生长、侵润转移和耐药等过程。研究人员发现,hUC-MSCs培养液对肿瘤细胞的增殖和迁移有促进作用[13],并推测这方面的作用可能是通过hUC-MSCs分泌的细胞因子实现的。本研究结果显示,与对照组相比,观察1、2组SKOV3细胞增殖和迁移能力增强,细胞凋亡率降低,且观察2组比观察1组显著,提示hUC-MSCs通过旁分泌途径促进了SKOV3细胞的增殖和迁移并抑制其凋亡。McLean等[14]在分离肿瘤相关MSCs时发现有90%的原发性卵巢癌患者存在肿瘤相关MSCs,但是这些MSCs没有致癌性,具有正常的核型和细胞表面标记以及多向分化潜能增强。Chu等[15]发现从健康人网膜中分离的脂肪来源MSCs能够明显促进卵巢癌细胞生长和迁移。另外,So等[16]发现,卵巢癌细胞与其微环境中的MSCs相互影响,MSCs通过分泌IL-6作用卵巢癌细胞发生上皮间质转化,使卵巢癌细胞获得间质特性,此外还分泌基质金属蛋白酶增强肿瘤的侵袭和转移能力。不过也有研究发现MSCs能够抑制卵巢癌的增殖迁移能力[17,18],这些结果的不一致可能是由于MSCs来源不同以及所使用的卵巢癌细胞株不完全一致。
Bax和Bcl-2是Bcl-2家族中重要成员,Bcl-2发挥促增殖和抑制下游凋亡途径的激活作用,而Bax能够与Bcl-2形成二聚体拮抗Bcl-2的促增殖作用,从而激活下游凋亡途径。正常情况下,Bax和Bcl-2相互协调维持平衡,但如果受到体内或是外部的刺激,将打破这个平衡导致机体功能紊乱。本研究结果显示,与对照组相比,观察1、2组SKOV3细胞Bcl-2表达升高,Bax表达下降,且观察2组比观察1组明显,提示在hUC-MSCs细胞培养液中培养,SKOV3细胞Bax的表达下调,Bcl-2表达下调,这可能是与各组细胞细胞增殖、凋亡、迁移能力的变化有关。
参考文献:
[1] Davies JE, Walker JT, Keating A. Concise review: Wharton′s Jelly: the rich, but enigmatic, source of mesenchymal stromal cells[J]. Stem Cells Transl Med, 2017,6(7):1620-1630.
[2] Fujii S, Miura Y, Iwasa M, et al. Isolation of mesenchymal stromal/stem cells from cryopreserved umbilical cord blood cells[J]. J Clin Exp Hematop, 2017,57(1):1-8.
[3] Zhang H, Tao Y, Liu H, et al. Immunomodulatory function of whole human umbilical cord derived mesenchymal stem cells[J]. Mol Immunol, 2017,87:293-299.
[4] Kang SY, Park DE, Song WJ, et al. Immunologic regulatory effects of human umbilical cord blood-derived mesenchymal stem cells in a murine ovalbumin asthma model[J]. Clin Exp Allergy, 2017,47(7):937-945.
[5] Li T, Zhang C, Ding Y, et al. Umbilical cord-derived mesenchymal stem cells promote proliferation and migration in MCF-7 and MDA-MB-231 breast cancer cells through activation of the ERK pathway[J]. Oncol Rep, 2015,34(3):1469-1477.
[6] Vulcano F, Milazzo L, Ciccarelli C, et al. Wharton′s jelly mesenchymal stromal cells have contrasting effects on proliferation and phenotype of cancer stem cells from different subtypes of lung cancer[J]. Exp Cell Res, 2016,345(2):190-198.
[7] Sousa BR, Parreira RC, Fonseca EA, et al. Human adult stem cells from diverse origins: an overview from multiparametric immunophenotyping to clinical applications[J]. Cytometry A, 2014,85(1):43-77.
[8] Liu A, Chen S, Cai S, et al. Wnt5a through noncanonical Wnt/JNK or Wnt/PKC signaling contributes to the differentiation of mesenchymal stem cells into type Ⅱ alveolar epithelial cells in vitro[J]. PLoS One, 2014,9(3):e90229.
[9] Yuan X, Zhang Q, Li Z, et al. Mesenchymal stem cells deliver and release conditionally replicative adenovirus depending on hepatic differentiation to eliminate hepatocellular carcinoma cells specifically[J]. Cancer Lett, 2016,381(1):85-95.
[10] Yuan X, Zhang Q, Li Z, et al. Mesenchymal stem cells deliver and release conditionally replicative adenovirus depending on hepatic differentiation to eliminate hepatocellular carcinoma cells specifically[J]. Cancer Lett, 2016,381(1):85-95.
[11] Gu J, Qian H, Shen L, et al. Gastric cancer exosomes trigger differentiation of umbilical cord derived mesenchymal stem cells to carcinoma-associated fibroblasts through TGF-beta/Smad pathway[J]. PLoS One, 2012,7(12):e52465.
[12] Kidd S, Spaeth E, Dembinski JL, et al. Direct evidence of mesenchymal stem cell tropism for tumor and wounding microenvironments using in vivo bioluminescent imaging[J]. Stem Cells, 2009,27(10):2614-2623.
[13] Watson N, Divers R, Kedar R, et al. Discarded Wharton jelly of the human umbilical cord: a viable source for mesenchymal stromal cells[J]. Cytotherapy, 2015,17(1):18-24.
[14] McLean K, Gong Y, Choi Y, et al. Human ovarian carcinoma-associated mesenchymal stem cells regulate cancer stem cells and tumorigenesis via altered BMP production[J]. J Clin Invest, 2011,121(8):3206-3219.
[15] Chu Y, Tang H, Guo Y, et al. Adipose-derived mesenchymal stem cells promote cell proliferation and invasion of epithelial ovarian cancer[J]. Exp Cell Res, 2015,337(1):16-27.
[16] So KA, Min KJ, Hong JH, et al. Interleukin-6 expression by interactions between gynecologic cancer cells and human mesenchymal stem cells promotes epithelial-mesenchymal transition[J]. Int J Oncol, 2015,47(4):1451-1459.
[17] Bruno S, Collino F, Deregibus MC, et al. Microvesicles derived from human bone marrow mesenchymal stem cells inhibit tumor growth[J]. Stem Cells Dev, 2013,22(5):758-771.
[18] Waterman RS, Henkle SL, Betancourt AM. Mesenchymal stem cell 1 (MSC1)-based therapy attenuates tumor growth whereas MSC2-treatment promotes tumor growth and metastasis[J]. PLoS One, 2012,7(9):e45590.

