促红细胞生成素对高氧诱导人肺泡上皮细胞A549凋亡的预防作用及其机制
党嘉文,董文斌,雷小平,康兰,李清平,何娜
(西南医科大学附属医院,四川泸州 646000)
高氧肺损伤的确切机制至今仍未阐明。肺泡上皮细胞凋亡是高氧肺损伤的一个重要组织学特征[1,2],细胞凋亡的发生与胞质内线粒体形态的动态变化存在密切联系[3]。而与线粒体形态变化相关的神经萎缩症蛋白 1(OPA1)是凋亡前期诱导因子[4]。近年大量研究[5~8]结果证实,促红细胞生成素 (EPO)是细胞因子超家族成员之一, 通过抗细胞凋亡、抗氧化应激、促血管生成、调节炎症等对抗多种组织损伤。但是EPO预处理是否可以预防高氧肺损伤目前尚未见报道。本研究用高体积分数氧处理人肺泡Ⅱ型细胞A549建立新生儿高氧肺损伤模型[9],观察EPO预处理对高氧肺损伤的预防作用,并探讨其机制。现报告如下。
1 材料与方法
1.1细胞、仪器及试剂人肺泡上皮细胞A549由西南医科大学附属医院中心实验室提供;LX71型倒置相差显微镜购自Olympus公司;JEOI-1400透射电子显微镜购自JEOL公司;FORMA311型CO2培养箱购自Gibco公司;EPO购自成都地奥九泓制药厂;CCK-8购自日本同仁化学研究所;ANNEXIN V流式细胞凋亡检测试剂盒购自凯基生物公司;OPA1多克隆抗体(兔抗人)购自R&D公司;SP免疫组化试剂盒购自武汉博士德公司;线粒体膜电位检测试剂盒购自Biovision公司。
1.2 细胞分组及EPO应用方法 先将人肺泡上皮细胞A549复苏,加入含有10%胎牛血清的DMEM高糖培养液,放入37℃、5%CO2培养箱中培养。待细胞生长至对数生长期时用0.25%的胰蛋白酶进行消化,传代培养。设观察1、2、3、4组及模型对照组、空白对照组。观察1、2、3、4组细胞分别加入10、20、50、100 IU/mL的EPO预处理24 h,然后置于氧浓度>90%的高氧培养箱内培养24 h。模型对照组细胞直接置于氧浓度>90%的高氧培养箱内培养24 h。空白对照组细胞常规条件下培养24 h。收集细胞进行如下研究。
1.3各组细胞增殖情况观察采用CCK-8法。按试剂盒说明操作,酶联免疫检测仪测定450 nm波长处的各组光吸收值(以OD450表示)。
1.4各组细胞凋亡情况观察 各组细胞培养24 h,后收集细胞,用流式细胞仪检测,按照凯基ANNEXIN V-FITC细胞凋亡检测试剂盒说明书操作。
1.5各组细胞形态观察采用倒置相差显微镜下观察细胞形态学变化。
1.6各组细胞线粒体形态观察采用JEOL-1400透射电镜观察线粒体形态变化。
1.7各组细胞OPA1 检测方法 采用免疫组化法检测观察4组、模型对照组和空白对照组细胞中的OPA1。实验中OPA1蛋白抗体的稀释度为1∶200。按照说明书进行操作,细胞质染成棕黄色为阳性表达。实验重复3次,每张爬片任选8个高倍镜图片,在倒置相差显微镜下观察细胞,采用Image-pro6.0图像分析软件对图像进行分析,测定IOD值。
1.8各组细胞线粒体膜电位检测方法 采用四氯四乙基苯并咪唑基羰花青碘化物 (JC-1) 检测观察4组、模型对照组和空白对照组细胞线粒体膜电位。3组细胞置于激光共聚焦显微镜下观察。设置激发波长为488 nm, 发射波长为530 nm及590 nm,分别观察绿色和红色荧光。计算机采集图像荧光值, 计算红绿荧光强度比值。红绿荧光强度比值=红色荧光强度/绿色荧光强度。
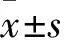
2 结果
2.1各组OD450比较观察1、2、3、4组及模型对照组、空白对照组OD450分别为0.21±0.03、0.28±0.02、0.32±0.03、0.34±0.04和0.16±0.04、0.37±0.06。模型对照组OD450与空白对照组相比,P<0.05;观察1、2、3、4组OD450与模型对照组相比,P均<0.05;观察1、2组OD450与空白对照组相比,P均<0.05;观察3、4组OD450与空白对照组相比,P均>0.05。
2.2各组细胞凋亡率比较 观察1、2、3、4组及模型对照组、空白对照组细胞凋亡率分别为3.70±0.66、2.31±0.54、1.08±0.49、1.13±0.51和5.24±0.93、0.95±0.37。模型对照组细胞凋亡率与空白对照组相比,P<0.05;观察1、2、3、4组细胞凋亡率与模型对照组相比,P均<0.05;观察1、2组细胞凋亡率与空白对照组相比,P均<0.05;观察3、4组细胞凋亡率与空白对照组相比,P均>0.05。
2.3各组细胞形态学变化 倒置相差显微镜下空白对照组细胞为扁圆的多角形,悬浮细胞较少,细胞排列紧密,连接成片,呈良好的生长状态。模型对照组细胞受损明显,变为圆形或椭圆形,细胞间空隙加大,活细胞数量明显降低,悬浮细胞明显增多。观察1、2、3、4组随EPO浓度增加 ,细胞损伤状况与模型对照组相比明显改善。观察3、4组细胞形态与空白对照组相似。
2.4 各组细胞线粒体形态变化 透射电子显微镜下可见模型对照组细胞大量线粒体肿胀或破裂,线粒体的数量增多,并可伴线粒体嵴数减少或消失、染色质浓缩、细胞核裂解为碎块等细胞凋亡特征。观察1、2、3、4组线粒体断裂情况有所恢复,观察3、4组细胞线粒体断裂情况与空白对照组相似。
2.5 各组细胞OPA1比较 OPA1染色阳性表现为胞质出现棕黄色颗粒。观察4组、模型对照组、空白对照组OPA1的 IOD值分别为23.01±2.01、7.53±1.16、38.25±6.67。观察4组OPA1的 IOD值与空白对照组和模型对照组相比,P均<0.05。
2.6 各组细胞线粒体膜电位比较 观察4组、模型对照组、空白对照组红绿荧光强度比值分别为1.73±0.06、1.32±0.07、1.96±0.84。观察4组红绿荧光强度比值与空白对照组和模型对照组相比,P均<0.05。
3 讨论
线粒体途径是细胞凋亡的主要途径及中心环节[10,11]。线粒体形态和功能的稳定对肺部疾病的发生发展起着直接作用。线粒体在细胞内形态的维持是通过线粒体融合和分裂实现的[12],而线粒体的结构与功能密切相关,线粒体膜电位是评价线粒体功能完整性的敏感指标[13]。线粒体在凋亡信号诱导下,跨膜电位下降,通透性改变,细胞色素C等凋亡执行因子释放入胞质,继而线粒体发生碎片化,完整性被破坏,融合功能也同时被抑制,导致细胞凋亡[14]。本研究结果显示,模型对照组细胞增殖活性下降,细胞凋亡率升高,线粒体外膜肿胀或破裂,线粒体嵴数量减少或消失,线粒体膜电位下降。证实高氧可诱导A549细胞凋亡,且凋亡的发生与线粒体形态和功能改变密切相关。
线粒体的分裂和融合是由特定的功能蛋白介导的,OPA1 是调控线粒体融合的关键蛋白,当其功能损伤时,可导致线粒体分裂和融合的动态平衡下降,线粒体外膜肿胀或破裂,线粒体嵴数量减少或消失,线粒体膜电位下降,线粒体碎片化,引起细胞凋亡[15]。本研究结果显示模型对照组细胞OPA1 表达较正常对照组显著降低,提示高氧可抑制A549细胞内 OPA1蛋白表达,使线粒体融合被阻断,线粒体完整性被破坏,导致细胞凋亡。对于高氧肺损伤的防治,临床上主要集中在合理用氧,如更换机械通气模式、运用保护性通气策略,但收效甚微,寻找一种有效的药物来阻断高氧肺损伤已迫在眉睫。故本研究采用外源性生长因子 EPO干预,结果发现,各观察组A549细胞凋亡率随 EPO浓度升高而降低,100、50 IU/mL的EPO能显著降低高氧所致A549细胞的损伤,与对照组比较无统计学差异。EPO 是通过与红细胞生成素受体 (EPOR)结合发挥作用。EPOR在多个器官都有表达, 肺是其靶器官之一[16],受体的生物效应与被占领受体的量呈正比,故本研究中其保护效应随EPO浓度的增加而增强。而受体与配体结合又具有饱和性,故在 EPO浓度达到 50 IU/mL后 ,其保护效应达到饱和。同时,本研究结果还显示,EPO可上调A549细胞内线粒体融合蛋白OPA1表达水平,抑制线粒体膜电位下降,因此推测EPO可能通过增强OPA1蛋白表达,稳定线粒体膜电位来明显减轻高氧诱导的肺泡上皮细胞凋亡,但具体的机制尚需进一步研究。
参考文献:
[1] Mc Evoy CT, Aschner JL.The natural history bronchopulmonary dysplasia: the case for primary prevention[J]. Clin Perinatol, 2015,42(4):911-931.
[2] Li L,Wu W,Huang W,et al.NF-kappaB RNAi decreases the Bax/Bcl-2 ratio and inhibits TNF-alpha-induced apoptosis in human alveolar epithelial cells[J]. Inflamm Res, 2013,62(4):387-397.
[3] Guo H, Chen L, Gui H, et al. Research advances on pathways of nickel-induced apoptosis[J]. Int J Mol Sci, 2015,17(1):323-336.
[4] Anand R, Langer T, Baker MJ. Proteolytic control of mitochondrial function and morphogenesis[J].Biochim Biophys Acta, 2013,1833(1):195-204.
[5] Togel FE, Ahlstrom JD, Yang Y, et al. Carbamylated erythropoietin outperforms erythropoietin in the treatment of AKI-on-CKD and other AKI models [J].J Am Soc Nephrol, 2016,27(11):3394-3404.
[6] Heitrich M, García DM , Stoyanoff TR, et al. Erythropoietin attenuates renal and pulmonary injury in polymicrobial induced-sepsis through EPO-R, VEGF and VEGF-R2 modulation[J]. Biomed harmacother, 2016,82:606-613.
[7] Liu QS, Cheng ZW, Xiong JG, et al.Erythropoietin pretreatment exerts anti-inflammatory effects in hepatic ischemia/repeffusion injured rats via suppression of the TLR2/NF-KB pathway[J]. Transplant Proc, 2015,47(2):283-289.
[8] Zhou S, Zhuang Y, Zhao W, et al.Protective roles of erythropoiesisstimulating proteins in chronic heart failure with anemia[J]. Exp Ther Med, 2014,8(3):863-870.
[9] Zhang C, Dong WB, Zhao S, et al. Construction of p66Shc gene interfering lentivirus vectors and its effects on alveolar epithelial cells apoptosis induced by hyperoxia[J]. Drug Des Devel Ther, 2016,10:2611-2622.
[10] Peng W, Wu JG, Jiang YB , et al. Antitumor activity of 4-O-(2″-O-acetyl-6″-O-p-coumaroyl-β-D-glucopyranosyl)-p-coumaric acid against lung cancers via mitochondrial-mediated apoptosis[J].Chem Biol Inter, 2015,233:8-13.
[11] Shoshan-Barmatz V, Ben-Hail D, Admoni L,et al. The mitochondrial voltage-dependent anion channel 1 in tumor cells[J].Biochim Biophys Acta, 2015,1848(10Pt B):2547-2575.
[12] Atkins K, Dasgupta A, Chen KH. The role of Drp1 adaptor proteins Mi D49 and Mi D51 in mitochondrial fission: implication for human disease[J]. Chin Sci(Lond), 2016,130(21):1861-1874.
[13] Van Ginkel PR, Darjatmoko SR, Sareen D, et al. Resveratrol inhibits uveal melanoma tumor growth via early mitochondrial dysfunction[J].Invest Ophthalmol Vis Sci, 2008,49(4):1299-1306.
[14] Wai T, Langer T. Mitochondrial dynamics and metabolic regulation[J]. Trends Endocrinol Metab, 2016,27(2):105-117.
[15] Varanita T, Soriano ME, Romanello V, et al.The opa1-dependent mitochondrial cristae remodeling pathway controls atrophic, apoptotic, and ischemic tissue damage[J].Cell Metab, 2015,21(6):834-844.
[16] Rayjada N, Barton L, Chan LS, et al.Decrease in incidence of bronchopulmonary dysplasia with erythropoietin administration in preterm infants: a retrospective study[J]. Neonatology, 2012,102(4):287-292.

