福州动物园圈养灵长类动物肠道寄生虫感染情况调查及其驱虫效果
唐 耀 陈小丽
(福州市动物园管理处,福州,350012)
福州动物园2008年由大梦山麓搬迁至新园,灵长类动物由原来的11种增加至目前的15种,动物的数量明显上升,新园的饲养环境也有所改变。但近年来灵长类动物的寄生虫感染情况多发,且成为困扰野生动物健康的一大因素。本次试验,通过普查确定福州动物园灵长类动物寄生虫的感染情况,对兽医今后的工作具有良好的指导意义。
1 材料与方法
1.1 材料
1.1.1 福州动物园灵长类动物样本
2011年9月~2014年8月,从福州动物园采集的各种灵长类动物粪便样本共182份。采集样本为福州动物园圈养的各种野生灵长类动物。黑猩猩(Pantroglodytes)、白颊长臂猿(Nomascusleucogenys)、黑叶猴(Trachypithecusfrancoisi)、赤猴(Erythrocebuspatas)、东非狒狒(Papioanubis)、埃及狒狒(Papiohamadryas)、川金丝猴(Rhinopithecusroxellana)、松鼠猴(Saimirisciureus)、猕猴(Macacamulatta)、山魈(Mandrillussphinx)、黑帽悬猴(Cebusapella)、熊猴(Macacaassamensis)、环尾狐猴(Lemurcatta)、懒猴(Loristardigradus)、婆罗洲猩猩(Pongopygmmaeus)等(表1)。
1.1.2 粪便样本
采集动物排出的新鲜粪便,按前、中、后不同部位约10 g左右,置于干净的自封袋中,填好标签记录。每天采集粪便样本10份左右,保证样本新鲜。
1.2 试验方法
1.2.1 麦克马斯特法(漂浮法)
麦克马斯特法[1]:称取2 g被检粪便于一小烧杯中,加入10 mL饱和盐水,搅匀,再加入50 mL饱和盐水混匀。用80目铜筛网过滤。将滤液混匀后,用吸管将粪液加入麦氏计数板的2个计数室内,直至粪液充满计数室,置计数板于显微镜载物台上,静置1~2 min后,按图 1中虚线顺序,对该2个室内的虫卵或卵囊计数。按以下公式求出其被检粪便中的虫卵
EPG或卵囊OPG值(每克粪便中的虫卵数或卵囊数)。
EPG=2个计数室内的虫卵或卵囊总数×150

图1 在显微镜下,虫卵或卵囊计数顺序(虚线)Fig.1 Under the microscope,count-sequential forthe number of eggs or sac(dashed line)
1.2.2 幼虫培养法
幼虫培养法[2]:本试验选取了东非狒狒、白颊长臂猿、川金丝猴和黑帽悬猴4种动物粪便进行培养。具体方法为:试管内加入蒸馏水2 mL,将滤纸条(宽度略大于试管)纵折后摊平,挑取粪便约0.5 g涂在滤纸条中段,将涂有粪样的滤纸条直插入试管,使与水接触,但不能没及有粪部分;放入28℃温箱中培养5~6 d或31℃温箱中培养4 d后,取出试管,沿管壁加入45℃温水,使淹没涂有粪样的滤纸部分,1 h后,取出滤纸弃去,再静置1 h,弃去上清液,吸取沉渣部分镜检。
1.2.3 虫卵及幼虫鉴定方法
对照图示参照医学寄生虫图鉴进行鉴定[3]。
2 结果
2.1 灵长类动物寄生虫感染情况
福州动物园饲养的灵长类动物15种108头(只)中,寄生虫的感染率分别为赤猴鞭虫40%;赤猴食道口属线虫60%;长臂猿鞭虫33%;金丝猴鞭虫25%;山魈食道口属线虫100%;豚尾猴(Macacanemestrina)鞭虫100%;黑叶猴鞭虫66.7%;另外环尾狐猴、绿狒狒、黑帽悬猴以及猕猴[4]属于群养动物,无法获得独立粪便,不计算感染率。灵长类动物感染的寄生虫种中,鞭虫的感染率为60%(9/15)(表1)。
表1 福州动物园灵长类动物消化道寄生虫感染情况

Tab.1 Primates infected digestive tract parasites in the Fuzhou Zoo
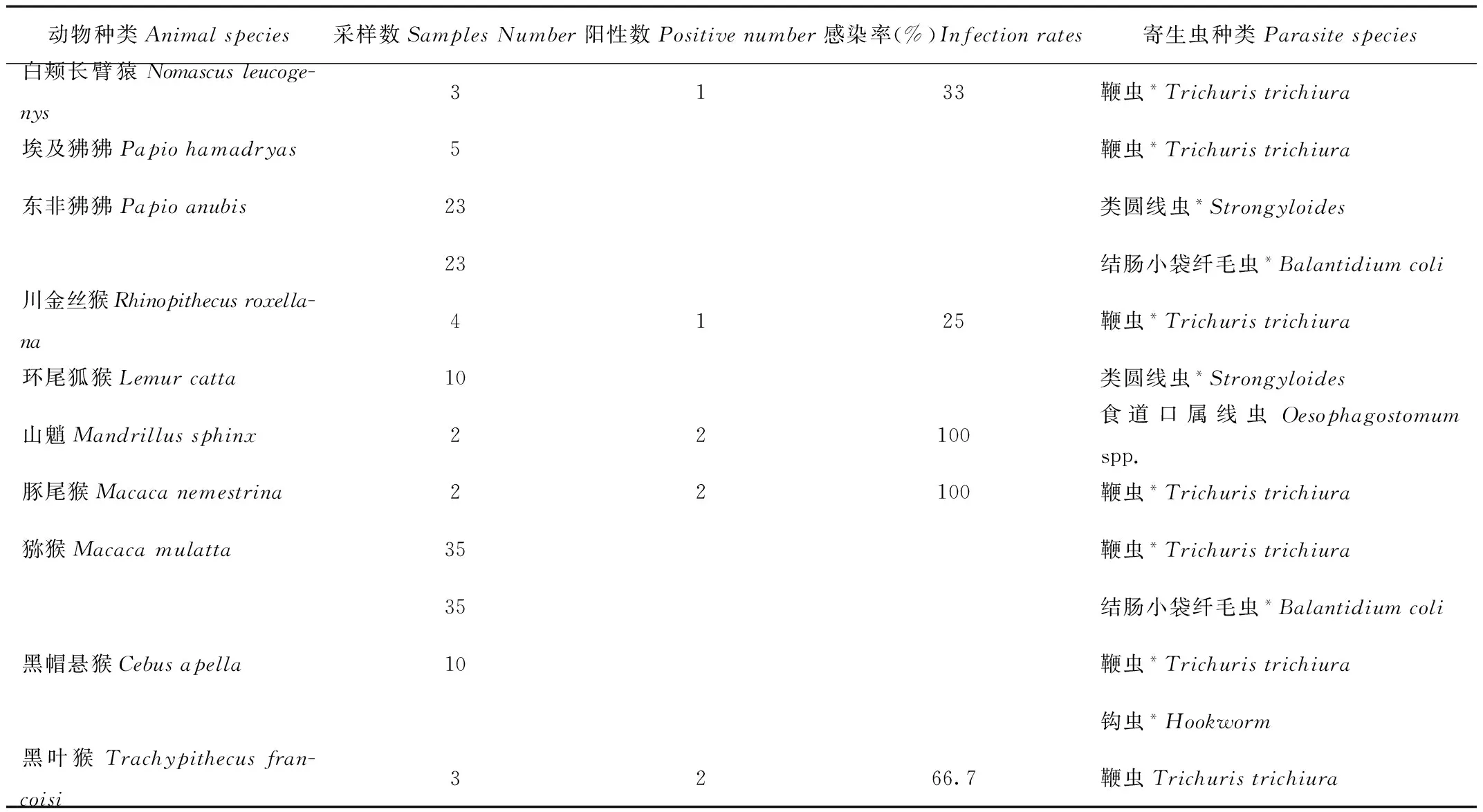
续表1
注:*为人畜共患寄生虫
Note:*For parasitic zoonoses
2.2 灵长类动物寄生虫卵形态特征
川金丝猴体内检出的鞭虫卵[3,5-6](图2-A):虫卵纺锤形,大小24.757 ~55.833 μm,卵壳较厚而光滑,两端呈瓶口状,各具一透明栓,栓高4.978 μm,内含卵细胞。东非狒狒体内的类圆线虫卵(图2-B):虫卵椭圆形,浅灰色,大小29.525 ~64.092 μm,内含幼虫。东非狒狒体内的纤毛虫卵[3,7](图2-C):虫卵呈亚圆形,直径大小56.554 μm,外被两层囊膜,内含1个虫体,发育过程中有滋养体和包囊两种形态。埃及狒狒体内的鞭虫卵(图2-D):虫卵纺锤形,褐色,大小27.575 ~58.762 μm,卵壳较厚而光滑,两端呈瓶口状,各具一透明栓,栓高5.723 μm,内含卵细胞。长臂猿体内的鞭虫卵(图2-E):虫卵纺锤形,褐色,大小28.015 ~59.152 μm,卵壳较厚而光滑,两端呈瓶口状,各具一透明栓,栓高4.994 μm,内含卵细胞。赤猴体内检出的鞭虫卵(图2-F):虫卵纺锤形,褐色,大小25.220 ~53.933 μm,卵壳较厚而光滑,两端呈瓶口状,各具一透明栓,栓高6.353 μm,内含卵细胞。赤猴体内的食道口属线虫(图2-G):虫卵长椭圆形,大小38.477 ~99.561 μm。环尾狐猴体内的类圆线虫卵[3,8](图2-H):虫卵椭圆形,大小30.217 ~50.439 μm,内含一折刀状幼虫。猕猴体内的鞭虫卵(图2-I):虫卵纺锤形,大小28.002 ~60.352 μm,卵壳较厚而光滑,两端呈瓶口状,各具一透明栓,栓高5.710 μm,内含卵细胞。猕猴体内的纤毛虫卵(图2-J):虫卵呈亚圆形,淡紫色,大小57.478 ~58.839 μm。山魈体内的食道口属线虫卵[3](图2-K):虫卵呈椭圆形,大小36.265 ~89.655 μm。黑帽悬猴体内的鞭虫卵[3](图2-L):虫卵纺锤形,大小22.333 ~56.789 μm,卵壳较厚而光滑,两端呈瓶口状,各具一透明栓,栓高5.461 μm,内含卵细胞。黑帽悬猴体内的钩虫卵(图2-M):虫卵椭圆形,大小42.578 ~76.649 μm。钩虫卵大小一般为56~78 μm×36~40 μm,和受精蛔虫卵相近或略长,短椭圆形,两端钝圆或一端稍扁平,卵壳薄,无色透明,新鲜卵内含2~8个灰色颗粒细胞。豚尾猴鞭虫卵(图2-N),虫卵纺锤形,29.695 ~62.962 μm。黑叶猴鞭虫卵(图2-O),虫卵纺锤形,32.956 ~57.319 μm。

图2 灵长类动物肠道寄生虫虫卵Fig.2 Gastrointestinal parasite eggs of primate animals 注:A 川金丝猴鞭虫卵,漂浮法(400×)Eggs of Trichuris trichiura in Rhinopithecus roxellana,Floating method(400×)B 东非狒狒类圆线虫卵,漂浮法(400×)Eggs of Strongyloides in Papio anubis,Floating method(400×)C 东非狒狒纤毛虫卵,沉淀法(400×)Eggs of Balantidium coli in Papio anubis,precipitation(400×)D 埃及狒狒鞭虫卵,漂浮法(400×)Eggs of Trichuris trichiura in Papio hamadryas,Floating method(400×)E 长臂猿鞭虫卵,漂浮法(400×)Eggs of Trichuris trichiura in Nomascus leucogenys,Floating method(400×)F 赤猴鞭虫卵,漂浮法(400×)Eggs of Trichuris trichiura in Erythrocebus patas,Floating method(400×)G 赤猴食道口属线虫卵,漂浮法(400×)Eggs of Oesophagostomum spp.in Erythrocebus patas,Floating method(400×)H 环尾狐猴类圆线虫卵,漂浮法(400×)Eggs of Strongyloides in Lemur catta,Floating method(400×)I 猕猴鞭虫卵,漂浮法(400×)Eggs of Trichuris trichiura in Macaca mulatta,Floating method(400×)J 猕猴纤毛虫卵,沉淀法(400×)Eggs of Balantidium coli in Macaca mulatta,precipitation(400×)K 山魈食道口属线虫卵,漂浮法(400×)Eggs of Oesophagostomum spp.in Mandrillus sphinx,Floating method(400×)L 黑帽悬猴鞭虫卵,漂浮法(400×)Eggs of Trichuris trichiura in Cebus apella,Floating method(400×)M 黑帽悬猴钩虫卵,漂浮法(400×)Eggs of Hookworm in Cebus apella,Floating method(400×)N 豚尾猴鞭虫卵,漂浮法(400×)Eggs of Trichuris trichiura in Macaca nemestrina,Floating method(400×)O 黑叶猴鞭虫卵,漂浮法(400×)Eggs of Trichuris trichiura in Trachypithecus francoisi,Floating method(400×)
2.3 灵长类动物寄生虫幼虫
运用幼虫培养方法,获得2种灵长类动物幼虫,分别是东非狒狒类圆线虫幼虫和黑帽悬猴钩虫幼虫,具体如下。
东非狒狒类圆线虫幼虫[3-4](图3-c):本虫的生活史为世代交替,寄生于动物小肠内的雌虫营孤雌生殖。此虫虫卵随动物粪便排出体外,在外界孵出第1期幼虫,称为杆虫型或杆状蚴,这种幼虫食道短,有2个膨大部。直接发育为具有感染性的第3期幼虫,称为丝虫型幼虫或丝状蚴,这种幼虫的食道长,呈柱状,无膨大部。
黑帽悬猴钩虫幼虫[3-4](图3-d):虫体呈淡黄色,杆状,前端略圆,微端细尖。

c 东非狒狒类圆线虫幼虫(40×)c Larvae of Papio anubis Strongyloides(40×)

d 黑帽悬猴钩虫杆状幼虫(40×)d Larvae of Cebus apella Hookworm(40×)
2.4 灵长类寄生虫感染强度
感染强度(EPG)所列的数据为同种动物单次最高的纪录,分别从春秋两季中选取。从表2可以看出,灵长类动物春秋两季的寄生虫感染强度差别不大,以环尾狐猴的感染强度最高,达18 750个/g,环尾狐猴属于群体饲养,采取3~4个点的粪便进行检查,可能其某个体当中EPG还要更高。以金丝猴(八妹)18 300个/g次之。其他灵长类动物寄生虫感染强度见表2。
表2 福州动物园灵长类动物消化道寄生虫感染强度

Tab.2 Primates infected digestive tract parasites intensity in the Fuzhou zoo
注:EPG1表示秋季EPG;EPG2表示春季EPG
Note:EPG1 represents fall EPG;EPG2 represents spring EPG
2.5 灵长类动物驱虫效果观察
运用麦克马斯特法,获得感染寄生虫动物驱虫前后感染强度,选取EPG较高的野生动物为样本,选用高效、低毒、方便的驱虫药进行驱虫试验,药物选择甲苯咪唑和丙硫苯咪唑,按照丙硫苯咪唑[5-7]8~10 mg/kg;甲苯咪唑[5-6]按5 mg/kg计算口服。口服驱虫药后15 d,采集动物新鲜粪便再次运用麦克马斯特法进行复检。运用甲苯咪唑和丙硫苯咪唑驱虫,试验动物中,虫卵转阴率可达100%(表3)。
表3 灵长类动物驱虫效果对比观察
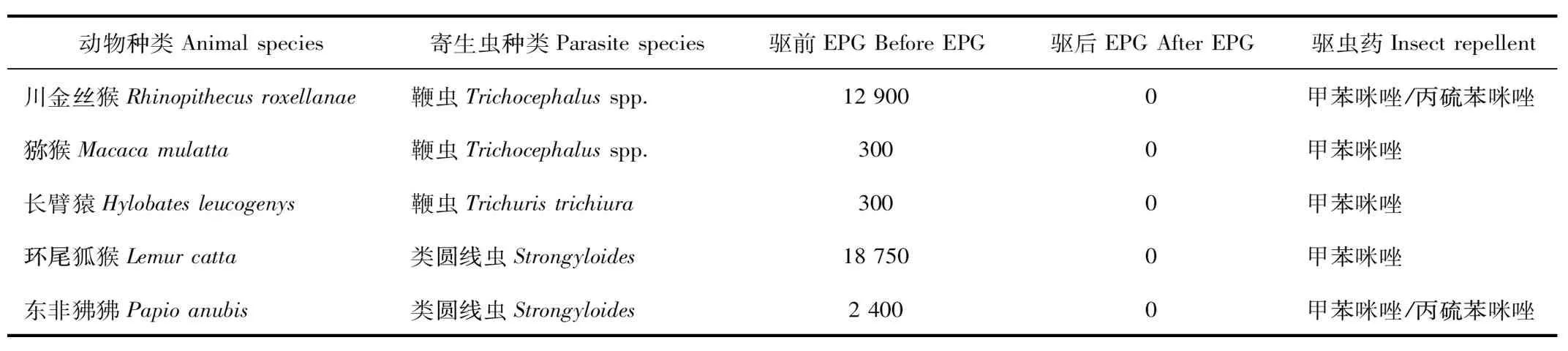
Tab.3 Primates insect repellent effect
3 结论与讨论
3.1 福州动物园灵长类动物寄生虫感染种类
Lim等[9]对马来西亚动物园的灵长类、有蹄类、猫科动物的197份粪便样本进行调查,结果显示寄生虫的感染率分别为54.5%、45.7%、89.3%,其中灵长类主要感染结肠小袋纤毛虫、隐孢子虫、钩虫。本次调查中,福州动物园15种灵长类动物,有8种动物感染鞭虫,感染率达53.3%;2种动物感染类圆线虫[10];2种动物感染小袋纤毛虫;2种动物感染食道口属线虫;其中山魈感染的钩虫在灵长类动物极为少见,且对人类危害极大,需引起同行的重视。另外此次运用幼虫培养法,首次培养出东非狒狒类圆线虫及山魈钩虫杆状幼虫,对兽医同行具有重大的指导意义。
3.2 福州动物园灵长类动物寄生虫感染率与感染强度
感染寄生虫的野生动物中,环尾狐猴类圆线虫卵EPG达18 750个/g;其次是川金丝猴的鞭虫卵EPG达18 300个/g。灵长类动物高感染率及感染强度跟我们长期的饲养环境相关,福州动物园灵长类动物的饲养方式主要为土地与室内水泥地两种相结合。室外土地均设置一些丰容项目或者灌木乔木相结合的绿化环境。且圈养野生动物的笼舍长期饲养同一种动物,导致消毒工作不彻底,从而助长了土源性寄生虫的长期寄生[3,11-12]。
3.3 野生动物寄生虫病发展趋势
随着饲养管理水平的提高,动物园工作者开始着手进行各种动物的丰容工作,特别是食物丰容,饲料通过各种丰容器具、投喂方式、取食习惯,增加了动物在地面的活动时间,这无形当中增加了食物与地面接触的机会,从而增加了寄生虫感染机率。
3.4 坚持定期驱虫,预防为主的寄生虫防治方针
认真贯彻“预防为主、防治结合”原则,坚持定期每季度对寄生虫进行监测及驱虫工作,加强地面消毒,更换笼舍泥土,改善投喂方式。同时加强新引进动物的检查隔离,及驱虫后的彻底消毒和复查等工作。
[1] 陈小丽,唐耀,王璜,等.福州动物园草食动物消化道寄生虫感染情况及驱虫效果调查[J].畜牧与兽医,2015,47(4):76-79.
[2] 杨光友,张志和.野生动物寄生虫病学[M].北京:科学出版社,2013:12-15.
[3] 李朝品,高兴政.医学寄生虫图鉴[M].北京:人民卫生出版社,2012:39-186.
[4] 林开铅,李友松,程由注,等.福建省实验动物体内外寄生虫调查研究初报[J].福建畜牧兽医,2003,25(5):2-3.
[5] 吕向辉,陈旭旭,袁英群,等.圈养川金丝猴、猕猴肠道寄生虫感染及其形态观察[J].经济动物学报,2010,14(2):92-95.
[6] 曹杰,何国声,徐梅倩,等.野生动物园动物寄生虫调查[J].野生动物,2005,26(6):46-47.
[7] 汪明.兽医寄生虫学[M].3版.北京:中国农业出版社,2006:79-81.
[8] 蔡娟,乔继英,张旭,等.陕西圈养珍稀野生动物肠道寄生虫感染及其形态观察[J].动物学杂志,2009,44(3):63-69.
[9] Lim Y A L,Ngui R,Shukri J,et al.Intestianl parasites in various animals at a zoo in Malaysia[J].Veterinary Parasitology,2008,157(1/2):154-159.
[10] 李家诚,曹杰,何国声,等.野生动物寄生虫的研究进展[J].中国兽医寄生虫病,2007,15(5):45-48.
[11] 索勋.高级寄生虫学实验指导 [M].北京:中国农业科学技术出版社,2005:20-31.
[12] 刘唐美.园养野生动物寄生虫重复感染原因的调查[J].山西科技,2006(3):106-107.

