虎源犬瘟热病毒的分离鉴定及H基因的序列分析
单 芬吴其锐邹洁建花福有陈 武*
(1.广州动物园,广州,510070;2.广东省野生动物救护中心,广州,510635;3.深圳野生动物园,深圳,518055)
犬瘟热病毒(canine distemper virus,CDV)属于副黏病毒科(Paramyxoviridae)麻疹病毒属(Morbillivirus)成员。感染的宿主范围较广,包括浣熊科(Procyonidae)、熊科(Ursidae)、灵猫科(Niverridae)、鬣狗科(Hyaenidae)、猫科(Felidae)及鼬科(Mustelidae)等动物[1]。2014年12月陕西珍稀野生动物救护中心4只大熊猫(Ailuropodamelanoleuca)感染犬瘟热死亡,开始对这个疫病的重视。
东北虎(Pantheratigrisaltaica)是我国Ⅰ级保护动物,为濒危物种,Tracie A等研究学者在2013年通过RT-PCR及免疫组化(IHC)等方法证实了2只出现典型神经症状的野外东北虎死于CDV感染[2],而国内尚未见虎感染CDV的相关报道。随着生态环境的变化和CDV对动物流行病因素的适应,加之CDV 变异株的出现,目前犬瘟热呈现的发病率和致死率有所升高、感染动物的宿主范围有扩大的趋势。本研究从死亡东北虎身上采集病料组织通过细胞培养、RT-PCR等方法进行分离鉴定,并对H基因全序列进行分子特征和遗传演化分析,为野生动物特别是濒危猫科动物CDV的有效防控提供科学依据。
1 材料与方法
1.1 样本
病料样本来自广东某地感染CDV病死东北虎的组织。病患临床症状表现为精神沉郁、运动失调、抽搐等神经症状,经抗生素等治疗无效而死亡。病料组织于研钵在冰上剪碎,加上PBS 充分研磨,待研磨完全后,8 000 r /min 高速离心25 min 后取上清液,用0.2 μm 滤膜过滤,-20 ℃保存备用。
1.2 主要试剂
ExTaqDNA 聚合酶、克隆载体pMD18-T、AMV Reverse Transcriptase、dNTPs、工程菌JM109等购自大连宝生物工程公司;Trizol、RNase Inhibitor 购自Invitrogen公司;胶回收试剂盒购自天根生物科技有限公司;Vero细胞由华南农业大学兽医学院传染病实验室保存;DMEM高糖培养基、胰蛋白酶、新生胎牛血清购自Hyclone 公司。
1.3 细胞复苏及病毒培养
从-80 ℃取出冻存的Vero 细胞,置于37 ℃水浴锅水浴5 min,800 r /min 离心3 min,弃去上清,加入含有10%胎牛血清的DMEM高糖培养基吹打混匀后,分装在细胞培养瓶中,置于细胞培养箱37 ℃静置培养。待Vero 细胞长至80% 后,弃去培养基,加入1 mL 制备好的病毒液接种细胞,放入细胞培养箱,37 ℃静置培养2 h,待病毒吸附后,弃去病毒液。加维持液继续放于细胞培养箱37 ℃静置培养,盲传3代后,再接种细胞,每日观察细胞CPE,当CPE达到80% 时收获病毒液,分装冻存于-80 ℃冰箱备用。
1.4 基因克隆和测序
使用E.Z.N.A.Viral RNA Kit(OMEGA,美国)进行病毒RNA 的提取,参照SuperScript III(Invitrogen,美国)操作说明进行反转录。用犬瘟热病毒基因特异性引物,PCR扩增CDV H基因保守片段,引物由华南农业大学兽医学院传染病实验室提供,鉴定引物信息如下:上游 5′-ATAGATGTCTTGACACCGCTCTT-3′,下游 5′-GTACATACCTTGGCTTTGGAACT-3′,目的片段预计大小为580 bp。参考NCBI中犬瘟热病毒H基因全长序列,设计H基因全长扩增引物,引物序列略。PCR产物经琼脂糖凝胶回收试剂盒回收后,与pMD18-T 载体连接,连接产物转化至大肠杆菌JM109感受态细胞,初步鉴定正确的重组质粒由深圳华大基因公司测序。
1.5 序列分析
用Lasergene Version 7.1 软件的SeqMan拼接所得的基因序列,测得序列登陆NCBI,与GenBank中不同犬瘟热的H基因序列进行BLAST分析。同时与下载不同基因型的犬瘟热病毒序列采用MegAlign进行不同序列、氨基酸比较分析。采用MEGA 5.1软件绘制其H基因的系统进化树。进化树的绘制方法如下:应用Neighbor-joining 法(参数设置为1 000 replications)、最大似然法(ML 法)、贝叶斯法(BI 法)构建的分子系统进化树及Maximum composite likelihood model 比对核苷酸序列。采用NetNGlyc1.0软件进行糖基化位点分析。
2 结果
2.1 病毒的细胞分离
病料经过Vero细胞盲传3代后再接种Vero细胞,到第3天时细胞培养基中出现明显的细胞脱落和死亡;第4天,出现明显的块状细胞脱落,细胞CPE病变明显。图1、图2所示为病料肺、肾组织接种Vero细胞传代6次之后的细胞变化。

图2 Vero细胞肺6代Fig.2 The sixth generation of Vero cells in lung
2.2 犬瘟热H基因特异性鉴定引物的RT-PCR扩增结果
提取犬瘟热病毒的RNA,经RT-PCR扩增、1%的琼脂糖凝胶电泳之后,结果得到大小约为580 bp的目的基因片段,结果与预期大小一致,其中泳道1、2、3、4分别为不同脏器组织样本的扩增结果(图3)。
2.3 H基因的序列及遗传演化分析
获得的H基因序列经DNASTAR Version 7.1 软件包中的seqman 软件拼接正确无误后,命名为CDV-1,登陆NCBI,经BLAST 分析,各基因与GenBank中核苷酸序列相似性最高的毒株列于表1。从表中可以看出分离株的H基因与1999年中国小熊猫(Ailurusfulgens)源分离株、2014年中国东北虎源的犬瘟热病毒分离株的H蛋白核苷酸序列相似性最高,均为99%。
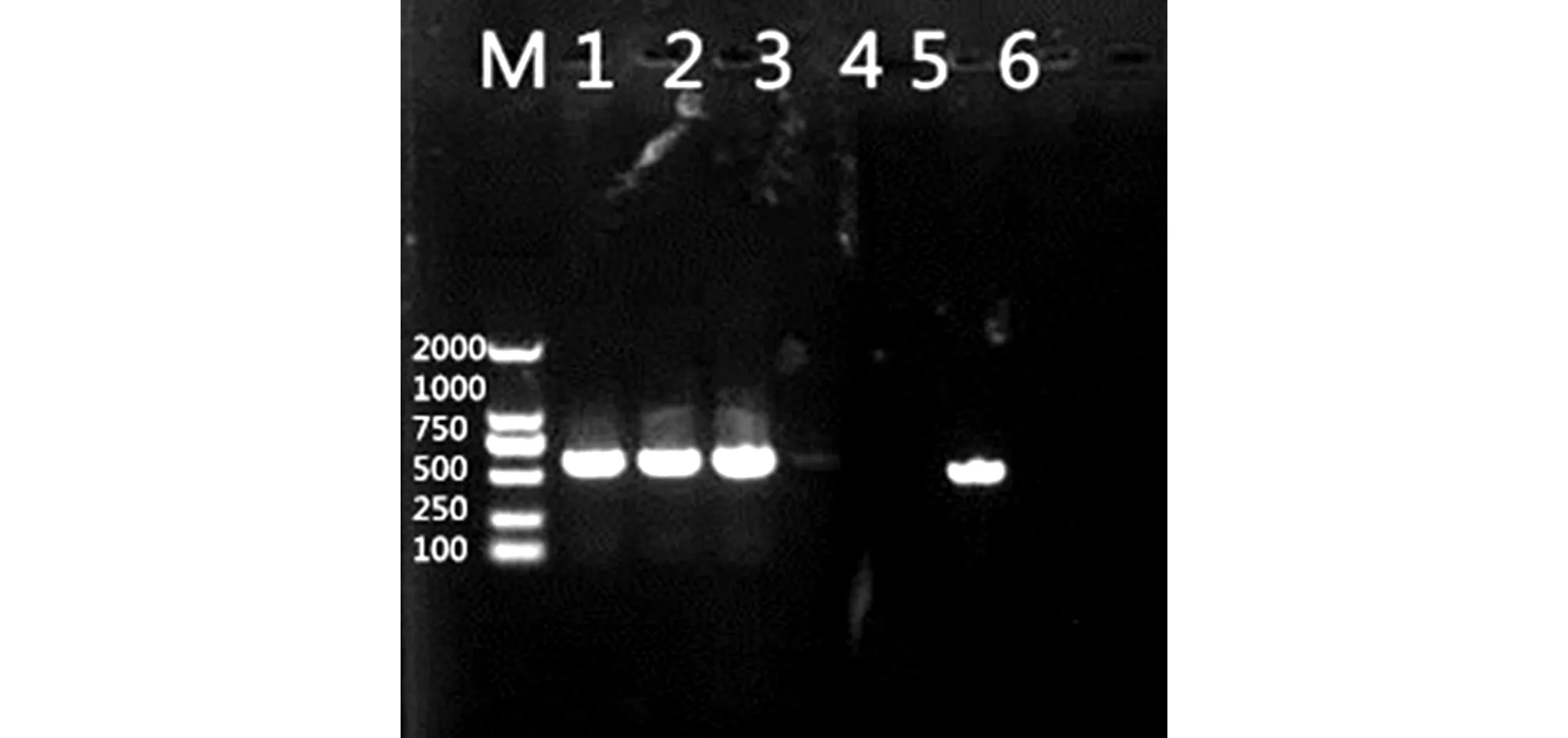
图3 RT-PCR扩增的H基因Fig.3 RT-PCR amplification of H geneM:DL 2 000 marker;1、2、3、4:H 基因PCR扩增产物;5:阴性对照;6:阳性对照M:DL 2 000 marker;1、2、3、4:H gene;5:Negative control;6:Positive control
表1 分离株与GenBankTM中核苷酸序列相似性最高的毒株

Tab.1 Homology of the isolate H genes from siberian tiger with the related sequences in GenBankTM
登陆GenBank下载不同基因型的CDV代表毒株,采用MegAlign软件进行核苷酸序列及编码氨基酸的比对分析。其中本分离株与标准强毒株A15/17的氨基酸相似性为96.2%;而与经典疫苗Onderstepoort株的氨基酸序列相似性仅为89.8%;与其他疫苗株SH、CDV3、Convac、lederle的氨基酸序列相似性分别为91.6%、91.6%、91.3%、91.8%;与其他Asia-1基因型的毒株相比氨基酸序列相似性在95.9%~97.5%之间。不同CDV分离株氨基酸序列相似性比对结果详见图4。
采用MEGA 5.1软件绘制CDV H基因的系统进化树,采用3种方法构建H基因进化树,3种方法的拓扑结构完全一致,结果见图5。由图5可知:本研究分离株CDV-1位于Asia-1,和目前我国犬瘟热流行毒株流行情况一致。与疫苗株属于的America-1(Vaccine strain)亲缘关系较远。在Asia-1基因分支内,与另外一株东北虎源分离株一起形成一个小的进化分支。CDV分离株遗传演化分析结果详见图5。
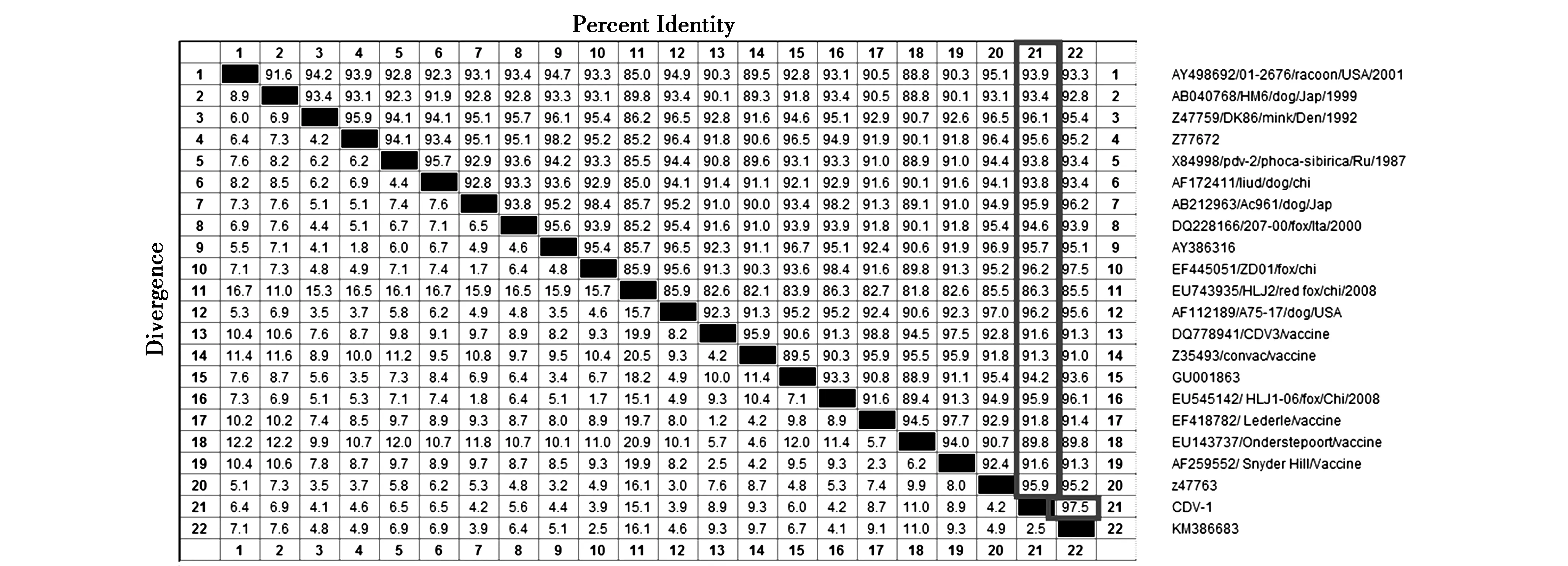
图4 不同CDV分离株氨基酸序列相似性比对Fig.4 Similarity comparison of amino acid sequences between different CDV isolates
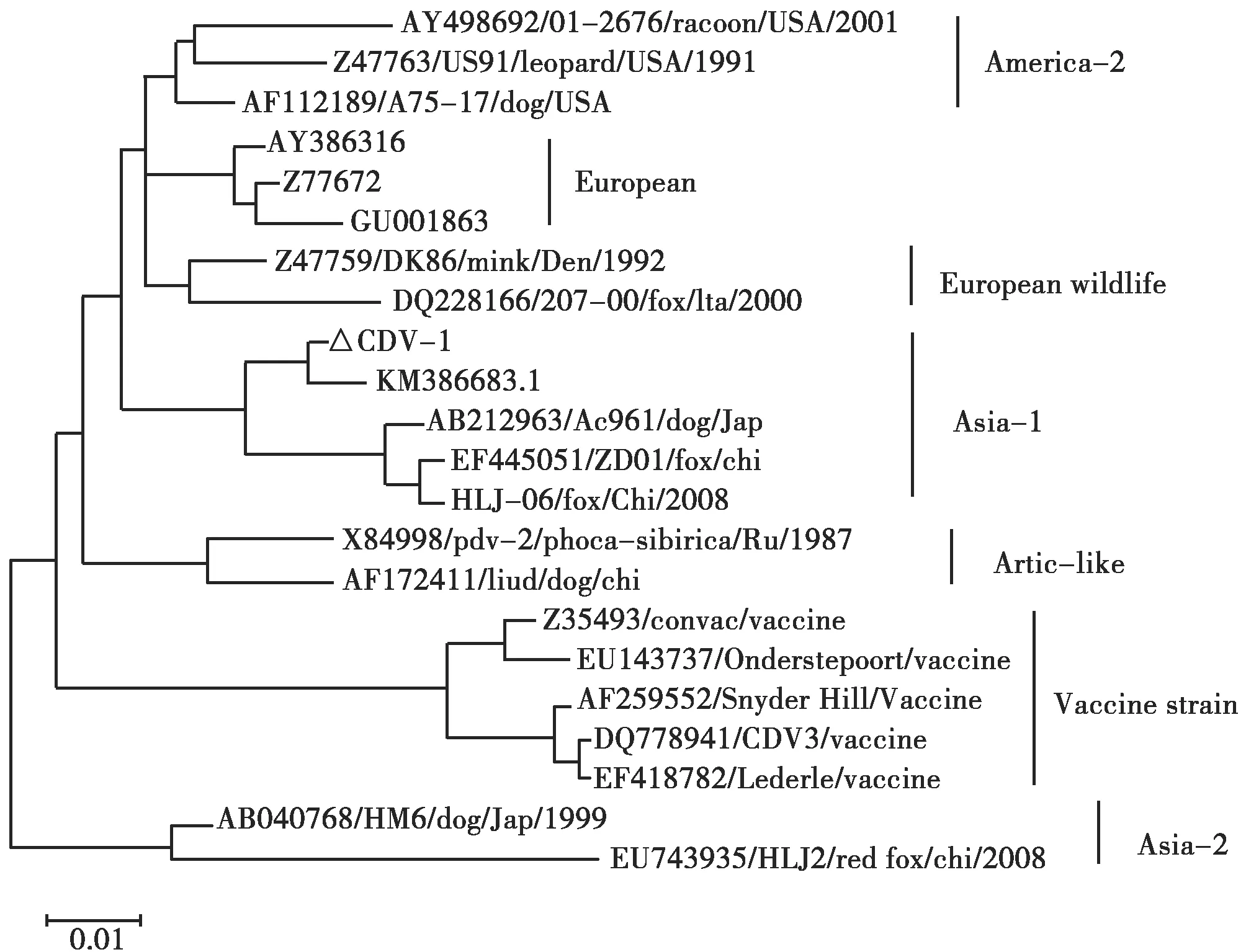
图5 不同CDV毒株H基因遗传演化分析Fig.5 The phylogenetic tree of CDV strains based on H gene sequence
CDV H蛋白作为重要的膜蛋白,主要通过与宿主体内SLAM受体的结合从而可以复制。研究表明H蛋白个别氨基酸位点改变会影响与SLAM受体的结合能力。文献报道这些位点集中在525、526、529、530、549等位点。分析发现本分离株的这几个位点氨基酸与强毒株A75/17完全一致,与疫苗株相比530、549位氨基酸差异明显。详细情况见表2。
本研究毒株H蛋白氨基酸序列与其他Asia-1型毒株相比在V47、M50、N77、R110、F198、T245、S265、N277、V337、A365、S388、V522等位点发生变异。
大量研究表明,H蛋白的糖基化位点的个数和位置与病毒的复制能力有关。采用NetNGlyc1.0软件进行H蛋白糖基化位点分析,结果显示:本研究的分离株具有9个糖基化位点,其中包括309-311位的野毒株特有的糖基化位点。而疫苗OP株仅有4个、其他几个疫苗株均含有7个。本研究毒株在其他位点没有发现新增的糖基化位点,这和大量文献中报道的流行毒株的情况相对一致,其他基因型的野毒株含有8个或9个糖基化位点。详细情况见表3。
表2 不同毒株与SLAM受体结合位点分析

Tab.2 Analysis of binding sites of SLAM receptor in different strains
表3 不同毒株N-糖基化位点
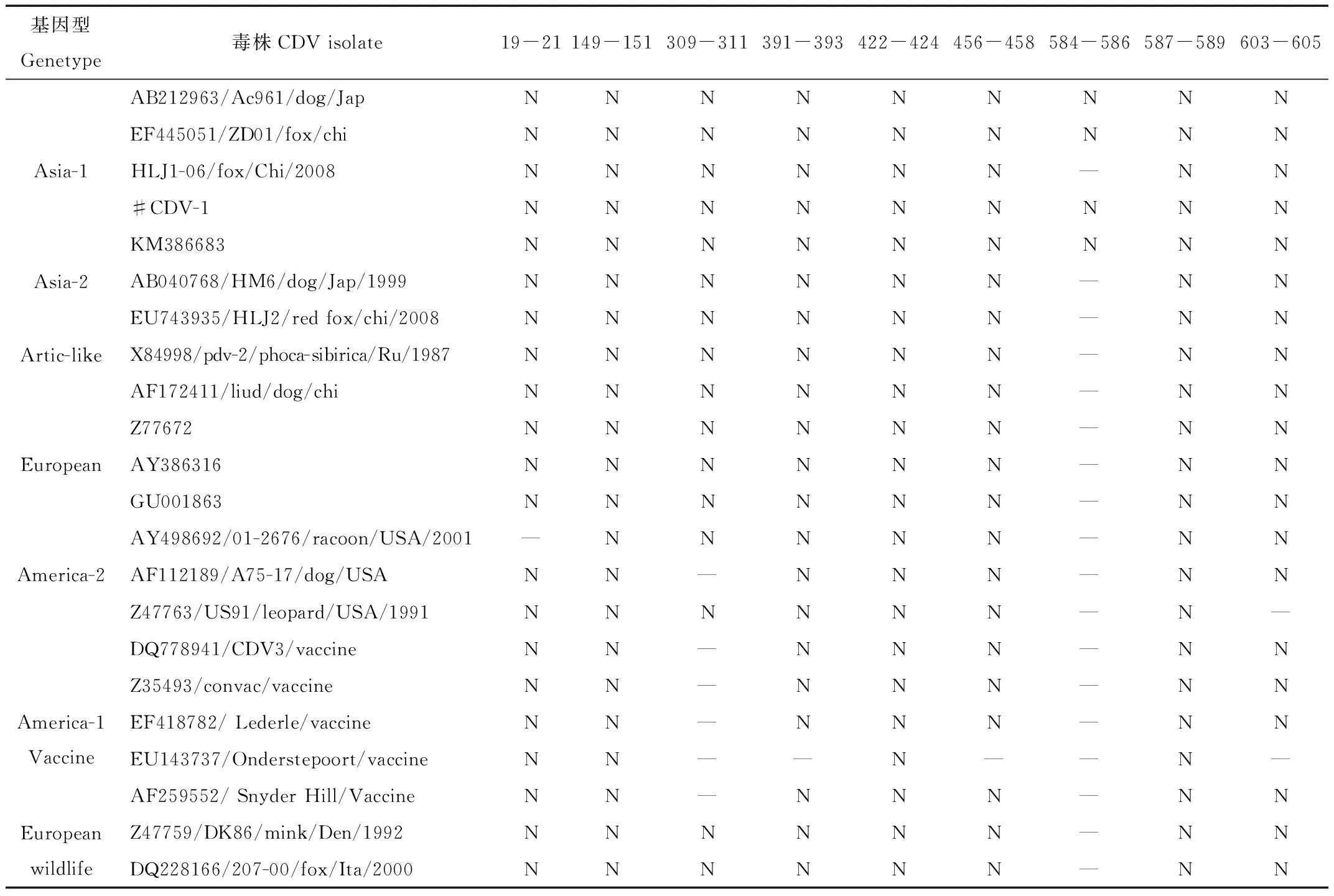
Tab.3 Distribution status of N-glycosylation sites of H gene in different genetypes of CDV
注:N代表糖基化位点;— 代表无此糖基化位点
Note:N N-glycosylation sites;— Negative
3 讨论
3.1 犬瘟热(CDV)H蛋白的氨基酸变异
H蛋白作为犬瘟热病毒表面膜蛋白,还协助病毒的另一囊膜糖蛋白F蛋白介导病毒囊膜与细胞膜发生膜融合,使病毒进入细胞[3]。研究证明:CDV感染动物,宿主体内至少存在两种受体,其中一种就是淋巴细胞信号活性分子(Signaling lymphocytic activation molecule,SLAM),CDV利用此受体,首先在呼吸道淋巴细胞及巨噬细胞中大量繁殖,进而随淋巴液和血液循环,侵染全身各免疫细胞[4]。大量实验研究证明CDV H蛋白个别氨基酸位点改变就会影响与SLAM受体的结合,从而使毒株在细胞内表达发生重要改变[5-7]。A75/17毒株被看作是犬瘟热病毒典型的强毒株A75/17 H 蛋白的Y525、D526 和 R529 是其与 SLAM 受体结合的关键位点。本研究毒株与其相比这3个位点的氨基酸完全一致。这次分离的毒株是否为强毒株,毒力研究还在进一步实验中。研究还表明野毒株的H蛋白530和549位点的改变也会出现与SLAM 受体结合的差异,本研究毒株549位氨基酸为Y,和A75/17等部分野毒株一致,而疫苗株Onderstepoort、CDV3、SH、Convac等则为H,而2013年Tracie A等[2]报道的俄罗斯远东地区东北虎源CDV分离株H蛋白也具有549 Y的特点。本研究分离株的H蛋白的530位为G,与部分强毒株如A75/17等一致,而与所有疫苗株相比均存在差异,CDV3、SH等为N,而OP株则为S。此外,本研究毒株H蛋白氨基酸序列与其他Asia-1型毒株相比在V47、M50、N77、R110、F198、T245、S265、N277、V337、A365、S388、V522等位点发生变异,这些关键位点氨基酸的变异,一方面彰显在高强度疫苗免疫压力下病毒发生变异,另一方面究竟这些变异与病毒的感染宿主、病毒的流行特点等是否有关还有待进一步研究。
H蛋白的糖基化位点的变化与病毒的毒力有明显关系,对本研究毒株H蛋白氨基酸分析表明:潜在N-末端糖基化位点与疫苗株也不同,本毒株具有9个,而目前最常用的疫苗株Onderstepoort株为4个、Convac株的糖基化位点为7个,和其他野毒株一样,具有309-311位的特有糖基化位点。本研究毒株的H蛋白糖基化位点与目前流行的野毒株相比没有发生明显变异,但是与现行疫苗株相比存在明显差异,目前市售疫苗能否给临床动物提供足够抗体保护还有待研究。
3.2 犬瘟热(CDV)的基因型
CDV的基因型与地理位置有关,基于H基因全长序列分析,根据病毒分离株地域流行特点将其分为7个主要基因型:America-1(疫苗株)、America-2、Asia-1、Asia-2、Europe、Artic-like和European野生型。还有些学者将其分为Africa、Asia、Argentina等基因型,其实也是基于病毒地域流行的特点[8]。本研究中虎源CDV分离株属于Asia-1和国内流行的毒株保持一致,与2013年Tracie A等报道的俄罗斯远东地区东北虎源CDV分离株的基因型(Artic-like)存在明显差异[2],这可能与CDV在不同地区流行株氨基酸之间存在较大差异有关。本分离株基因型与疫苗株基因型(America-1)也差异较大,这可能与高强度的疫苗免疫压力下,流行毒株发生变异的可能性较大。
目前国内尚未有虎源犬瘟热感染的报道,CDV不仅仅是引起家犬死亡的第二大病原,同时也是在全球范围内威胁野生食肉动物健康的重要病原,较多动物种类在病原的传播过程中起着病毒存储器的作用,而疫苗接种是控制本病发生的最好方法[9]。而目前并没有针对圈养野生动物的犬瘟热疫苗,市面上针对宠物的犬瘟热疫苗应用于野生动物时候应格外慎重,可能会引起动物的发病甚至死亡[10]。Seimon等研究中指出通过免疫家犬来达到保护野外东北虎的目的[2],因为有东北虎捕猎家犬的案例发生,这项建议对于以猪肉、鸡肉为食的圈养虎则不适用,而直接免疫老虎,这显然存在一定的安全隐患。在疫苗的选择方面重组载体疫苗在安全性和有效性具有独特优势而应该被优先推荐,但是由于商品采购困难等原因,在实际的临床使用中存在一定限制。
本研究在国内首次分离了一株虎源CDV,并对病毒的H蛋白进行系统分析,在目前缺乏野生动物犬瘟热疫苗的情况下,了解流行毒株的分子生物学特点、流行毒株的病毒变异情况,对于该病的有效防控有重要意义。同时也要求野生动物研究人员平时应注重对易感动物如小熊猫、虎、狼(Canislupus)等CDV血清学抗体等数据的积累,对CDV在圈养野生动物中的流行情况做详细调查,同时积极从事专项用于野生动物犬瘟热防控疫苗的研究。
[1] Sakai K,Nagata N,Ami Y,et al.Lethal canine distemper virus outbreak in cynomolgus monkeys in Japan in 2008[J].Journal of Virology,2013,87(2):1105-1114.
[2] Seimon T A,Miquelle D G,Chang T Y,et al.Canine distemper virus:an emerging disease in wild endangered Amur tigers(Pantheratigrisaltaica)[J].mBio,2013,4(4):e00410-e00413.
[3] Guo Ling,Yang Shaolin,Wang Chengdong,et al.Phylogenetic analysis of the haemagglutinin gene of canine distemper virus strains detected from giant panda and raccoon dogs in China [J].Virology Journal,2013,10(1):109.
[4] Kapil S,Allison R W,Johnston L,et al.Canine distemper virus strains circulating among North American dogs[J].Clinical and Vaccine Immunology,2008,15(4):707-712.
[5] Origgi F C,Plattet P,Sattler U,et al.Emergence of canine distemper virus strains with modified molecular signature and enhanced neuronal tropism leading to high mortality in wild carnivores[J].Veterinary Pathology,2012,49(6):913-929.
[6] Maes R K,Wise A G,Fitzgerald S D,et al.A canine distemper outbreak in Alaska:diagnosis and strain characterization using sequence analysis[J].Journal of Veterinary Diagnostic Investigation,2003,15(3):213-220.
[7] Terio K A,Craft M E.Canine distemper virus(CDV)in another big cat:should CDV be renamed carnivore distemper virus?[J].mBio,2013,4(5):e00702-e00713.
[8] Mochizuki M,Hashimoto M,Hagiwara S,et al.Genotypes of canine distemper virus determined by analysis of the hemagglutinin genes of recent isolates from dogs in Japan[J].Journal of Clinical Microbiology,1999,37(9):2936-2942.
[9] Stanton J B,Givens L,Evermann J F,et al.Immunohistochemical analysis of two strains of lion(Pantheraleo)-adapted canine distemper virus in ferrets(Mustelaputoriusfuro)[J].Veterinary Pathology,2003,40(4):464-467.
[10] 张晓明,单芬,陈武,等.小熊猫犬瘟热病毒的分离鉴定及分子特点[J].畜牧与兽医,2013,45(10):60-63.

