圈养虎迟缓爱德华氏菌的分离鉴定及药敏分析
陈茂金黄海玲付党华黄 萃邬向东*
(1.江西农业大学动科院,南昌,330045;2.南昌市动物园管理处,南昌,330006)
华南虎(Pantheratigrisamoyensis)是中国的十大濒危动物之一、国家Ⅰ级保护动物,红色物种名录极度濒危,在野外已灭绝。目前南昌市动物园饲养着20多只圈养华南虎,为更好保护该虎群,采集华南虎新鲜粪便,进行了细菌分离,通过扩增16S rRNA基因片段分析,确定分离到一株迟缓爱德华氏菌(Edwardsiellatarda)。
该菌属于肠杆菌科(Enterobacteriaceae),爱德华氏菌属。为革兰氏阴性杆菌,无荚膜,是一种人畜共患病[1]病原。1962年首次由日本科学家Hoshina从发病鳗鲡(Anguillajaponica)体内分离发现[2]。该菌常发病于水产动物中,给水产养殖业带来巨大的危害,造成不可估量的经济损失;其他动物报道较少,尚无从虎肠道内分离发现的报道[3]。
1 材料与方法
1.1 材料
1.1.1 实验材料
华南虎粪便,采于江西南昌市动物园内一雌性成年华南虎新鲜粪便,粪便偏软但成形,无其他可见临床症状。
1.1.2 引物
根据细菌16S rDNA基因序列,设计特异性引物一对,由上海生工生物有限公司合成,引物序列如下:
16S(F)5′-AGAGTTTGATCCTGGCTCAG-3′
16S(R)5′-GGTTACCTTGTTACGACTT-3′
1.1.3 主要试剂
小牛血清,杭州江滨生物技术有限公司;PCR Mix、100bp DNA Ladder购自北京全式金生物科技有限公司;饱和酚、溴化乙啶(EB)购自上海生工生物工程股份有限公司;胶回收试剂盒购自Omega;Tris碱购自Solarbio公司;SDS、Agarose购自Sigma公司。
1.1.4 主要设备
SW-CJ净化工作台,苏州净化设备有限公司;立式压力蒸汽灭菌器、生化培养箱,上海博讯实业有限公司医疗设备厂;5415R冷冻台式高速离心机,Eppendorf;PCR仪,杭州晶格仪器有限公司。
1.2 方法
1.2.1 细菌分离
无菌操作将约5 g华南虎粪便放入烧杯,并加入95 mL无菌生理盐水混匀做100倍稀释;静置10 min后,取上清做10倍剃度稀释。选择10-6、10-7、10-83个稀释度用无菌棉签蘸取粪便稀释液涂布血清培养基,置37℃电热恒温箱中培养24 h。从培养基内勾取单个、孤立菌落,进行纯化获得菌株;从中选择典型分离株进行16S rRNA基因的PCR扩增。
1.2.2 细菌16S rDNA鉴定
1.2.2.1 菌液制备
取7支无菌5 mL试管,每支加入3 mL LB液体培养基,分别将7个分离菌株挑单个菌落接种到LB液体培养基中37℃、150 r/min振荡培养过夜。待培养基浑浊后停止振荡,取出试管,供提取细菌DNA模板之用。
1.2.2.2 细菌DNA提取
取1 mL对数期菌液,12 000 rpm离心3 min弃上清。加入0.6 mL TE重悬细菌,12 000 rpm离心3 min弃上清,加入100 μL双蒸水煮沸12~18 min;再12 000 rpm离心5 min,取上清即为提取细菌DNA模板,-20℃备用。
1.2.2.3 细菌16S rDNA PCR扩增
扩增体系(25 μL):16S(F),1.0 μL;16S(R),1.0 μL;PCR Mix,12.5 μL;模板 DNA,1.0 μL;ddH2O,9.5 μL;Total 25.0 μL。
PCR 反应条件:按上述体系,将引物、PCR Mix、dNTP、细菌DNA模板依次加入无菌 0.2 mL EP管中,将EP管放入PCR仪,盖好盖子,调好扩增条件进行DNA扩增。94℃预变性5 min,进行扩增循环,扩增条件94℃ 40 s,55℃ 50 s,72℃ 50 s,33个循环;最后72℃延伸10 min结束扩增。
取出反应管,从中吸取6 μL在1%的琼脂糖凝胶中,电泳30 min。在紫外分析仪下观察扩增结果,并拍照记录结果。
1.2.3 PCR扩增产物送检测序
将PCR扩增的产物送至南京金斯瑞生物科技有限公司双向测通测序。
1.2.4 序列分析
将测序得到的7个序列用NCBI中Blast工具进行相似性比较。根据比较的结果,选取参考菌株,采用MEGA6.05软件,用N-J法、ML法、MP法进行系统发育树的构建,并通过自举分析进行置信度检测,自举数集为1 000。
1.2.5 分离菌株药敏实验
麦氏比浊法确定菌液细菌浓度对应3号标准管(约9×108/mL),在血清培养基平板上进行纸片法药敏实验,37℃培养24 h后测量抑菌圈的直径大小,按照中华人民共和国卫生行业标准中纸片法抗菌药物敏感试验标准来确定菌株对不同药物的敏感性。
2 结果
2.1 细菌分离结果
分离细菌经纯化培养获得24个菌株;分离细菌在血清培养基37℃培养24 h后菌落形态大致相似:灰白色、半透明、中间略微凸起、边缘整齐、表面光滑且湿润;革兰氏染色呈阴性,镜检呈短杆状,无芽孢。从中选择7个典型分离株进行PCR扩增,并分别命名为NCH01~NCH07。
2.2 细菌16S rDNA PCR扩增结果
7个分离菌株经过PCR扩增出约1 500 bp大小的基因片段(图1)。
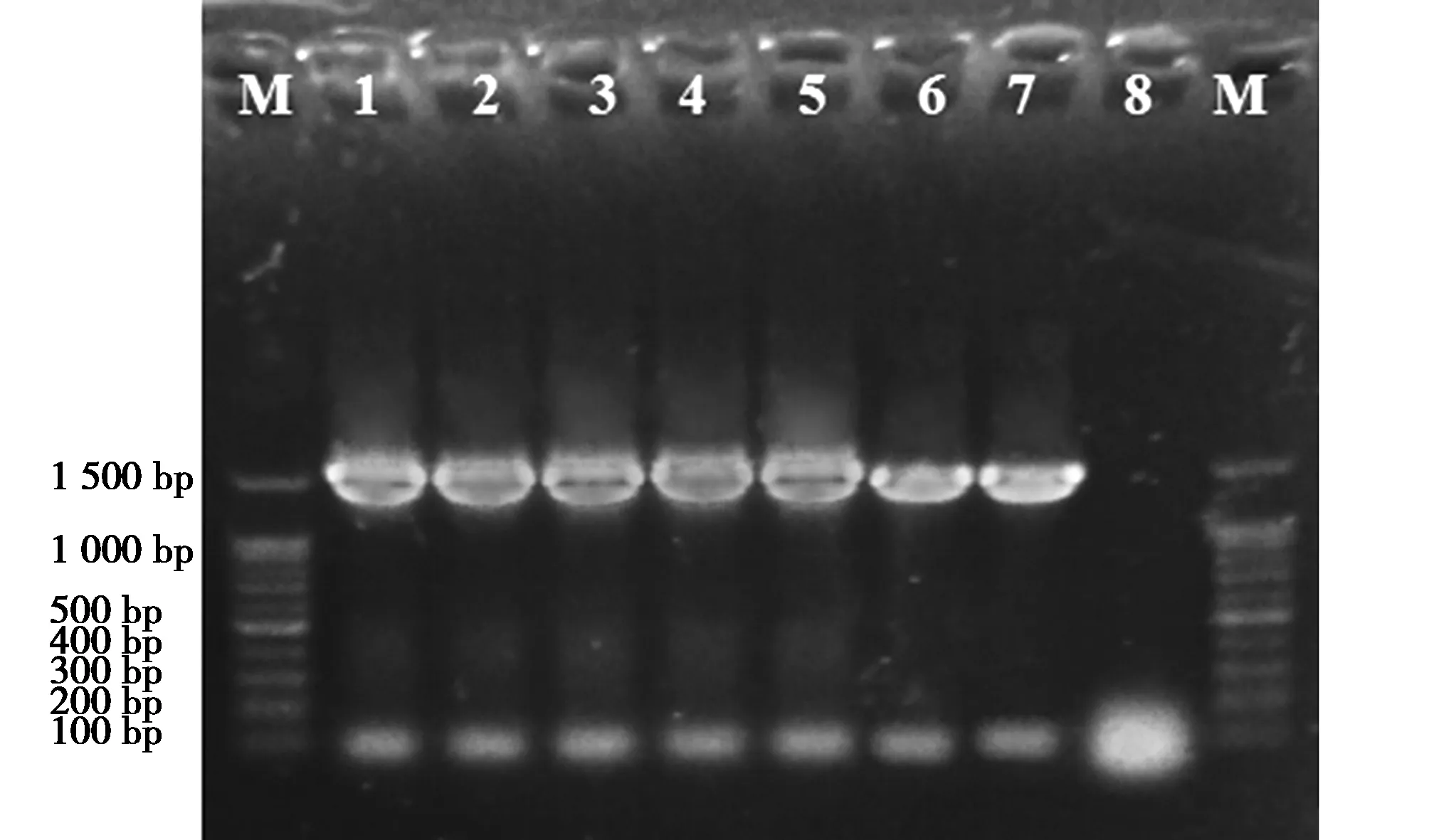
图1 NCH01-NCH07分离菌株16S rDNA扩增产物电泳图Fig.1 Electrophoretic map of 16S rDNA amplification product of NCH01-NCH07 isolated strain 注:M为100 bp DNA Ladder;1~7分别为菌株NCH01~NCH07 16S rDNA 扩增产物;8为阴性对照 Note:M is 100 bp DNA ladder;1-7 is the 16S rDNA amplification product of strain NCH01-NCH07;8 is a negative control
2.3 测序及序列分析结果
经过PCR扩增的7个分离菌株的16S rRNA基因测序后分别与GenBank中序列进行BLAST比对,结果显示分离菌株NCH01、NCH02、NCH04、NCH05、NCH06、NCH07的16S rRNA基因与大肠杆菌(Escherichiacoli)的同源性均达到99%;而NCH03 16S rRNA基因与迟缓爱德华氏菌Su100菌株16S rRNA基因(AB050829.1)同源性达到100%(图2)。分离菌株NCH03的16S rRNA基因片段长度为1 414 bp(图3)。
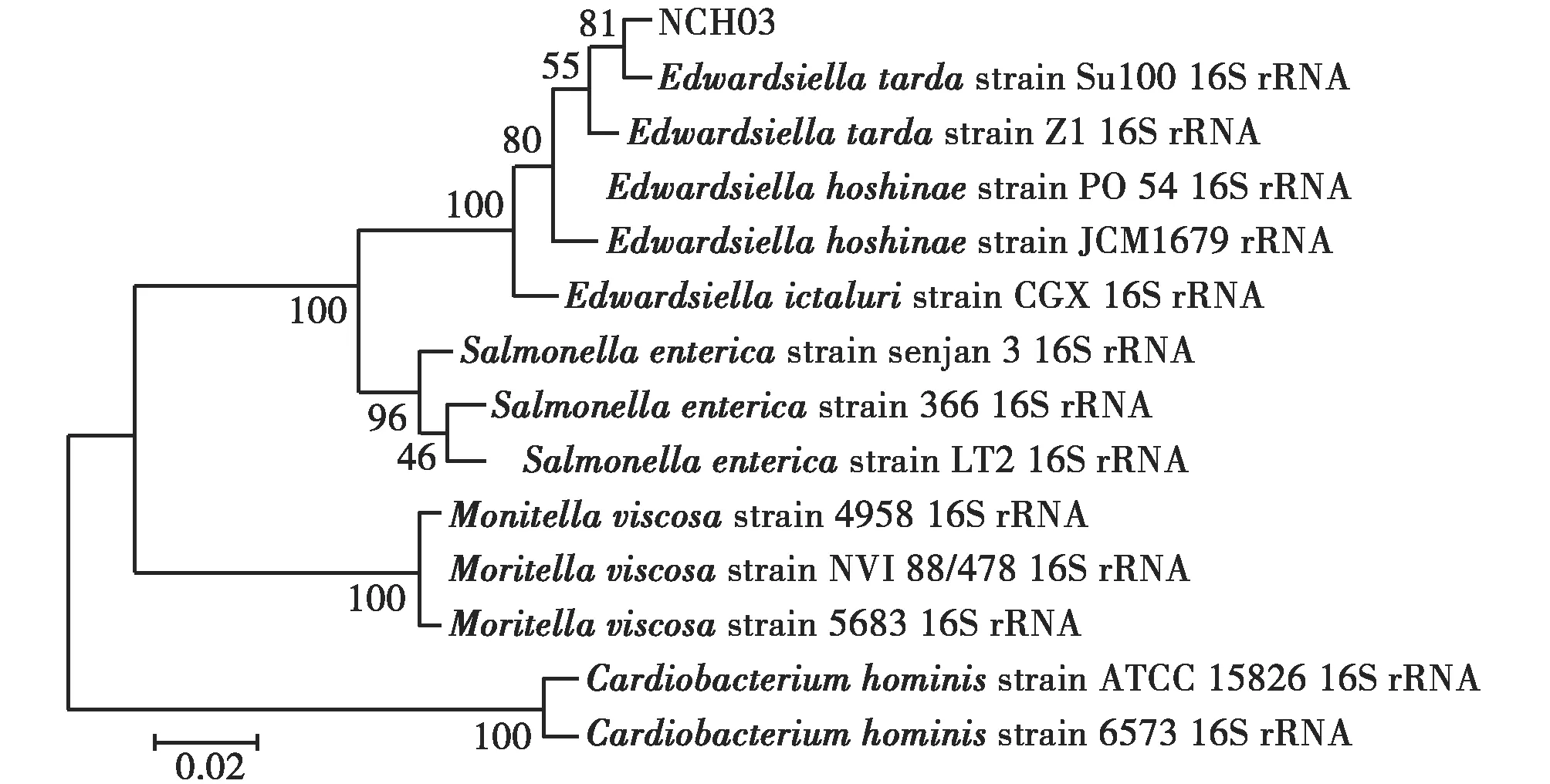
选取迟缓爱德华氏菌(Edwardsiellatarda)、保科爱德华氏菌(Edwardsiellahoshinae)、鮰爱德华氏菌(Edwardsiellaictaluri)、沙门氏菌(Salmonellaenterica)、粘放线菌(Moritellaviscosa)、人肺炎杆菌(Cardiobacteriumhominis)菌株与分离菌株NCH03的16S rRNA基因采用邻接法(Neighbor-Joining)、最大似然法(Maximum likelihood)、最大简约法(Maximum parsimony)构建系统发育进化树,结果都显示分离菌株NCH03与迟缓爱德华氏菌属于同一聚类分支,亲缘关系最近。可确定分离菌株NCH03为迟缓德华氏菌(图4)。

图2 NCH03 16S rRNA基因与迟缓爱德华氏菌Su100菌株16S rRNA基因(AB050829.1)对比图Fig.2 The Comparison Chart of NCH03 16S rRNA gene with Edwardsiella tarda strain Su100 16S rRNA gene(AB050829.1)

图3 菌株NCH03 16S rRNA基因部分序列Fig.3 Part of the sequence of the strain NCH03 16S rRNA gene

(a)
(b)

(c)图4 3种方法构建NCH03 16S rRNA基因系统发育树(a.N-J法,b.ML法,c.MP法)Fig.4 Three methods of constructing NCH03 16S rRNA gene phylogenetic tree(a.Neighbor-Joining,b.Maximum likelihood,c.Maximum parsimony)
2.4 药敏实验结果
分离菌株NCH03对20种药物敏感性测定结果如表1,结果表明:NCH03菌株对氨苄西林、阿莫西林、替卡西林-克拉维酸、头孢曲松、庆大霉素、阿米卡星、头孢噻肟、妥布霉素、氧氟沙星、呋喃妥因敏感;对卡那霉素中敏;对头孢他啶、四环素、多西环素、红霉素、阿奇霉素、林可霉素、复方新诺明、环丙沙星、诺氟沙星耐受。
表1 分离菌株NCH03对20种药物的敏感性

Tab.1 Sensitivity of strain NCH03 to 20 kinds of drugs
注:S敏感;I中等敏感;R抗性
Notes:S Sensitive;I Intermediate;R Resistant
3 小结与讨论
本实验从华南虎新鲜粪便内随机分离到24株菌株,选取7株菌株(命名为NCH01到NCH07)提取其DNA作为模板,通过扩增16S rRNA基因进行同源性分析,初步鉴定菌株NCH03为迟缓爱德华氏菌,其他6株菌株为大肠杆菌。采用菌株NCH03 16S rRNA基因序列进行了系统发育树的构建,以进一步确认菌株NCH03分类地位。结果表明NCH03与迟缓爱德华氏菌同源性为100%且在系统发育树上为一聚类,确定分离菌株NCH03为迟缓爱德华氏菌。NCH03菌株对20种药物敏感性测定,结果显示对10种药物敏感,9种药物耐受,一种药物处于耐受于敏感之间。
本实验旨在通过对新鲜华南虎粪便菌群进行人工培养和16S rRNA基因扩增测序鉴定,从而反映出华南虎肠道菌群构成情况。为判断圈养华南虎肠道健康状况提供依据。对实验中分离到的一株迟缓爱德华氏菌进行药敏实验,实验结果为该圈养华南虎治疗迟缓爱德华氏菌感染用药的选择提供参考,能更好地保护该华南虎群,也为华南虎源迟缓爱德华氏菌后续研究奠定基础。
迟缓爱德华氏菌广泛分布在水环境中,既能感染多种海水淡水鱼类,也能感染两栖动物、爬行动物、哺乳动物等[1,4-6]。宣云峰等[7]从加州鲈(Micropterussalmoide)内分离出迟缓爱德华氏菌。邓显文等[8]从罗非鱼(Oreochromisspp.)内分离鉴定了迟缓爱德华菌。周常义[9]等人从两栖动物牛蛙(Ranacatesbeiana)分离到该菌。陈宗淦,陆亢兴等[4-5]发现人感染迟缓爱德华氏菌的病例。目前尚无华南虎感染该菌的报道。
迟缓爱德华氏菌感染途径较多,许多动物肠道和水体中都含有该菌,接触带毒动物粪便和饮用污染的水源,都可能被感染,从而显现一些临床症状[10],严重危害动物和人的健康。如牙鲆(Paralichthysolivaceus)感染引起腹部膨胀,内有脓液状腹水,肝肾肿大并伴有出血症状[11];牛蛙感染引起腹水病[9];海狮感染引起活动异常、采食量减少、无力等;人感染后可引起肠胃疾病、败血症等[10]。因此,饲养华南虎时应注意饲养环境卫生,勤打扫消毒,饲喂干净水和食物,防止水和食物被该菌污染。这才能更好地保护华南虎。
目前迟缓爱德华氏菌病治疗多以抗生素为主,容易产生耐药性。本实验中对华南虎粪便分离菌株NCH03进行药敏实验,结果显示该菌对20种药物中的10种耐药,具有较强的耐药性。这也加大了保护濒危动物华南虎的难度。中药防治疾病时具有副作用小、不易产生耐药菌的特点。刘克奉等[12]研究了6种中药对迟缓爱德华氏菌的抑制作用,为使用中药防治该病提供了重要依据。
[1] 刘春,李凯彬,王庆,等.斑马鱼迟缓爱德华氏菌的鉴定、致病性及药物敏感性[J].华中农业大学学报,2013,32(3):105-111.
[2] 邵建春.黄鳝源迟缓爱德华氏菌的鉴定、分型及全基因组测序[D].武汉:华中农业大学,2016.
[3] 叶旭红,林先贵,王一明.养殖澳洲宝石鱼迟缓爱德华氏菌的分离鉴定及致病基因的检测[J].淡水渔业,2010,40(1):50-54.
[4] 陈宗淦,朱江,魏威,等.迟缓爱德华氏菌败血症3例[J].大理医学院学报,1998,7(3):54-55.
[5] 陆亢兴.爱德华氏菌致肝脓肿[J].临床检验杂志,1990,8(3):164.
[6] 吴斌,樊海平,曾占壮,等.欧洲鳗鲡肝肾病病原菌的分离与鉴定[J].中国海洋大学学报:自然科学版,2010,40(11):51-56.
[7] 宣云峰,沈勇亮,杨小猛,等.加州鲈迟缓爱德华氏菌病的检测和防治[J].水产养殖,2014,35(10):8-10.
[8] 邓显文,谢芝勋,刘加波,等.罗非鱼迟缓爱德华氏菌的分离与鉴定[J].水生态学杂志,2009,2(1):114-117.
[9] 周常义,陈晓凤,何仲京.牛蛙迟缓爱德华氏菌变异株K的分离与鉴定[J].集美大学学报:自然科学版,2004,9(1):26-31.
[10] 王波,莫照兰.迟缓爱德华氏菌及其致病机理[J].海洋科学集刊,2007,48:133-139.
[11] 张浴阳,王维娜,王军霞,等.牙鲆爱德华氏菌病的研究[J].水产科学,2003,22(1):34-36.
[12] 刘克奉.6种中草药对2株致病菌的抑菌效果比较[J].水产养殖,2013,34(10):49-54.

