黄樟茎段离体培养体系的建立
戴小英,刘新亮,邱凤英,章 挺,李 江
(江西省林业科学院 国家樟树工程技术研究中心,江西 南昌 330032)
黄樟Cinnamomum porrectum(Roxb) Kosterm俗称油樟、大叶樟,为樟科Lauraceae樟属Cinnamomum常绿阔叶大乔木,是南方珍贵的用材和经济树种,在我国主要分布于广东、广西、福建、江西、湖南、贵州、云南等地[1-2]。黄樟木材属硬木类,硬度中等坚重,具有纹理美观细致,不易开裂变形,耐腐防虫,材性稳定,气味芳香等优良特性,是木地板、高档家具制作以及室内装饰的优质材料;其叶中富含精油成分,可提制多种香精,供食品、医药和日用化工用,是重要的天然精油植物资源;其干形通直,树冠分枝匀称,四季青翠,生长迅速,是极具发展前景的园林绿化和行道树种[3-5]。本课题组前期研究发现,黄樟母树结实量小,种子在幼期易被鸟虫侵害,加之种子繁殖的后代性状分化较大,母本优良性状难以通过有性繁殖保存,为黄樟优良品系的选育和推广带来了较大困难[6]。组织培养具有繁殖速度快、繁殖系数大的优点,不受繁殖材料和季节的限制,可在短时间内获得大量无性系。因此,组织培养是保持黄樟优良性状的重要途径,研究黄樟的组培快繁技术对我国黄樟产业发展具有重要意义。目前,关于樟Cinnamomum camphora(Linn) Presl的组织培养研究已经取得了一定的成果,但对黄樟的组织培养未见报道[7-9]。本研究在借鉴前期樟的组织培养研究的基础上,以黄樟秋稍带腋芽茎段为外植体,建立并优化黄樟茎段的离体培养体系,以期为黄樟的快速繁殖提供技术支持。
1 材料与方法
1.1 供试材料及处理
供试材料采自江西省国家林业局樟树工程中心黄樟基因库(27°53′N,116°47′E)的 3 年生黄樟母树。9月采集当年萌发饱满隐芽新枝,去顶、剪取顶芽以下3~4个带腋芽茎段,用洗洁精溶液浸泡10 min后,毛笔刷洗去枝条表面污垢,将茎段剪成1~2个芽一节,放置流水下冲洗30 min。在超净工作台上用体积分数75%酒精消毒45 s,用0.1%的升汞消毒6~8 min,无菌水冲洗3次,消毒处理后的材料插入启动培养基。
1.2 启动培养基的筛选
以1/2MS、MS、改良MS(NH4NO30.8 g/L、Ca(NO3)2·4H2O 0.2 g/L)、B5、ER培养基为基本培养基,均添加4.0 mg/L 6-BA、0.5 mg/L NAA的条件下进行茎段诱导试验,筛选出最佳基本培养基种类。将灭菌的带腋芽茎段接种到不同的培养基中培养,每处理接种10瓶,每瓶接种2个茎段,3次重复。培养30 d后,观察记录出芽数和生长状况,统计诱导率:
诱导率=分化不定芽数/接种外植体数×100%。
1.3 继代培养
1.3.1 激素组合对不定芽增殖的影响
待启动培养中腋芽长度为2~3 cm时,切取健壮无污染芽体转入继代培养基继续培养。以启动培养筛选出基本培养基为基础,用改良MS培养基为继代的基本培养基,附加一定浓度的激素组合(2.0 mg/L 6-BA、0.1 mg/L ZT、0.2 mg/L KT、0.2 mg/L NAA、0.5 mg/L IAA),进行激素组合筛选试验。每个处理接种10瓶,每瓶接种2个芽,3个重复。
1.3.2 激素浓度配比对不定芽增殖的影响
在激素组合筛选的基础上,以改良MS培养基为基本培养基,附加一定浓度的6-BA(0.5, 1.0,2.0, 3.0)、KT(0, 0.2, 0.5, 1.0)、NAA(0, 0.05,0.1, 0.5)组合,并采用三因素四水平正交试验设计L16(45),进行激素浓度配比试验。每个处理接种10瓶,每瓶接种2个芽,重复3次。观察记录出芽数和生长状况,计算芽增殖倍数:
芽增殖倍数 = 一个周期培养后芽数 / 接种芽数。
1.4 生根培养
选取继代培养35 d后长势较好的、长度为2~3 cm的不定芽进行生根诱导。以改良1/2 MS培养基为基本培养基,添加不同浓度的IAA(0.2、0.5、1.0)和IBA(0.2、0.5、1.0),将两者进行正交试验组合设计L9(34)。每处理接种10瓶,每瓶3株,重复3次。25 d后统计生根数量和生长状况。
1.5 培养条件
诱导、增殖和生根的培养基均添加30 g/L蔗糖和3.0 g/L卡拉胶,生根培养基添加0.2 g/L活性炭,pH为7.0。培养条件为温度(25±2) ℃,光照强度2 500 lx,光照时间14 h/d。
1.6 数据处理
试验数据采用Excel 2016进行统计,SPSS 17.0进行统计分析和显著性检验(Duncan’s新复极差法)。
2 结果与分析
2.1 基本培养基对黄樟不定芽诱导的影响
5种基本培养基均能诱导黄樟腋芽的萌发,但在不同的培养基中黄樟茎段出芽时间、出芽率和萌芽后生长情况均有差异(见表1)。由表1可知,改良MS培养基中茎段的起始出芽时间为7d,出芽率为76.7%,均高于其他4种培养基,且芽体长势正常,叶绿、健壮(见图1)。MS培养基的出芽率仅次于改良MS培养基,为66.7%,与改良MS培养基差异未达到显著水平(P<0.05),但其起始出芽时间(10 d)晚于改良MS培养基(见图1)。B5培养基的出芽率最低,为45.0%,起始出芽时间较晚,为12 d。因此,黄樟带腋芽茎段最佳启动培养基为改良MS + 4.0 mg/L 6-BA+ 0.5 mg/L NAA培养基。
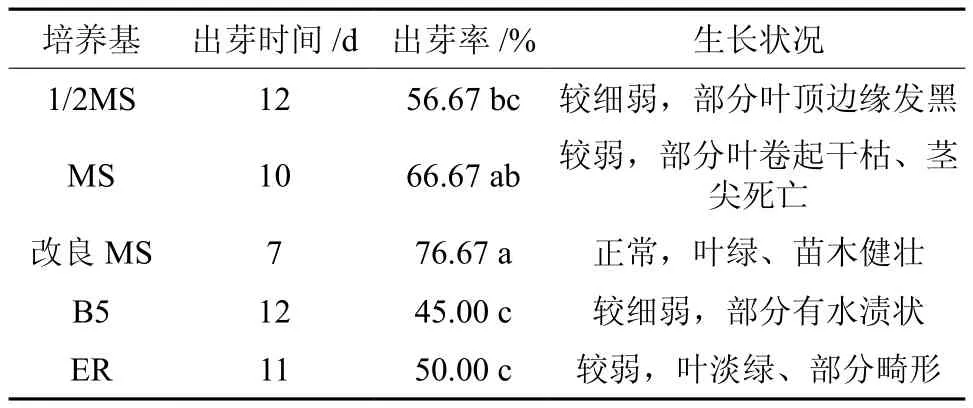
表1 不同基本培养基对茎段不定芽诱导的影响†Table 1 Effect of different basic mediums on the induction of stem in Cinnamomum porrectum

图1 黄樟茎段初芽诱导Fig. 1 Bud induction of stem in C. porrectum
2.2 不同激素的组合对不定芽诱导的影响
黄樟茎段腋芽启动生长后,为了形成一个多芽多枝的丛状结构培养体,需利用外源的细胞分裂素及生长素诱导单芽分化为多个不定芽。本试验在改良MS中添加一定浓度的6-BA、ZT、KT、NAA、IAA,进行激素组合试验(见表2)。由表2可知,在不添加激素的情况下(组合11),茎段萌发出的单芽继续生长,但未分化出新的不定芽。添加6-BA的培养基(组合1~6)中诱导不定芽率明显高于其他不添加6-BA的培养基,说明添加6-BA有利于黄樟茎段不定芽的诱导。在添加6-BA的 基础上,添加NAA可提高诱导不定芽的诱导率。添加6-BA、ZT、NAA激素(组合2)的培养基诱导不定芽率最高,达到了86.7%,与其他激素组合的差异均达到了显著水平(P<0.05),且诱导不定芽较多,生长健壮。添加KT与NAA组合的培养基诱导不定芽率最低,为20.0%,且诱导的不定芽较少。因此,添加6-BA、ZT和NAA激素组合的培养基为诱导不定芽增殖的最佳培养基。
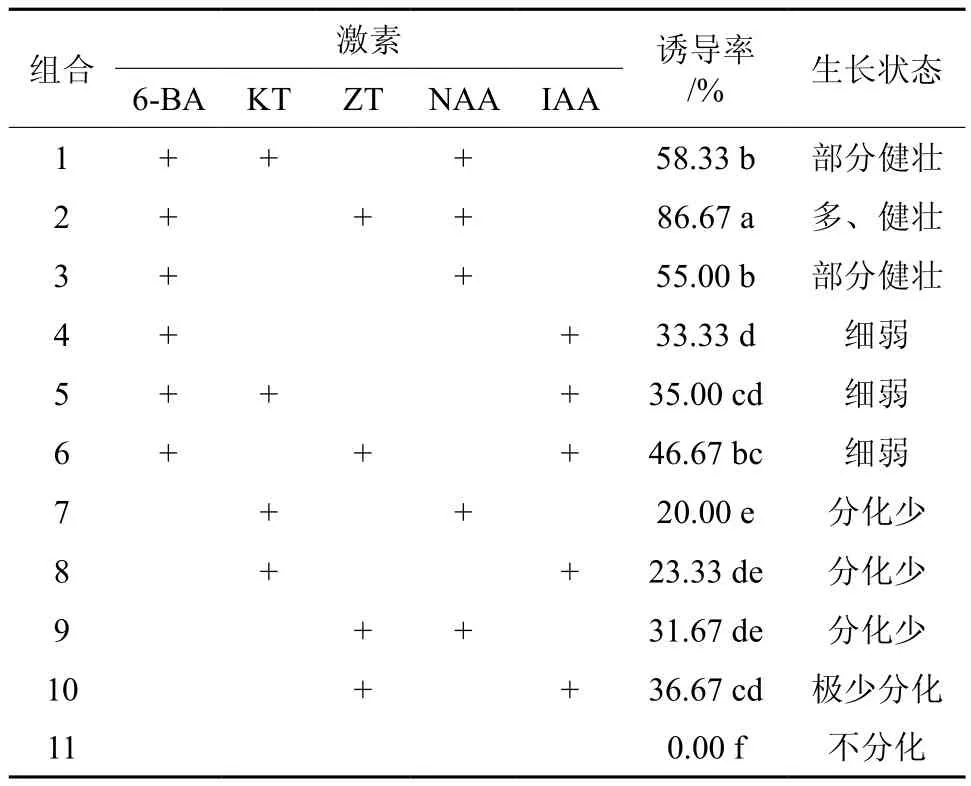
表2 不同激素组合对黄樟不定芽诱导影响†Table 2 Effect of different hormone combination on budding of C. porrectum
2.3 激素浓度配比对黄樟不定芽再生的影响
黄樟腋芽经初期诱导后可获得大量茎芽,继代多次后,发现苗易发生芽密集、顶芽坏死、芽圆头型、愈伤组织过多、丛生芽玻化、褐化、单芽不生长、叶片生长量小、茎细小等问题,直接影响组培苗扩繁速度及植株再生状况。为使无菌体系达到稳定、高效增殖,本试验以2.1和2.2获得的培养条件为基础,采用三因素四水平正交试验进一步研究激素浓度配比对不定芽再生的影响(见表3)。对诱导芽增殖倍数结果进行极差分析发现R6-BA>RZT>RNAA,表明6-BA对不定芽诱导率的影响最大。表4方差分析结果表明,6-BA对黄樟不定芽增殖影响存在显著性差异,而ZT、NAA作用不显著。
当继代培养基中6-BA为0.5 mg/L时,继代3次几乎无新芽,芽体出现明显愈伤,因此低浓度的6-BA不利于诱导黄樟不定芽再生。随着6-BA浓度的升高,不定芽增值系数也不断升高;处理9的不定芽生长旺盛,具有较高的芽增值系数,此时6-BA浓度为2.0 mg/L。由表3直观分析可知,6-BA 4个水平的均值大小依次为:k4>k3>k2>k1,表明水平4(3.0 mg/L)最适于不定芽增殖;但是当6-BA浓度为3.0 mg/L时,芽苗生长状态开始变差,芽密集、细小略呈畸形(见图2)。当NAA浓度为1.0 mg/L时,丛生芽基部出现大量愈伤组织,继代多次后基部扩展到茎上后慢慢发黑直接影响芽体正常生长,故高浓度NAA易造成愈伤组织生长旺盛、细胞团组织松散、不利细胞分化形成苗。因此,综合各项指标,黄樟不定芽增殖的最优激素配比为(处理9):改良MS + 2.0 mg/L 6-BA + 0.5 mg/L NAA(见图3)。
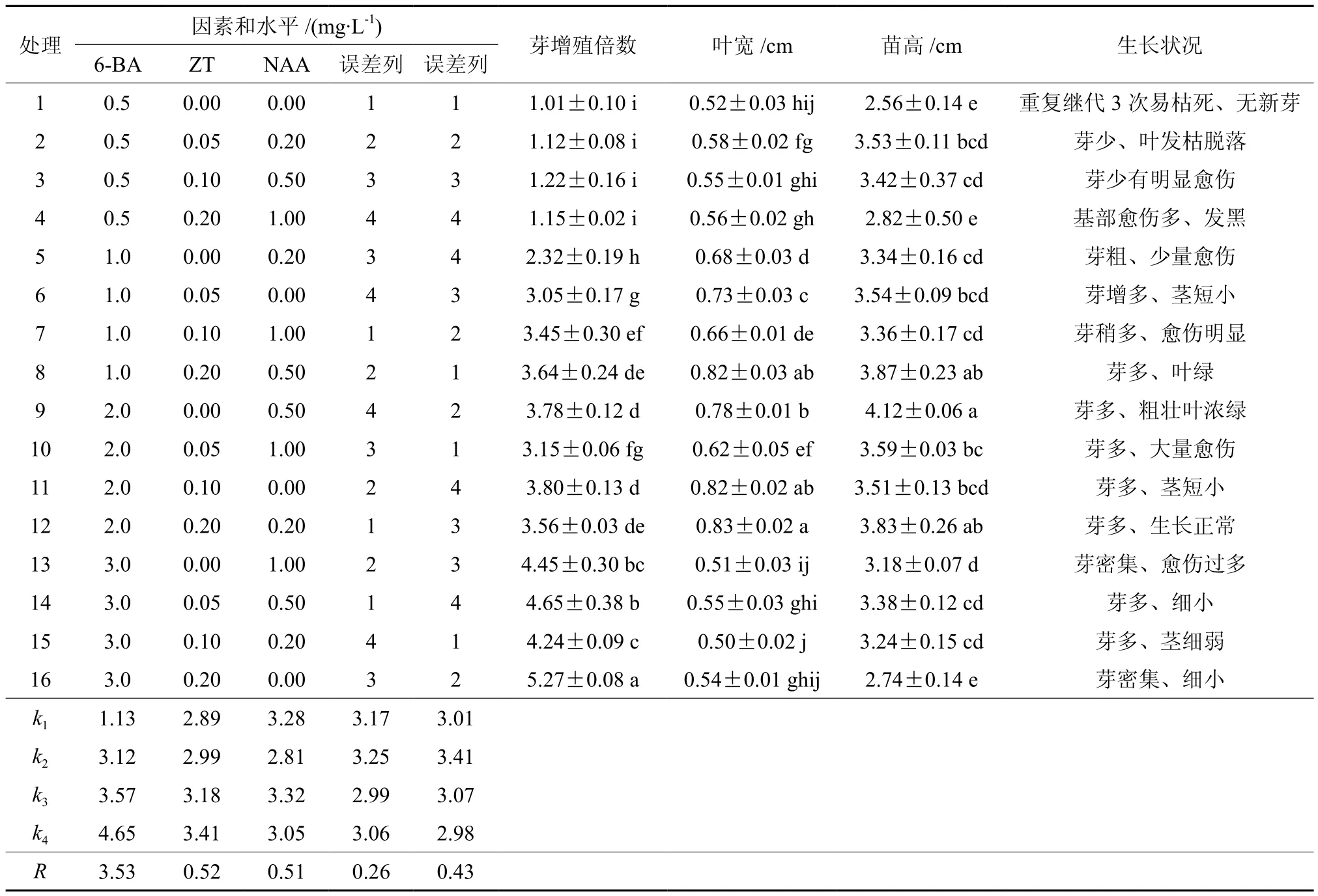
表3 黄樟不定芽诱导增殖正交试验结果†Table 3 Results of orthogonal design of different hormone on cluster buds proliferation
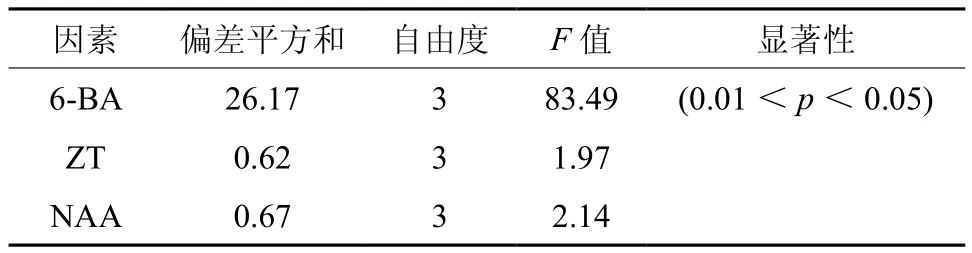
表4 激素处理对黄樟不定芽增殖正交试验方差分析Table 4 Variance analysis of orthogonal design on cluster buds proliferation

图2 3.0 mg/L 6-BA条件下的继代苗Fig. 2 Subcultured seedlings under 3.0 mg/L 6-BA

图3 继代苗(处理9)Fig. 3 Subcultured seedlings (Treatment 9)
2.4 激素组合对组培苗生根的影响
在继代瓶苗中选择高度3~4 cm、2~3片叶、茎干粗壮的单芽插入添加不同激素的改良1/2 MS培养基中,接种25 d后生根率、始发根时间、平均生根数、根系长度及生长状况见表5。结果表明,当培养基中不添加激素时,幼苗不生根;单独添加一种激素时,幼苗生根率均低于60%;添加高质量浓度(1.0 mg/L)IBA或IAA时,根系生长状况较差,容易先形成愈伤后发根。因此,生根培养基中同时添加两种激素有利于幼苗生根和生长,且添加激素浓度不宜过高。处理5的幼苗生根率和平均生根数最高,始发根时间最早,且平均根长最长(见图4);处理8的生根率、平均生根数和根长均仅次于处理5,两者差异未达到显著水平(P<0.05),但其根基略带愈伤,生长状况明显差于处理5。综合各项指标,最适宜黄樟组培苗生根的培养基为改良1/2 MS+0.5 mg/L IBA+0.5 mg/L IAA。
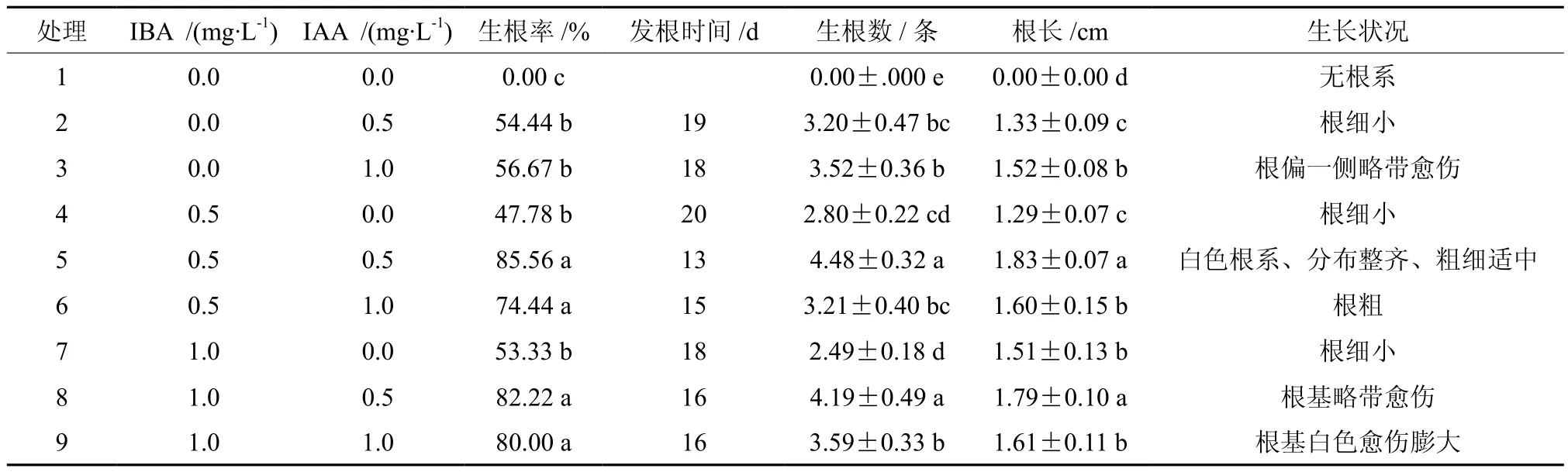
表5 不同质量浓度IBA和IAA组合对黄樟组培苗生根的影响Table 5 Effects of different combinations of IBA and IAA on the rooting of cultured seedlings

图4 黄樟组培生根苗(25 d)Fig. 4 Rooting culture of C. porrectum (25 d)
3 结论与讨论
植物的组织培养技术能够保持母本的优良性状,是大量繁殖和保存珍稀、濒危、芳香和药用植物种质资源的有效途径[10-11]。一般情况下,直接诱导外植体不定芽发生与诱导愈伤再分化相比,诱导不定芽芽体健壮,且组培苗变异程度低[12-13]。常新民等[14]的研究表明,用组培繁殖的芳樟醇型樟的叶精油含量和成分基本保持亲本的特性,而用种子繁殖则发生较大的变异。本研究首次以带腋芽茎段为外植体建立离体快繁体系,且以茎段、茎尖诱导不定芽的方式进行繁殖,此方法是保持黄樟母本性状的有效途径,扩繁的后代遗传性状较为稳定。
本研究表明,5种基本培养基均能诱导黄樟腋芽的萌发,但是在1/2MS、MS基本培养基中出现茎尖生长死亡,或停止生长情况;这两种基本培养基中含钙量较低,较低的Ca2+浓度加上培养容器内高湿环境,易造成Ca2+供应不足,从而导致腋芽生长不良。这与其他一些木本植物组织培养时缺钙时的表现一致,如加拿大紫荆Cercis canadensis、黄连木Pistacia chinensis、俄罗斯矮杏Prunus tenella等,培养基中较低浓度的Ca2+容易造成植物顶部叶片边缘发黑、卷曲,严重时会导致茎尖死亡[15-17]。B5培养基中苗木生长出现玻璃化的原因是由于此培养基中K+含量高,容易引起茎段内外散透压不平衡,从而造成水分吸收过多,引起苗木玻璃化,呈现水渍状。ER培养基种苗木生长出现畸形可能是由于培养基中较低的微量元素浓度较低,对黄樟的细胞分化和形态生成产生很大影响,从而出现畸形苗。改良MS培养基在MS培养基基础上增加0.2 g/L Ca(NO3)2·4H2O,NH4NO3浓度降低至0.8 g/L,相对于其他培养基,降低了NH4+浓度,形成了适宜黄樟腋芽生长的NO3-/NH4+浓度比。另外,改良MS培养基中增加了Ca2+浓度,为黄樟蒸腾流内供应新鲜的Ca2+来源,有利于消除茎枝矮化和玻化现象,因此苗木生长更健壮。
植物生长激素的种类和水平对其生长发育起到关键作用,组织培养中添加一定的外源激素有利于外植体的分化和增殖,促进不定根的诱导[18]。在黄樟茎段的培养过程中,本试验首先对外源细胞分裂素及生长素进行初步筛选,通过对比6-BA、ZT、KT、NAA、IAA 5种激素对黄樟不定芽诱导的影响,6-BA对不定芽的诱导起到主要作用,添加6-BA的培养基诱导不定芽率明显高于ZT、KT,结果与李乾振等试验过程采用ZT、KT取代6-BA对樟的不定芽诱导效果及芽苗质量均不如6-BA的结果是一致的[19]。适宜黄樟不定芽增殖的最优培养基为改良MS + 2.0 mg/L 6-BA + 0.5 mg/L NAA,采用激素的种类和浓度范围与郑红建对樟的茎段不定芽增殖培养的研究结果一致[20]。本研究在继代过程中发现,不定芽基部切口位置易形成大量的膨大白色愈伤组织,随继代次数增加愈伤组织由白色或淡黄色向黑色逐步转变,3~4代后黑色覆盖整个基部并向周围扩散,芽体褐化且分化受阻,已分化的芽体生长不良(见图5)。产生此现象是愈伤组织褐化阻碍营养供给还是次生代谢物对器官组织具有毒害作用,有待于进一步研究和探讨,这与官锦燕等研究牛樟组织培养与植株再生出现情况一致[21]。本研究在继代转接时采取切除愈伤组织的办法,防止黄樟愈伤褐化对芽体繁殖带来伤害,在一定程度上降低了黄樟扩繁速度,增加了育苗成本,为黄樟工厂化生产带来一定影响。在以后的研究中,有待进一步寻求愈伤发生抑制剂及防褐化吸附剂来优化继代培养基配方。

图5 不定芽基部愈伤褐化(继代多次)Fig. 5 Browning on the bottom of cluster buds(subcultured after several times)
茎芽生根是植物实现快繁的关键技术环节和瓶颈问题,组培苗生根效果的好坏直接影响其移栽成活率,而植物组培过程中,激素的种类和浓度是影响组培苗生根的重要因素[22]。吴幼媚等在樟的组培快繁生根阶段发现,一定浓度的IAA和IBA组合有利于组培苗的生根[23],本研究用改良MS培养基添加IBA和IAA,通过不同质量浓度筛选出适宜组培苗生根的最佳激素组合为 0.5 mg/L IBA+0.5 mg/L IAA。经观察,黄樟组培苗生根与其茎枝的生长状态有一定关联,茎枝杆粗壮和叶多、大的组培苗生根所需时间短,根系数量多且一致性强,这是由于组培苗木质化程度高的茎枝分生能力强、生长速度快,光合能力、抗蒸腾能力和适应能力强。因此,黄樟组培诱导生根时应选用生长粗壮、叶生长量大、茎秆红色的茎枝,小枝、弱枝可经壮苗后备用。
[1]曹展波,郑育桃,林 洪,等.江西九连山黄樟生长过程分析[J].中国野生植物资源,2015,34(6): 29-31,39.
[2]王应君.黄樟的生物学特性及大苗培植技术[J].贵州林业科技, 2003,31(3):52-53.
[3]李志辉,李柏海,祁承经,等.我国南方珍贵用材树种资源的重要性及其发展策略[J].中南林业科技大学学报, 2012,32(11): 1-8.
[4]徐明锋,柯娴氡,张 毅,等.粤东6种阔叶树木材密度及其影响因子研究[J].华南农业大学学报, 2016,37(3):100-106.
[5]吴 航,王建军,刘 驰,等.黄樟化学型的研究[J]. 植物资源与环境学报,1992,1(4): 45-49.
[6]国 颖.黄樟叶精油成分分析及化学类型划分研究[D].南昌:江西农业大学,2016.
[7]叶润燕,童再康,张俊红,等.樟树茎段组培快繁[J].浙江农林大学学报,2016,33(1):177-182.
[8]周丽华,蔡燕灵,曾令海,等.樟树优良家系的组培育苗技术研究[J].热带作物学报,2013,34(1): 67-73.
[9]戴小英,章 挺,杨海宽,等.龙脑樟组培繁殖及植株再生技术研究[J].林业科技通讯,2016(8):6-9.
[10]Kumar N, Reddy M P. Plant regeneration through the direct induction of shoot buds from petiole explants ofJatropha curcas:a biofuel plant[J]. Annals of Applied Biology, 2010, 156(3): 367-375.
[11]Asghari F, Hossieni B, Hassani A, et al. Effect of explants source and different hormonal combinations on direct regeneration of basil plants (Ocimum basilicumL.)[J]. Australian journal of agricultural engineering, 2012,3(1): 12-17.
[12]张家瑛,潘超美,苏家贤,等.贡菊不定芽离体诱导增殖培养条件的优化[J].中国现代中药, 2016,18(3):329-334.
[13]杨 宏,陈文静,杨 标,等.长山核桃茎段组织培养初步研究[J].经济林研究,2017,35(2):220-224.
[14]常新民,梁忠云,刘 虹,等.不同繁殖方法对芳樟醇型樟叶油成分的影响[J].林业科技开发, 2013,5(18):70-72.
[15]Alderson P G, Harbour M A, Patience P A. Micropropagation ofPrunus tenellacv.fi rehill[J]. Acta Horticulturae, 1987,(212):463-468.
[16]Barghchi M, Alderson P G. The control of shoot tip necrosis inPistacia veraL. in vitro[J]. Plant Growth Regulation, 1996,20(1):31-35.
[17]Yusnita S, Geneve R L, Kester S T. Micropropagation of white eastern redbud (Cercis canadensisvar.alba)[J]. HortScience,1990,25: 1091.
[18]Hossain MM, Sharma M, Teixeira da Silva JA,et al.Seed germination and tissue culture ofCymbidium giganteumWall. ex Lindl[J]. Scientia Horticulturae, 2010,123(4): 479-487.
[19]李乾振,吴丽君,陈碧华,等.芳樟工厂化育苗技术研究[J].福建林业科技,2001,28(4):21-24.
[20]郑红建.香樟组培快繁技术研究[J].林业科技开发,2012,26(1): 103-105.
[21]官锦燕,谭嘉娜,罗剑飘,等.牛樟的组织培养和植株再生[J].南京林业大学学报(自然科学版), 2016,40(4): 63-68.
[22]周新华,朱宜春,桂尚上,等.多花黄精组培生根技术研究[J].经济林研究,2015,33(4):102-105.
[23]吴幼媚,王以红,陈晓明,等.芳樟醇型樟树组培快繁优化技术[J].林业科技开发,2010,24(6): 78-81.

