不同森林抚育强度对栎类天然次生林细根特征的影响
闫东锋,吴桂藏,王一三,杨喜田
(河南农业大学 林学院,河南 郑州 450002)
细根(D<2 mm)在支持林木生长、固碳以及森林生态系统物质循环和能量流动等方面具有重要作用[1-2]。尽管细根在整个林木生物量中只占很小的比例[3],但是在大部分森林生态系统中,细根周转在整个年生物量产出中占有相当大的份额[4],研究表明,细根生物量产出最高可达5倍于叶生物量产出[5]。在森林生态系统中,地上部分的凋落物和地下部分细根营养物质的归还,在土壤碳和营养积累等方面起到重要作用[6]。细根中的有机碳归还到土壤中,会影响到土壤微生物活性和分解过程[7]。
森林抚育是一种重要的森林生态系统管理措施,深刻影响着森林土壤、树木生长,甚至整个森林生态系统[8]。国内外关于森林抚育间伐对林分植物组成和更新[9]、生长发育[10]、碳密度[11]等方面已经开展了大量研究,但关于森林抚育对细根的研究较少。研究表明,抚育除了会直接影响细根生长环境,更多的是非直接影响,诸如通过改变土壤水分和土壤温度来影响细根生长[12]。研究表明,森林抚育使林分密度下降,蒸腾作用减少,土壤水分含量增加,这可能会影响细根生长[13],但也有研究发现森林抚育对土壤水分无显著影响[14]。与此同时,抚育后会有更多阳光照射,地表土壤温度会上升,这可能会促进细根的生长[13],尤其在地表层。关于抚育对细根生长和形态结构特征影响的研究结论并不一致,如间伐显著减少了侧柏人工林细根总生物量[15],而杉木人工林细根生物量却显著增加[16],根长密度、比根长和根数显著降低[17]。细根生长受多个要素的影响,在不同立地条件、林分类型和森林抚育后持续时间可能得到的结果不同[18]。目前关于抚育对细根生长的影响主要集中在人工针叶林,而对天然次生阔叶林细根的研究较少。
栎类天然次生林是河南山区典型的落叶阔叶林,分布十分广泛,对保障生态安全、大径级木材培育具有重要的生态价值和经济价值。栎类天然次生林往往存在密度过大和丛生等现象,合理的抚育措施可以促进次生林的生长发育和良好干形的形成。本文通过对栎类天然次生林开展森林抚育实验,设置不同抚育强度(轻度21%、中度35%、重度54%和对照0%),森林抚育2年后,调查地表0~20 cm土层细根生物量和形态分布特征,分析不同抚育强度对栎类天然次生林细根生物量和形态结构特征的影响,为开展碳次生林培育、大径级次生林培育和制定科学合理的森林抚育经营技术措施提供理论支撑。
1 研究区概况
研究区位于河南驻马店马道林场、三门峡甘山林场和济源邵原林场,分别处于豫南、豫西和豫北山区,分属桐柏山脉、伏牛山脉和太行山脉等栎类天然次生林在河南的主要分布区。调查区域森林经营和保护状况良好。该区属暖温带-亚热带和湿润-半湿润季风气候。年平均气温为12~16 ℃,无霜期180~240 d,年降水量500~900 mm,且多集中在 7—8 月。森林群落建群种有栓皮栎Quercus variabilis,麻栎Quercus acutissima,锐齿槲栎Quercus alinavar.acuteserrata,槲栎Quercus aliena和油松Pinus tabulaeformis等树种。
2 研究方法
2.1 样地设置与调查
为了保证各处理的可比性,在研究区林分生长发育状况,位置临近、生长环境条件和森林经营措施基本一致的中幼龄栎类天然次生林进行森林抚育,森林抚育采用的是基于近自然经营理论的目标树作业法,主要伐除对目标树生长有影响的干扰树和生长不良的受压木,同时对林地杂灌和粗木质残体进行清理。抚育前林分密度在2 200~2 400株/hm2之间,根据抚育后的林分密度,将调查样地划分为轻度(21%),中度(35%)和重度(54%)3个抚育强度水平,同时设置未抚育样地作为对照(对照与其他处理一样,对林地杂灌和粗木质残体清理)。森林抚育2年后,在每处理水平林分随机选取重复样地4个,面积为0.067 hm2。细根调查是在样地四角及中心选取5个样点,在各样点采用大环刀(直径7.5 cm,高10 cm,体积441.6 cm3),分别取0~10 和10~20 cm 土层的包含有土壤和细根的土壤样柱装入布袋并及时冷藏保存。样地概况见表1。

表1 样地基本情况Table 1 Basic conditions of plots
2.2 细根样品处理
细根是直径<2 mm的植物根系,将野外采集的含有根系样品的土壤经过浸泡、漂洗和过筛,直至根表层无土壤残留。在蒸发皿中,用镊子初步选取直径<2 mm的根系,然后根据根系的颜色、弹性、根皮与中柱分离的难易程度和外形区分活根和死根,如活根有弹性、较坚硬,颜色鲜艳;而死根易折断,颜色暗淡等[19]。将初步选取的根系在Epson数字化扫描仪内扫描,然后用根系扫描系统WINRhizo分死根和活根进行根系扫描,对直径 <2 mm的根系按细根进行统计,输出细根形态结构特征参数细根根长密度(Fine-root length density,FRLD)、细根表面积密度 (Fineroot surface area density,FRSAD)、细根体积密度(Fine-root volume density,FRVD)和细根平均 直 径(Fine-root average diameter,FRAD)。将扫描后的细根样品置于70℃恒温下的鼓风干燥箱中[20],经48 h后称其干重,计算细根生物量密度(Fine-root biomass density,FRBD)和比根长(Speci fi c root length,SRL),比根长(m·g-1)=根长(m)/生物量(g)[21]。
2.3 数据分析
对不同土层厚度、不同抚育强度的死根和活根,利用R软件(https://cran.r-project.org/mirrors/,Rversion 3.3.1)平台[22],使用Vegan(version 2.4-0)软件包[23]对样地进行PCoA (Principal Coordinates Analysis)主坐标分析。PCoA坐标排序中,用Bray-Curtis距离测度排序对象(样地)之间的关系,生成相异矩阵,然后在笛卡尔坐标系中将对象之间的相互关系表达出来,坐标图上的距离对象之间距离远近代表对象在关联测度上的相似性。计算过程是先利用decostand函数对原始数据进行标准化,然后使用vegdist函数计算样地之间Bray-Curtis距离矩阵,最后利用cmdscale函数进行主坐标分析。细根形态结构参数、细根生物量密度和比根长的置换检验利用LmPerm(version 2.1.0)软件包中的avop函数进行。置换检验是在样本量不够大,且分布未知的情况下,采用置换检验模拟出样本均值分布,然后再进行差异性比较。
不同抚育强度之间细根形态结构参数、细根生物量密度和比根长的差异性检验采用R软件kruskal test函数进行Kruskal-wallis非参数显著性检验。
3 结果与分析
3.1 不同抚育强度样地PCoA主坐标分析
利用细根根长密度、细根表面积密度、细根平均直径、细根体积密度、细根生物量密度和比根长等细根结构参数,计算基于上述指标的Bray-Curtis距离矩阵,分活细根和死细根以及不同土层厚度对16块样地进行PCoA主坐标分析,得到排序图(见图1)。
由图1可知,活细根0~10 cm和10~20 cm土层PCoA排序图第1轴分别解释了总方差的73.02%和59.17%,第2轴分别解释了总方差的10.75%和28.31%。与活细根2个土层样地排序图类似,死细根0~10 cm和10~20 cm 土层PCoA排序图第1轴分别解释了总方差的74.45%和76.78%,第2轴分别解释了总方差的15.03%和11.02%。代表不同抚育强度的样地沿第1和第2排序轴有序的排序,对照样地与弱度抚育样地较接近,而与中度抚育和强度抚育样地距离较远(见图1),这说明不同抚育强度之间细根结构存在着一定程度的差别,具体这些指标存在什么变化,还需要对指标进行详细分析。从图1还可以看出,相对于0~10 cm土层,在10~20 cm土层,分别代表弱度抚育、中度抚育和强度抚育各样地聚集程度较高,说明各样地10~20 cm层活根细根结构特征参数较接近,变异较小,也说明细根动态变动在0~10 cm表现的更强烈。
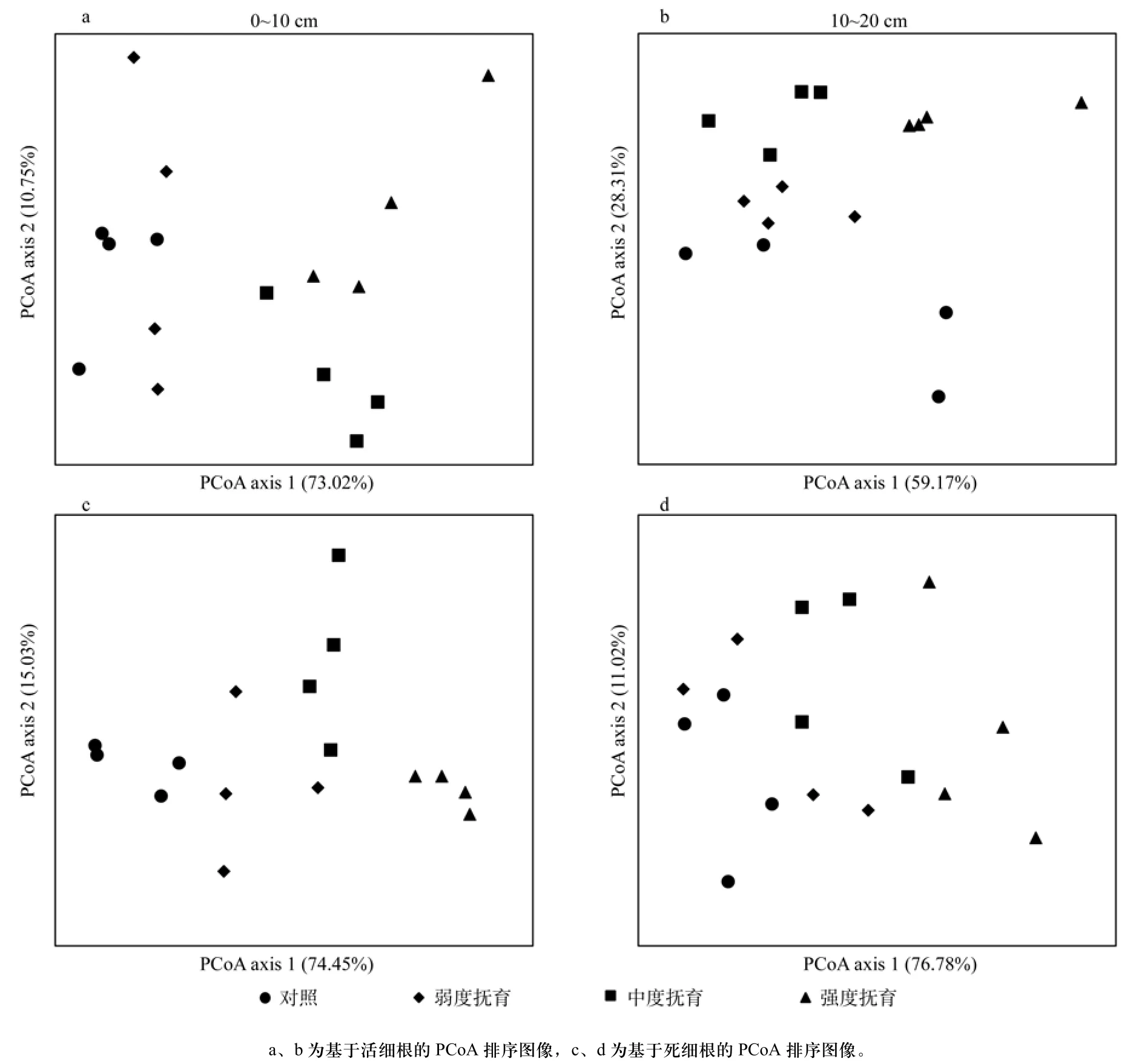
图1 不同土层厚度不同抚育强度样地PCoA排序图像Fig.1 PCoA plots of the samples of different thinning intensities in different soil depths
3.2 细根形态结构特征参数对森林抚育的响应
3.2.1 细根形态结构特征参数置换检验
考虑抚育强度、土层厚度以及两者交互作用,对细根形态结构特征参数进行置换检验,结果见表2。不管是活细根还是死细根,细根根长密度、细根表面积密度、细根平均直径和细根体积密度在不同抚育强度之间存在显著差异(P<0.05)。除活根根体积密度外,各细根形态结构特征参数在土层厚度之间存在显著差异(P<0.05)。除活细根表面积密度和死细根长密度外,抚育强度和土壤厚度的交互作用并未造成活细根和死细根其余各细根形态结构参数的显著差异(P> 0.05)。上述结果与PCoA排序结果基本一致,即抚育造成了0~20 cm土层各细根形态结构特征参数值显著差异,同时大部分细根形态结构特征参数在土层0~10 cm和10~20 cm之间存在差异(P<0.05),说明森林抚育对细根形态结构的影响在土层中存在较为明显的垂直分布差异特征。
3.2.2 细根形态结构特征参数对森林抚育的响应
图2和图3分别为活细根和死细根在不同抚育强度和不同土层厚度条件下各形态结构特征参数箱图,均值采用中位数和算术平均数描述。死细根代表了根系周转和营养物质回归到土壤中的能力和速率,不同抚育强度死细根结构特征参数与活细根变化规律基本一致,即在相同土层厚度下,随着抚育强度的增加,各细根形态结构特征参数值均呈现不同程度的上升趋势,且中度抚育和强度抚育均显著高于弱度抚育和对照(P<0.05),这说明这2个处理水平对细根生长造成了显著影响。10~20 cm土层各细根形态结构特征参数值小于0~10 cm土层,且在不同抚育强度之间的变化没有在0~10 cm土层明显,这与PCoA的分析结果基本一致,即与10~20 cm土层相比,森林抚育对0~10 cm土层细根生长和周转的影响更为明显。
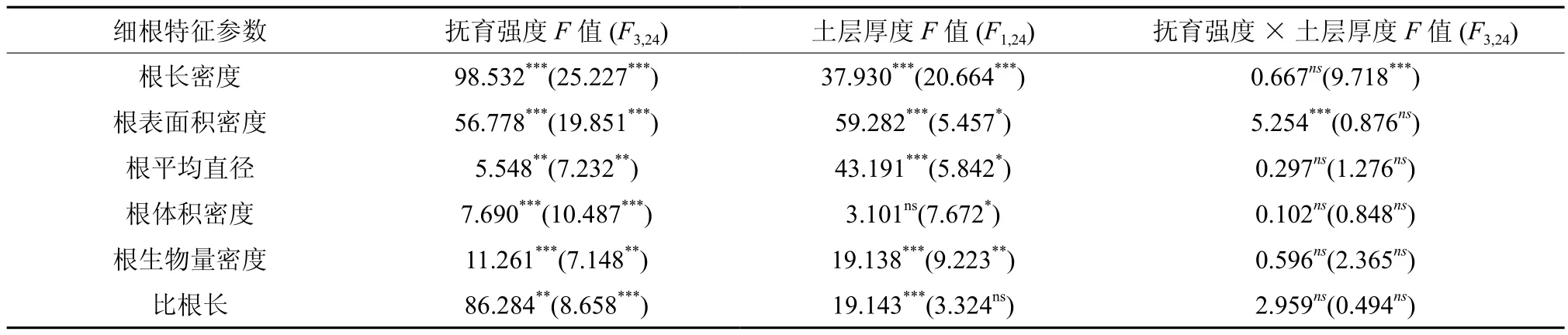
表2 不同抚育强度、不同土层厚度细根形态结构特征参数和细根生物量密度、比根长置换检验†Table 2 Permuted analysis of variance of characteristic parameter of fine-root morphology, fine-root biomass density and specific root length in different thinning intensities and soil depths
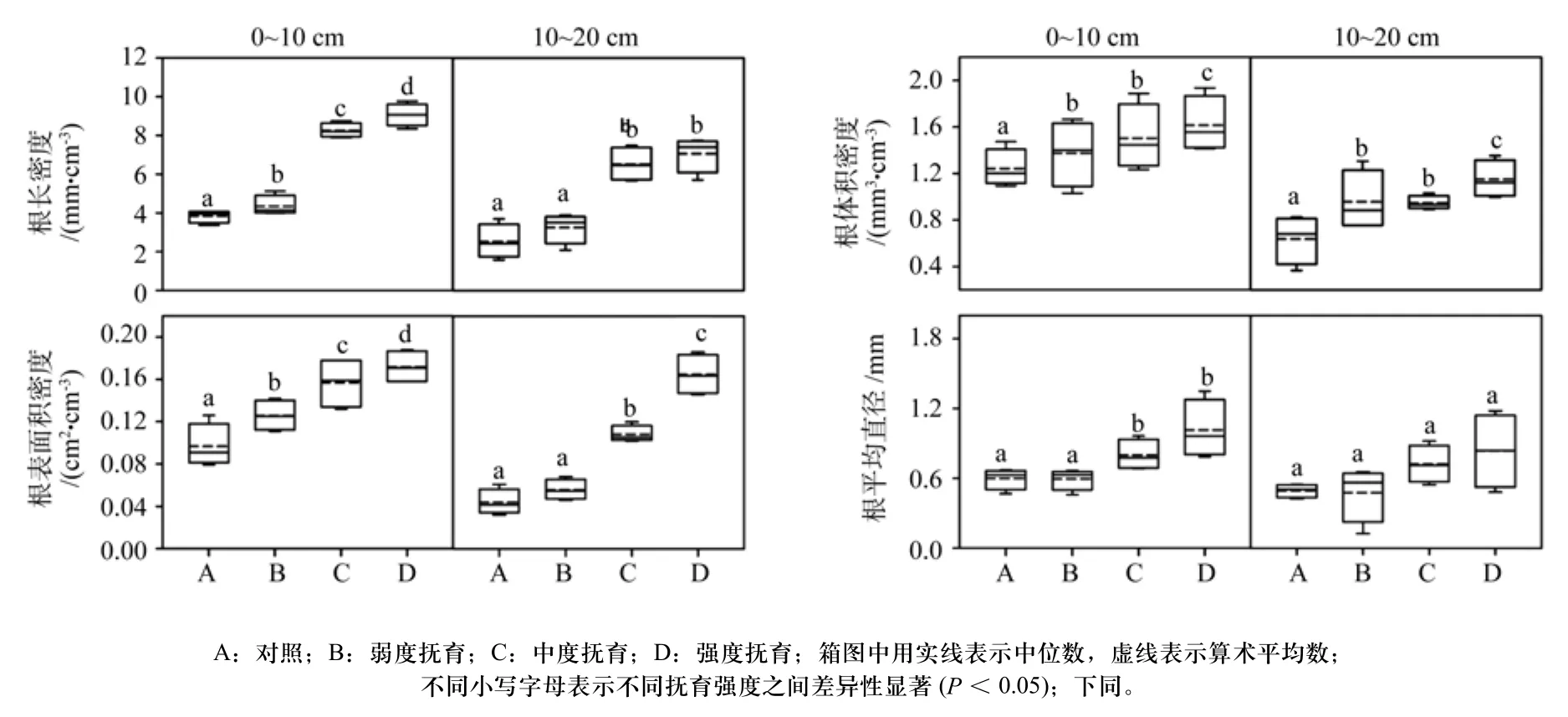
图2 不同抚育强度各活细根形态结构特征参数的变化趋势Fig.2 Trends of characteristic parameters of live fi ne-root morphology of different thinning intensities

图3 不同抚育强度各死细根形态结构特征参数的变化趋势Fig.3 Trends of characteristic parameters of dead fi ne-root morphology of different thinning intensities
在0~10 cm土层,活细根平均直径在对照和弱度抚育之间以及中度抚育和强度抚育之间无显著差异(P> 0.05),与对照相比,中度抚育和强度抚育细根平均直径分别增加了33.84%和69.68%;在10~20 cm土层,4个处理活细根和死细根平均直径并无显著差异。弱度抚育、中度抚育和强度抚育3个抚育处理水平细根根长密度之间存在显著差异(P<0.05),且均显著高于对照(P<0.05),与对照相比,分别增加了13.42%、115.17%和136.12%。在10~20 cm土层,中度抚育和强度抚育活细根根长密度显著高于对照和弱度抚育,但两者之间并无显著差异,与对照相比,分别增加了151.17%和136.12%。可以看出,随抚育强度的增加,细根平均直径的上升远没有根长那样明显,尤其是在10~20 cm土层,这说明在随着抚育强度的增加,细根根长在显著增加,吸收养分和水分的能力在快速提升,与此同时,生物质也在根系中积累,细根平均直径也在缓慢增加,但是增加的幅度远没有根长增加的幅度大,在直径生长方面并没有长度发育那么明显。
3.3 抚育对细根生物量和比根长的影响
细根生物量密度和比根长在不同抚育强度和土层之间的置换检验结果表明(见图4),不管是活细根还是死细根,2个指标在不同抚育强度之间呈现显著的差异(P<0.05),但是并不存在抚育强度和土层的交互作用,而死根比根长在土层厚度之间不存在显著差异(P<0.05)。

图4 不同抚育强度细根生物量密度和比根长的变化趋势Fig.4 Trends of fi ne-root biomass density and speci fi c root length of different thinning intensities
随着抚育强度的增加,0~10 cm 和10~20 cm土层活细根生物量密度和总细根生物量密度均在增加。 相比于对照,弱度抚育、中度抚育和强度抚育0~10 cm细根总生物量密度分别增加了41.47%、102.14%和136.72%,分别达到1.311、1.874和2.194 mg·cm-3;在土层10~20 cm,弱度抚育、中度抚育和强度抚育细根总生物量密度分别比对照增加了20.21%、57.43%和105.68%,分别达到 0.834、1.092 和 1.427 mg·cm-3。从细根生物量密度垂直分布特征来看,相同抚育强度0~10 cm土层活细根和死细根生物量密度均高于10~20 cm土层。对照、弱度抚育、中度抚育和强度抚育0~10层总细根生物量密度占0~20 cm土层所有细根生物量密度的比例分别达到57.19%、61.13%、63.17%和60.59%,呈现先增加后减小的趋势。可见,细根生物量主要集中在地表0~10 cm土层,且抚育对地表层(0~10 cm)细根生物量的影响要大于下层土壤(10~20 cm)。
活细根单位重量的根长(比根长)随着抚育强度的增加也在显著上升,但是死细根上升趋势并不明显。中度抚育和重度抚育总细根比根长显著高于对照和弱度抚育(P>0.05),两者之间差异并不显著(P<0.05),而对照和弱度抚育之间也不显著(P<0.05)。结合细根生物量密度和细根根长密度随抚育强度的变化特征来看,抚育强度的增加促进地表层细根发育,如生物量的增加和根长的增加,但是根长的增加速率要快于生物质的积累,因此比根长也在上升,但到了中度抚育和强度抚育,比根长维持在一个相对稳定的水平。
4 结论与讨论
森林抚育作为一个重要森林经营措施,能够降低林分密度,改变植物生长环境,对细根生长有显著的影响[24],森林抚育通过改变冠层和蒸腾作用,可能会改变地表层水分、温度等微环境,进而影响地表细根的生长发育。本研究发现,随着抚育强度的增加,同一土层栎类天然次生林地表0~20 cm土层活细根和死细根根长密度、细根表面积密度、细根平均直径和细根体积密度等根系形态结构特征参数值均有不同程度的增加,这与大部分的已有研究结果一致,如关于北美5个树种的细根研究[25]和抚育对侧柏人工林[26]和杉木人工林[17]地表层细根的影响研究。大量研究表明,细根具有较大的形态可塑性[27],随着抚育强度的增加,细根形态发生了变化,如细根平均直径增加,说明抚育促进了细根径向生长;抚育还促进了根长密度和细根表面积的增加,这可以提高细根获取水分和养分的效率[28]。本研究还发现,弱度抚育和对照之间的细根形态结构特征指标值差异往往不明显,细根形态结构指标值在中度或强度抚育处理下往往达到最大值,且显著高于对照和弱度抚育。但是,继续加大抚育强度是否会造成这个趋势继续存在,还需要设置更多的处理水平进行研究。本研究发现,中度抚育和强度抚育比根长已经趋于稳定,说明单位重量下的根长发育已经趋于稳定。
细根生物量往往会对森林抚育产生直接的响应,本研究发现,随着抚育强度的增加,0~20 cm土层活细根生物量密度和总细根生物量密度均在显著增加,相对于对照,强度抚育0~10 cm和10~20 cm土层细根总生物量密度分别增加了136.72%和105.68%,这与关于80%强度间伐3年后冬青栎Ilex purpurea林细根生物量增加超过100%[12]的研究结论基本一致,关于抚育对Curpressus lusitanica细根的影响研究[29]结果表明,抚育后细根生物量增加了63%。但是,关于间伐对侧柏人工林细根生物量的研究[15]却得到截然相反的结论,即强度间伐显著减少了林分细根生物量。本研究选取细根根长密度、细根表面积密度、细根平均直径、细根体积密度、细根生物量密度和比根长等细根特征参数,分不同土层厚度,对代表不同抚育强度的样地进行PCoA主坐标分析,结果表明,基于上述细根特征参数和Bray-Curtis距离矩阵的PCoA分析能很好的描述不同抚育强度细根发育特征之间的差异,可以在以后的研究中加以运用。
森林抚育对不同土层细根造成的影响存在着一定程度的差异,对硬阔叶林的研究[30]发现,0~20 cm土层细根占整个土层细根年生物量积累的绝大部分。因此,本研究关于抚育对细根发育的影响集中在0~20 cm土层。本研究表明,相比于10~20 cm土层,森林抚育对0~10 cm土层细根发育的影响更为强烈,如强度抚育条件下的0~10 cm土层细根生物量密度比对照增加了136.72%,而10~20 cm土层细根生物量密度比对照只增加了105.68%。而且,本研究还发现,在各土层细根形态结构特征指标呈现出随土层加深而递减的趋势,这与关于抚育对山毛榉林分细根影响的研究结果一致[31],但与关于抚育对日本落叶松细根的影响研究[32]相反。本研究发现,随着抚育强度增加,细根0~10 cm层细根生物量密度占0~20 cm总生物量密度的比例呈先增加后减小的趋势,这可能与弱度抚育和中度抚育疏开了林分,在春夏季节,地表温度上升,促进细根朝地表移动,但是强度抚育可能会造成地表水分含量快速下降,这并不利于细根生长[33],进而朝10~20 cm土层移动,这与抚育对锐齿栎林细根影响的研究结论一致。
森林抚育对细根生长是一个复杂过程[34],不仅与抚育强度、立地条件、林分类型、林分发育阶段,还与抚育持续时间、次数和调查季节等因素有关[35],本研究只开展了森林抚育对细根形态及其生物量的短期影响研究,且实验中无法将森林抚育造成的细根发育与诸多可能影响细根发育的因子完全区分开,这可能影响评价结果的可靠性。在以后的研究中,需要在特定地块开展连续多年的控制实验,同时开展对可能影响细根发育的植被和环境因子的观测,这样才可以更准确科学地评价森林抚育对细根生长的影响。
[1]Reynolds H L, Packey A, Bever J D,et al.Grassroots ecology:Plant-microbe-soil interactions as drivers of plant community structure and dynamics [J]. Ecology, 2003, 84(9): 2281-2291.
[2]贾全全,刘琪璟,梁 宇.三种常见针叶树种的细根形态比较[J].中南林业科技大学学报,2016,36(2):33-39.
[3]Jackson R B, Mooney H A, Schulze E D. A global budget for fi ne root biomass, surface area, and nutrient contents [J]. P. Natl Acad Sci USA, 1997, 94(14): 7362-7366.
[4]Nadelhoffer K J, Raich J W. fi ne root production estimates and belowground carbon allocation in forest ecosystems [J]. Ecology,1992, 73(4): 1139-1147.
[5]Joslin J D, Henderson G S. organic-matter and nutrients associated with fi ne root turnover in a white oak stand [J]. Forest Science, 1987, 33(2): 330-346.
[6]Li Y, Wang Y, Ma C,et al.Influence of the spatial layout of plant roots on slope stability [J]. Ecological Engineering, 2016,91:477-486.
[7]Lai Z, Zhang Y, Liu J,et al.Fine-root distribution, production,decomposition, and effect on soil organic carbon of three revegetation shrub species in northwest China [J]. Forest Ecology and Management, 2016, 359:381-388.
[8]Zhang Y F, Yu J, Sichilima A M,et al.Effects of thinning on scatter-hoarding by rodents in temperate forest [J]. Integrative Zoology, 2016, 11(3): 182-190.
[9]李 荣,何景峰,张文辉,等.近自然经营间伐对辽东栎林植物组成及林木更新的影响[J].西北农林科技大学学报(自然科学版), 2011, 39(7): 83-91.
[10]段 劼,马履一,贾黎明,等.抚育间伐对侧柏人工林及林下植被生长的影响[J].生态学报,2010,30(6):1431-1441.
[11]武朋辉,党坤良,常 伟,等.抚育间伐对秦岭南坡锐齿栎天然次生林碳密度的影响[J].西北农林科技大学学报(自然科学版), 2016, 44(10): 75-82.
[12]Lopez B C, Sabate S, Gracia C A. Thinning effects on carbon allocation to fine roots in aQuercus ilexforest [J]. Tree Physiology, 2003, 23(17): 1217-1124.
[13]Breda N, Granier A, Barataud F,et al. soil-water dynamics in an oak stand .I. soilmoisture, water potentials and water-uptake by roots [J]. Plant and Soil, 1995, 172(1): 17-27.
[14]Mattson K G, Smith h C. Detritalorganic-matter and soil CO2efflux in forests regenerating from cutting in west-virginia [J].Soil Biol. Biochem., 1993, 25(9): 1241-1248.
[15]陈信力,刁娇娇,闵建刚,等.间伐强度和次数对侧柏人工林细根形态及生物量的影响[J].西南林业大学学报,2013, 33(4):5-11,16.
[16]刘运科,范 川,李贤伟,等.间伐对川西亚高山粗枝云杉人工林细根生物量及碳储量的影响[J].植物生态学报,2012,36(7): 645-654.
[17]王祖华,李瑞霞,关庆伟.间伐对杉木不同根序细根形态、生物量和氮含量的影响[J].应用生态学报,2013,24(6):1487-1493.
[18]Lai Z R, Zhang Y Q, Wu B,et al. Fine root distribution and belowground interactions in an alley silvopasture system in northern China [J]. Turkish Journal of Agriculture and Forestry,2014, 38(5): 644-651.
[19]权 伟,徐 侠,王 丰,等.武夷山不同海拔高度植被细根生物量及形态特征[J].生态学杂志,2008,27(7):1095-1103.
[20]闫东锋,张 振,杨喜田.豫南山区典型林分地表层根系结构与土壤特性的关系[J].东北林业大学学报,2014(12): 30-36.
[21]梅 莉,王政权,韩有志,等.水曲柳根系生物量、比根长和根长密度的分布格局[J].应用生态学报,2006,17(1):1-4.
[22]RCORETEAM. R: A language and environment for statistical computing [M]. Vienna: Austria; R Foundation for Statistical Computing,2015.
[23]Oksanen A, Blanchet F, Kindt R,et al.Vegan: Community ecology package for R[R]. version 2.3-2, 2015.
[24]Štefančík I. The effect of different tending on stand structure and quantitative production of European beech (Fagus sylvaticaL.)stand in a selected region of East Slovakia [J]. Journal of Forest Science, 2016, 61(3): 98-105.
[25]Pregitzer K S, Deforest J L, BurtonA J,et al.Fine root architecture of nine North American trees [J]. Ecological Monographs, 2002, 72(2): 293-309.
[26]李瑞霞,彭婷婷,刘 娜,等.间伐对侧柏人工林碳储量以及细根生物量和形态的影响[J].东北林业大学学报,2013(5):34-38.
[27]Majdi H, Pregitzer K, Morén A-S,et al.Measuring Fine Root Turnover in Forest Ecosystems [J]. Plant and Soil, 2005, 276(1-2): 1-8.
[28]Zhang Y, Niu J, Yu X,et al.Effects of fi ne root length density and root biomass on soil preferential flow in forest ecosystems [J].Forest Systems, 2015, 24(1): 12.
[29]Asaye Z, Zewdie S. Fine root dynamics and soil carbon accretion under thinned and un-thinnedCupressus lusitanicastands in,Southern Ethiopia [J]. Plant and Soil, 2012, 283(1-2): 261-271.
[30]Hendrick R L, Pregitzer K S. Temporal and depth-related patterns of fi ne root dynamics in northern hardwood forests [J]. Journal of Ecology, 1996, 84(2): 167-176.
[31]Leuschner C, Hertel D, Schmid I,et al. Stand fi ne root biomass and fine root morphology in old-growth beech forests as a function of precipitation and soil fertility [J]. Plant and Soil,2004, 258(1-2): 43-56.
[32]Tian D L, Peng Y Y, Yan W D,et al.Effects of thinning and litter fall removal on fi ne root production and soil organic carbon content in masson pine plantations [J]. Pedosphere, 2010, 20(4):486-493.
[33]Ren L D, Huang M B. Fine root distributions and water consumption of alfalfa grown in layered soils with different layer thicknesses [J]. Soil Research, 2016, 54(6): 730-738.
[34]Hartmann P, von Wilpert K. Fine-root distributions of Central European forest soils and their interaction with site and soil properties [J]. Canadian Journal of Forest Research-Revue Canadienne De Recherche Forestiere, 2014, 44(1): 71-81.
[35]Jimenez M N, Navarro F B. Thinning effects on litterfall remaining after 8 years and improved stand resilience in Aleppo pine afforestation (SE Spain) [J]. Journal of Environmental Management, 2016, 169:174-183.

