青钱柳组织培养研究
张文泉,邓 洁,罗国涛,张 雕
( 凯里学院,贵州 凯里 556011)
青钱柳Cyclocarya paliurus( Batal) Iljinskaja为中国特有的珍稀濒危植物,属胡桃科Juglandaceae青钱柳属Cyclocarya[1],现有研究表明:青钱柳富含钾、钙、镁、锌、硒、等多种对人体有益的中、微量元素及三萜、甾体类化合物和黄酮等有机成分,全株均能入药,干制叶片为治疗II型糖尿病的天然良药,青钱柳的水提物还具有降血压、降血糖、降血脂的作用,其药用价值及保健功效显著,具有广阔的开发利用前景[2-5]。
青钱柳为落叶速生乔木,树木高大挺拔,枝叶美丽多姿,其果实从10月至次年5月挂在树上像一串串的铜钱迎风摇曳,别具一格,因此又名摇钱树,颇具观赏性,具有极高的庭院栽培价值,可作为园林绿化观赏树种。青钱柳木材轻软,细致,有光泽,纹理交错,结构略细,加工容易,胶粘性和油漆性能好,可作家具及工业上的优良用材;其树皮含鞣质及纤维,为橡胶及造纸原料,树皮含鞣质,可提制栲胶,亦可做纤维原料。
青钱柳的自然资源极其匮乏,种子具有深度休眠特性,自然条件下,次年或是多年后才能萌发,且发芽率最高仅在0.2%,扦插成活率最高仅45.6%[6-8],使得青钱柳的种苗匮乏,严重阻碍其开发利用。植物组织培养为高效可行的无性繁殖方式,具有繁殖系数高,周期短,且不受外界环境条件限制等优点,国内外虽然已有对青钱柳组织培养的研究,但外植体多采用种胚,外植体来源有限,操作难度较大,而且通过胚培养所建立的快繁体系难以保持母树的优良性状,或者由于愈伤分化率、生根率低等原因尚未建立青钱柳的完整组培体系[9-10]等。笔者利用青钱柳幼嫩叶片为外植体,探讨了基本培养基和生长调节物质对青钱柳愈伤组织及不定芽发生的影响,以期为青钱柳的工厂化育苗提供技术支持,从而解决青钱柳开发过程中资源匮乏问题。
1 材料与方法
1.1 材料来源与处理
试验材料为贵州省雷公山自然保护区内自然状况下生长的青钱柳当年生嫩叶(颜色为淡红色到嫩绿色)为外植体,首先用洗涤液擦拭表面后,流水冲洗6 h,于超净工作台上,75%酒精消毒30 s,无菌水洗3次; 0.1% 氯化汞消毒10 min,无菌水冲洗3~5次,无菌滤纸吸干,将叶片分割成约1.0 cm2的小方块,用手术刀在背面划4~5条划痕,接种于已预备的愈伤诱导培养基中,每瓶接种3个外植体,每处理3次重复。以嫩叶为外植体诱导所获得的愈伤组织为材料,接种于分化培养基上,进行愈伤组织不定芽分化试验。以诱导获得的不定芽为材料,接种于生根培养基上,进行根系诱导。
1.2 培养基及培养条件
诱导愈伤组织的培养基:以WPM,MS,B5为基本培养基,附加不同浓度2,4-D(1.0、2.0、3.0 mg/L),6-BA(0.5、1.0、1.5 mg/L)激素组合;愈伤组织分化培养基:以WPM基本培养基,附加不同浓度激素及外源物,进行正交试验,分析不同条件对青钱柳叶片诱导愈伤组织分化的影响,各因素水平见表1,以不添加任何激素及外源物质的WPM培养基为CK;生根培养基:1/2MS为基本培养基, 附加IBA(0.5、1.0、1.5、2.0 mg/L),以上所有培养基均附加3%蔗糖,6.0 g/L琼脂,pH值调至5.8~6.0,培养条件:愈伤组织诱导时采用暗培养,愈伤组织分化及生根诱导采用光照培养,光照强度为1 500~2 000 lx,光照时长为12 h/d,全程培养温度23~26 ℃。
培养过程中,定期观察生长情况,接种25 d后,统计不同培养基组合的愈伤组织诱导率。愈伤组织接种于分化培养基后,定期观察,并统计各处理的愈伤组织分化率。当愈伤组织分化的不定芽生长至1.5 cm接种于生根培养基后,每一处理接种20个不定芽,重复3次,定期观察根系诱导情况,统计不定根诱导率及生根数,测量根长。

表1 青钱柳叶片愈伤组织分化试验各因素水平Table 1 Levels of different factors in leaf segments tissue culture test of Cyclocarya paliurus
其中:愈伤组织诱导率=形成愈伤组织的外植体数/接种外植体数×100%;愈伤组织分化率=产生不定芽的愈伤组织数/接种的愈伤组织数×100%;不定根诱导率=产生不定根的芽数/接种芽总数×100 %。
本试验所得数据采用Excel 2010 及SPSS 19.0进行分析处理。
2 结果与分析
2.1 不同处理对青钱柳愈伤组织诱导的影响
采用WPM、MS、B5 3种基本培养基,附加不同浓度的外源激素(2,4-D,6-BA)组合,以青钱柳叶片为外植体,研究不同培养基及激素组合对青钱柳愈伤组织诱导的影响。培养过程中观察:8 d时,叶片切口及划痕处膨大,14 d时于膨大处开始产生愈伤组织,但不同处理条件下诱导得到的愈伤组织具有显著差异。笔者将其分为2种类型:I型(见图1):乳白色,如小米粒状,质地光滑、疏松,体积较大;II型(见图2):淡黄色、如水渍状,质地粗糙、致密,体积较小;统计愈伤组织诱导率并分析后(见表2)得出:相同培养基条件下,不同外源激素组合条件下青钱柳叶片愈伤组织诱导率均存在极显著差异(P<0.05),相同激素组合条件下,WPM培养基上青钱柳叶片的愈伤组织诱导率最高,愈伤组织诱导率为58.3%~97.6%,愈伤组织90%左右为I型,MS培养基上愈伤组织诱导率为54.2%~87.5%,愈伤组织50%左右为I型, B5培养基上愈伤组织诱导率为37.5%~66.7%,愈伤组织仅有10%左右为I型,由此可知青钱柳叶片诱导愈伤组织最佳的基本培养基为WPM培养基。

图1 青钱柳愈伤组织类型IFig.1 Callus types I of C.paliurus

图2 青钱柳愈伤组织类型IIFig.2 Callus types II of C.paliurus

表2 不同处理对青钱柳叶片愈伤组织诱导结果†Table 2 Result of different treatments on lamina callus induction of Cyclocarya paliurus
采用SPSS19.0进行方差分析及多重比较表明:相同培养基条件下,两类激素2,4-D,6-BA的浓度对青钱柳叶片愈伤组织诱导率均呈极显著差异,相同质量浓度的 6-BA水平下,愈伤组织诱导率随2,4-D 质量浓度的递增而呈抛物线状变化,2,4-D 为2.0 mg/L时,愈伤组织的诱导最高,当2,4-D增加至3.0 mg/L时,愈伤组织的诱导反而下降,相同质量浓度的2,4-D水平下,愈伤组织诱导率与6-BA质量浓度的变化关系与2,4-D一致,均表现为低浓度条件下的激素促进愈伤组织的诱导,高浓度的激素抑制愈伤组织的诱导,综上所述:青钱柳叶片愈伤组织诱导的最佳培养基组合为:WPM+2.0 mg/L 2,4-D+1.0 mg/L 6-BA,愈伤组织诱导率为97.6%。
2.2 不同处理对青钱柳愈伤组织分化的影响
将乳白色,如小米粒状,质地光滑、疏松的愈伤组织置于超净工作台无菌培养皿上,去除已老化的部分,取中部质地疏松的愈伤组织接种于分化培养基上,光照培养14~16 d,空白对照中的愈伤组织逐渐褐化,失去生活力,其他组合的愈伤组织表面的光泽度明显增加,17~20 d,愈伤组织表面逐渐出现球形突起(见图3),随着培养时间的延长,愈伤组织表面出现芽点并开始萌发,35~40 d形成不定芽(见图4)。45 d后统计愈伤组织分化率,得表3,所得数据采用SPSS19.0软件,采进行方差分析及多重比较,比较各因素对愈伤组织诱导率的效应(见表4)。

图3 分化的青钱柳愈伤组织Fig.3 Differentiated callus of C.paliurus

图4 分化出不定芽的青钱柳愈伤组织Fig.4 Adventitious buds differentiated from callus of C.paliurus
采用单变量多因素方差分析可知:6-BA、ZT、椰乳3个因素的伴随概率P分别为0.043,0.048,0.012, 均 小 于 0.05, 而 2,4-D 的P为0.053,由此可知,6-BA 、ZT、椰乳3因素对青钱柳叶片愈伤组织的分化率存在显著影响,2,4-D对青钱柳叶片愈伤组织的分化率无显著影响。其中ZT的影响最大,其次是6-BA,影响最小的是椰乳。

表3 不同处理组合对青钱柳叶片愈伤组织分化率的影响Table 3 Effects of different treatments on callus differentiation rate of Cyclocarya paliurus

表4 因素间效应检验Table 4 Tests of between-subjects effects
2.2.1 植物生长调节剂对青钱柳叶片愈伤组织分化的影响
在青钱柳叶片愈伤组织分化试验中,6-BA这一因素的设置3水平,水平1(1.0 mg/L)愈伤分化率的均值为54.11%,水平2(2.0 mg/L)愈伤分化率的均值为59.78%,水平3(3.0 mg/L)分化率的均值为55%,基于这些均值采用LSD进行成对比较,得表5。

表5 6-BA各水平成对比较Table 5 Pairwise comparisons of 6-BA concentrations
由表5可得出,6-BA水平1 与水平2,3 之间的愈伤组织分化率在p≤0.05水平上存在显著性差异,而水平2与水平3差异不显著,所以低浓度条件下,提高激素浓度,可明显提高青钱柳叶片愈伤组织的分化率,而高浓度的激素则抑制愈伤组织的分化。
在青钱柳叶片愈伤组织分化试验中,ZT这一因素的设置3水平,水平1(1.0 mg/L)愈伤分化率的均值为53.44%,水平2(1.5 mg/L)愈伤分化率的均值为54.89%,水平3(2.0 mg/L)愈伤分化率的均值为60.55%,基于这些均值采用LSD进行成对比较,得表6。

表6 ZT各水平成对比较Table 6 Pairwise comparisons of ZT concentrations
由表6可得出,ZT水平3与水平1,2 之间的愈伤组织分化率在0.05 水平上存在显著性差异,而水平2与水平1,3差异不显著,由此可知,青钱柳愈伤组织分化试验中,提高ZT的浓度能促进青钱柳叶片愈伤组织的分化。
生长素2,4-D在各因素中对青钱柳叶片愈伤组织分化率的影响不显著,则不对生长素2,4-D的各水平做成对比较, 2,4-D 各水平的愈伤组织分化率均值为:水平1(0.5 mg/L)愈伤组织诱导率为59.67%;水平2(1.0 mg/L)为54.67%;水平3(1.5 mg/L)为54.55%,体现出低浓度的激素促进愈伤分化的规律,由此可知:青钱柳叶片愈伤组织分化最佳的激素组合为1.0 mg/L 6-BA+2.0 mg/L ZT+ 0.5 mg/L 2,4-D。
2.2.2 外源物质对青钱柳叶片愈伤组织分化的影响
诸多研究表明:在培养基中加入外源物质如:椰乳,香蕉汁,水解蛋白等天然物质能促进愈伤组织的分化。在青钱柳叶片愈伤组织分化试验中,椰乳这一因素的设置3水平,水平1(10%)愈伤分化率的均值为59.67%,水平2(15%)愈伤分化率的均值为55.22%,水平3(20%)分化率的均值为54.11%,基于这些均值采用LSD进行成对比较,得表7。

表7 椰乳各水平成对比较Table 7 Pairwise comparisons of coconut milk concentrations
由表7可得出,椰乳水平1与水平2,3之间的愈伤组织分化率在0.05 水平上存在显著性差异,而水平2与水平3差异不显著,由此可知,青钱柳愈伤组织分化试验中,椰乳浓度的增加对青钱柳叶片愈伤组织的分化率不存在促进作用,因此采用较低浓度的椰乳。
2.3 不同激素浓度对青钱柳不定芽生根诱导的影响
选取生长情况一致的不定芽,在超净工作台截取不定芽(1.5 cm)接种于附加不同浓度IBA的1/2MS培养基上,诱导根系,25 d后观察,在不定芽的基部产生白色的不定根,随着培养时间的延长,根系颜色加深,逐步转化为深褐色(见图5),50d后统计生根率及根系生长情况得表8,由表8分析可知:低浓度条件下IBA能促进青钱柳根系的诱导,高浓度的IBA反而抑制根系的诱导,当IBA为1.5 mg/L,青钱柳不定芽根系诱导率为27%,平均根条数为4.12,平均根长为1.81 cm,生根效果优于其他激素浓度,试验结果表明:青钱柳不定芽生根诱导最适的培养基组合为1/2MS+1.5 mg/L IBA。
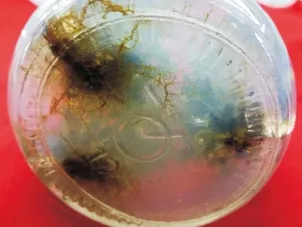
图5 根系诱导Fig.5 Roots induced

表8 不同IBA浓度对不定根诱导的影响Table 8 Adventitious root inductions in different IBA
3 结论与讨论
不少学者对青钱柳器官发生的直接发生方式进行了研究,如:张志敏、吴群英、胡冬南等[11-13]均采用青钱柳茎段对其不定芽的诱导进行了研究,发现外植体的取材时间,位置均影响显著,最适时间为春季取材,5月份是最佳的取样时期,顶芽下1、2节的幼嫩茎段分化效果较好;尚旭岚[14]等对青钱柳离体胚进行快速繁殖研究,结果表明:采用离体胚为外植体进行组织培养时,污染率低、成苗数高,为获得青钱柳无菌小植株的有效途径,但青钱柳种子空壳率较高,外有坚硬的种壳,外植体来源缺乏。而关于从幼胚、叶片或茎段为外植体采用间接发生方式对青钱柳组培进行研究,大部分仅获得愈伤组织[15-17]。
本试验采用青钱柳的幼嫩叶片为外植体诱导得到愈伤组织,愈伤组织再分化出不定芽,不定芽根系诱导获得完整植株的方式建立青钱柳的植株再生体系。实验结果表明,叶片在切口处先脱分化诱导得到愈伤组织形成愈伤组织,愈伤组织再分化形成不定芽,在此过程中,植物生长调节剂起到至关重要的作用,最常用的植物生长调节剂为2,4-D与6-BA组合,常用于叶片、茎段、子叶、胚等不同类型外植体愈伤组织的诱导及生长,但浓度过高则会抑制愈伤组织的生长,易导致玻璃化。愈伤组织诱导过程中,添加较高浓度的生长素和较低浓度的细胞分裂素可以提高愈伤组织的诱导率及愈伤组织的质量,大量实验研究结果表明:浓度比为2:1~10:1之间则能诱导得到愈伤组织,如莫竹承等[18]对膝柄木叶片组织培养时采用1.0 mg/L 2,4-D+0.5 mg/L 6-BA组合,愈伤诱导率高为70%;张彦妮[19]等对‘普瑞头’百合的组培过程中采用2.5 mg/L 2,4-D+0.5 mg/L 6-BA愈伤诱导率为85%;丁植磊[20]等对油茶 12 个物种花药愈伤组织诱导过程中采用2,4-D与6-BA组合,愈伤诱导率均达到100%,本试验中对青钱柳叶片为外植体进行愈伤组织诱导2.0 mg/L 2,4-D +1.0 mg/L 6-BA 诱导率最高的结果与以上研究结果一致。
愈伤组织的分化过程中,则需要较高浓度的细胞分裂素和较低浓度的生长素,这与其他木本植物离体培养在植物生长调节物质使用的原则上是相同的,不仅取决于生长调节物质的种类及其绝对量,还取决于它们之间的相对比例,但离体培养成功是否成功,尤其是再分化阶段,外源物质的存在也起到了一定的作用,诸多研究报道:在培养基中加入外源物质如:椰乳,香蕉汁,水解蛋白等等,能促进愈伤组织的分化[21,22],本实验中添加椰乳能促进青钱柳愈伤组织的分化,这与前期研究也是相符的。但青钱柳的离体培养也有不同之处,尤其是愈伤组织分化过程中,由本实验结果可知:6-BA、ZT两种分裂素均能对青钱柳叶片愈伤组织的分化起到促进作用,影响显著,ZT较6-BA作用更明显,而2,4-D对青钱柳叶片愈伤组织的分化率无显著影响。但同为胡桃科核桃属的诸多核桃品种在离体胚培养时,添6-BA反而抑制芽苗的增殖[23-25]。在青钱柳愈伤组织诱导过程中,采用WPM、MS、B5 3种不同的培养基进行筛选,WPM、MS、B5 3种培养基均能够诱导得到愈伤组织,但培养基的种类对愈伤组织的诱导率及愈伤组织的质量存在显著影响,在植物组织培养中,MS为应用最广泛的基本培养基,但对诸多针叶树种的组织培养中不适应[26],究其原因可能是由于MS培养基中的盐含量过高及NH4+和NO3
-含量过高所致。本试验得出:以青钱柳幼嫩叶片为外植体诱导愈伤时,最适的培养基组合为WPM+2.0 mg/L 2,4-D+1.0 mg/L 6-BA,愈伤组织分化WPM+1.0 mg/L 6-BA+2.0 mg/L ZT+0.5 mg/L 2,4-D +10%椰乳的组合处理效果最优。青钱柳愈伤组织分化出不定芽与愈伤组织的状态有密切联系,只有适宜的的愈伤组织才能诱导出不定芽,在本试验中,只有小米粒状,质地光滑、疏松的愈伤组织能分化出不定芽,而水渍状的愈伤组织褐化严重,不能进一步分化。在生根诱导阶段,青钱柳根系诱导采用1/2MS培养基,降低MS培养基中大量元素的量,低盐条件下更有利于根系的生长。
综上所述,青钱柳愈伤组织分化的频率还不是很高,分化率最高只能达到60%左右,不定芽发生和发育不能同步进行。诱导形成的不定芽,成苗还存在一定的困难,不定芽虽然诱导得到不定根,形成完整植株,但生根率仅为20%左右,而且侧根较少,难以形成完整的根系,如果大量应用于生产中会受到限制。这也是本试验的局限所在。在青钱柳的愈伤组织分化实验中是否还能有其他的激素组合,或是添加其他外源物质能更进一步的促进青钱柳愈伤组织的分化?有研究表明生根诱导培养基中加入活性炭等物质形成黑暗条件有利于根系形成,在青钱柳根系诱导过程中采用此方法更有利于生根?后续的实验及研究过程还需对愈伤组织分化、不定芽生根机理和调控的方法进行探索,打破愈伤组织分化难、组培苗难以生根的瓶颈,建立更加有效的青钱柳组培快繁体系。
[1]张文泉,邓 洁.青钱柳叶片诱导愈伤组织研究[J].内蒙古农业大学学报,2016,37(2):28-33.
[2]Xie M Y, Lei L, Nie S P,et al.Determination of speciation of elements related to blood sugar in bioactive extracts fromCyclocarya paliurusleaves by FIA-ICP-MS [J]. European Food Research & Technology, 2006, 223(2):202-209.
[3]Xie J H, Xie M Y, Nie S P,et al. Isolation, chemical composition and antioxidant activities of a water-soluble polysaccharide fromCyclocarya paliurus(Batal.) Iljinskaja [J]. Food Chemistry,2010, 119(4):1626-1632.
[4]Zhang J, Qiang S, Lu J C,et al. Phenolic compounds from the leaves ofCyclocarya paliurus(Batal.) Ijinskaja and their inhibitory activity against PTP1B [J]. Food Chemistry, 2010,119(4): 1491-1496.
[5]洑香香,方升佐.青钱柳次生代谢产物及其生理功能[J].安徽农业科学,2009,37(28):13612-13614.
[6]李海玲,方升佐.青钱柳繁殖技术研究进展[J].林业工程学报, 2009,19(6):3-5.
[7]杨万霞,方升佐.青钱柳种子综合处理过程中内源激素的动态变化[J].南京林业大学学报,2008,32(5):85-88.
[8]雷土荣,方水强,钟建军,等.青钱柳综合利用及播种育苗造林技术[J].安徽农学通报,2010,16(8):94,101.
[9]谢明勇,谢建华.青钱柳研究进展[J].食品与生物技术学报,2008, 27(1): 113-121.
[10]乔卿梅,王 鹏,程茂高.青钱柳的研究现状[J].河南林业科技,2006,26(1):24-25,28.
[11]张志敏,尚旭岚,王 纪,等.消毒方法和培养基对青钱柳茎段腋芽萌发的影响[J].林业科技开发,2010,24(3):87-90.
[12]吴群英,徐 庆,李丽亚,等.青钱柳不同外植体组织培养及褐变防止的研究[J].时珍国医国药,2008,19(8):1872-1874.
[13]胡冬南,上官新晨,刘亮英,等.青钱柳茎段离体培养研究[J].湖北农业科学,2009,8(6):1300-1303.
[14]尚旭岚,徐锡增,方升佐.青钱柳离体胚的培养及快速繁殖[J].南京林业大学学报(自然科学版),2007,31(1):101-105.
[15]乔卿梅,程茂高,王新民.青钱柳离体胚的组织培养研究[J].广东农业科学,2009(7):69-71.
[16]乔卿梅,程茂高,魏志华,等.不同外源激素对青钱柳茎段组织培养的影响[J].北方园艺,2009(7):125-127.
[17]盛丽莉,史文亚,张志敏,等.青钱柳组织培养技术研究进展[J].西南林业大学学报,2011,31(2):84-88.
[18]莫竹承,庞万伟,刘 珏,等.膝柄木叶片诱导愈伤组织研究[J].中南林业科技大学学报,2015,35(10):13-17.
[19]张彦妮,李文英.百合属‘普瑞头’的组织培养和快速繁殖[J].草业科学,2012,29(7):1077-1083.
[20]丁植磊,张日清,刘友全,等.油茶12个物种花药愈伤组织诱导及继代培养[J].经济林研究,2007,25(1):20-24.
[21]辛亚龙,唐军荣,杨宇明,等.牛樟组织培养技术研究[J].中南林业科技大学学报,2017,37(8):48-53.
[22]吴高殷,田有亮,何炎红,等.山杏组织培养和优化体系的建立[J].经济林研究, 2017,35(2):151-156.
[23]张建成,吴国良,屈红征,等.培养基及培养条件对核桃试管芽苗继代增殖的影响[J].山西农业大学学报,2005,25(1):45-48.
[24]杨 宏,陈文静,杨 标,等.长山核桃茎段组织培养初步研究[J].经济林研究, 2017,35(2):220-224.
[25]曹 凡,冯 刚,谭鹏鹏,等.不同品种薄壳山核桃种胚组织培养研究[J].中南林业科技大学学报,2017,37(8):18-23.
[26]张文泉,闫 伟.樟子松组织培养初步研究[J].干旱区资源与环境,2013,27(6):107-111.

