不同时代因素、地域因素及经济条件对中国母乳脂肪酸构成的影响研究
文/刘翠平 闫永恒 范炜宇 宝 黎 邱 斌 杜方玲 陈 亮 徐同成*
﹝1山东省农业科学院农产品研究所/山东省农产品精深加工技术重点实验室;2阿胡斯卡尔斯油脂(上海)有限公司;3江南大学食品学院﹞
一直以来,母乳被认为是婴儿成长最自然、最安全、最理想的食品,是婴幼儿营养的最佳来源。母乳作为婴幼儿配方食品的重要参考标准,一直是国内外研究热点。国外对母乳影响因素的研究趋于完备,而国内对于中国人群母乳营养素的研究却呈现研究较为分散,样本量偏小,代表性不强的特点。脂类是母乳重要的组成成分,脂肪酸提供婴儿所需能量的45%~55%,一方面部分脂肪酸是婴儿脑部及神经组织的构成成分,在婴儿视力与智力发育中不可或缺;另一方面,部分脂肪酸(如肉豆蔻酸、月桂酸及反式脂肪酸)过量将会为婴幼儿健康带来风险。因此,探寻母乳脂肪酸组成和含量,以此作为配方粉添加量的重要依据,对开发模拟中国母乳脂类的配方产品及抢占婴幼儿配方粉市场尤为重要。
随着中国经济快速发展以及人民生活水平提高,生活习惯随之改变。本文以讨论母乳脂肪酸组成是否受到膳食的影响,进而是否受到沿海内陆地域因素、南北方地域因素以及经济条件的影响为基础,采用现代统计学方法,对现有研究的数据进行收集和再分析,得到可用数据17 篇文献[1~17],并进行进一步研究,以期探明中国人群母乳中脂肪酸组成受各因素影响变化情况。
1 研究对象
1.1 检索策略的确定
确定检索中、英文数据库和关键词,搜集相关文献,并通过“标题”“摘要”和“全文”三个步骤的筛选,最终确定纳入文献。并将已搜索到文献中的参考文献进行二次检索。
1.2 纳入时间
母乳成分受多种因素影响,如基因、胎龄、膳食、泌乳时间、母乳营养贮存及状况等。我国近三十年迅猛发展的社会经济影响了孕妇、乳母的营养状况,进而影响母乳成分,为减少因此带来的混杂因素,故纳入时间为1990年后的相关研究数据。
1.3 纳入及排除标准
纳入标准:母乳来自健康、分娩足月儿及正常体重儿的乳母,中国地区母乳重要成分的分析检测,发表于1990年及以后的核心期刊,单城市样本数超过10 例,抽样设计与检测方法合理。
排除标准:母乳来自非健康、分娩早产儿、低出生体重儿及巨大儿的乳母,非原始研究文献,非中国母乳成分研究文献,非人乳文献,样本量少于10 例,非母乳脂肪酸成分的分析检测,同一作者重复发表文献。
1.4 纳入文献的数据提取
全面提取论文相关信息,包括实验人群的年龄、地域、哺乳时间等基本信息,以及脂肪酸等脂类组成信息。对于多终点结果、单位不同等问题,依据统计学方法,提出解决方案。
2 研究方法
2.1 统计情况
2.1.1 统计方法的选择
本课题选择多因素方差分析,不仅考虑多个控制变量独立作用,还可分析控制变量的交互作用以及随机变量的作用。
2.1.2 固定因子的纳入标准
多数研究者认为不同膳食会影响泌乳期间母乳脂肪酸组成与含量,本研究选择影响膳食原料、烹饪模式、摄食习惯迥异的4 个主要因素进行探讨,累积研究数据,为相关研究提供补充,为后续配方设计提供参考。
Time表示时代因素,膳食习惯受时间跨度影响较深,过去20 年我国经济提升飞速,从碳水化合物为主的饮食习惯变为碳水化合物、蛋白质和脂肪这三大营养素较为均衡,后因生活水平的提升脂类和蛋白质摄入量远超过去。Location A(LA)表示南北方地域因素,烹饪方式受南北方差异影响较深,南方膳食精致且较为清淡,常用蒸、煮、煲汤等烹饪方式,北方膳食粗犷较为浓烈,常用煎、炒、烤等烹饪方式。Location B(LB)表示沿海内陆地域因素,膳食原料受地域因素影响较深,内陆地区膳食脂肪主要来源于肉类与食用油等,沿海地区膳食脂肪来源于鱼虾类,贝类比例则明显高于内陆。Location C(LC)表示城市发达程度因素,城市发达水平与经济水平紧密挂钩,其脂肪摄入程度受此影响。
2.1.3 其它因子的筛除
原固定因子年龄(Age),因原始数据中大部分以范围形式存在(如25~40 岁),无法取得可信的均值数值,故作去除处理。原固定因子体质量比(BMI)作为评判乳母身体健康程度的指标,在原始数据中被大面积忽略,可能是由于原始文献筛选时就以健康程度进行了初步筛选,默认所有进入成分分析阶段的母乳均来自健康乳母,故作去除处理。
2.1.4 统计方法
将不同研究按照泌乳阶段(Colostrum Milk初乳,Mature Milk熟乳)分类汇总,将脂肪酸按不饱和程度(SFA饱和脂肪酸,MUFA单不饱和脂肪酸,PUFA多不饱和脂肪酸)分类汇总。采用SPSS 22.0统计学软件进行统计学分析,探明中国人群母乳整体脂类组成。
每项研究中汇总的母乳成分含量以均值(Mean)表示,分析归纳的母乳成分含量以均值±标准差(Mean±SD)表示。
将母乳重要成分的平均含量结合样本量加权,按照数值大小依次排列,采用四分位数法Q2(Q1,Q3)对汇总的母乳重要成分平均含量进行描述。其中,Q1为全部数据中第25%位置数值,Q2为第50%位置数值,Q3为第75%位置数值。
2.2 分析情况
2.2.1 计量单位的统一
大部分数据来源(如Rebecca Yuhas等[10])采用weight%形式,小部分数据来源如MingYan Xiang等[12]采取g/100 g形式,Yongmei Peng等[1]采取mol%形式,部分数据来源使用g/mL形式。根据100 mL母乳质量为104 g统一各研究单位,最终统一计量单位为weight%。
2.2.2 空白数据的补充
由于数据来源文献的研究目的各不相同,数据测定存在部分倾斜,如饱和脂肪酸成分分析较少,不饱和脂肪酸成分分析细致的问题,本着全面、细致、严谨的原则将提及的脂肪酸主要成分进行统计,部分空白数据以均值填充,保障了分析结果的可靠。
2.2.3 偏离数据的留舍
系统对偏离较大的数据进行再三确定及处理,例如某研究长春市母乳脂肪酸文献,由于多不饱和脂肪酸数据偏离较大,饱和脂肪酸数据量严重不全予以删除;对于Yongmei Peng等的研究结果存在部分脂肪酸数据偏大的问题(如C16∶0),经查验讨论,因其代表地方特色,样本量合理,分析统计方式有效,不予筛除。
2.2.4 其它
亚麻酸分为两个家族——ω3系列的α-亚麻酸及ω6系列的γ-亚麻酸;世界卫生组织和联合国粮食及农业组织推荐专项补充α-亚麻酸及其代谢物。故而本研究以添加调整ω3 C18∶3(α-亚麻酸)为主,特殊脂肪酸显著分析所提及的亚麻酸皆为α-亚麻酸。
3 研究结果
3.1 纳入文献情况
在PubMed中以“Chinese mothers”“Breast milk”“Fatty acid composition”为关键字,并通过标题、摘要和全文三个步骤的初步筛选,匹配所有结果共76 篇。随后以“母乳营养素”“母乳脂肪酸组成”结合三数据库联合检索(CNKI检索、万方数据检索、维普信息检索),再次筛选出地区包含中国、1992年以后的临床试验数据,各种语言发表的相关文献39 篇,最后经合理严格的排除标准(详见2.2.3),确定项目可用数据17 篇(表1)。
3.2 数据整理情况
17 篇源文献中,包含城市数量各有不同,共提取出35 个独立研究数据。
3.2.1 基础数据的提取
基础数据的提取包括数据来源、发表年限、样本城市、地理因素(LA、LB)以及经济水平(LC)。
3.2.2 脂肪酸数据的提取
提取计算饱和脂肪酸(SFA)、单不饱和脂肪酸(MUFA)、多不饱和脂肪酸(PUFA)的含量。
4 结论
4.1 南北方地域因素对母乳脂肪酸占比结构变化的影响
北方与南方地域因素对母乳脂肪酸占比结构变化的影响如图1所示。
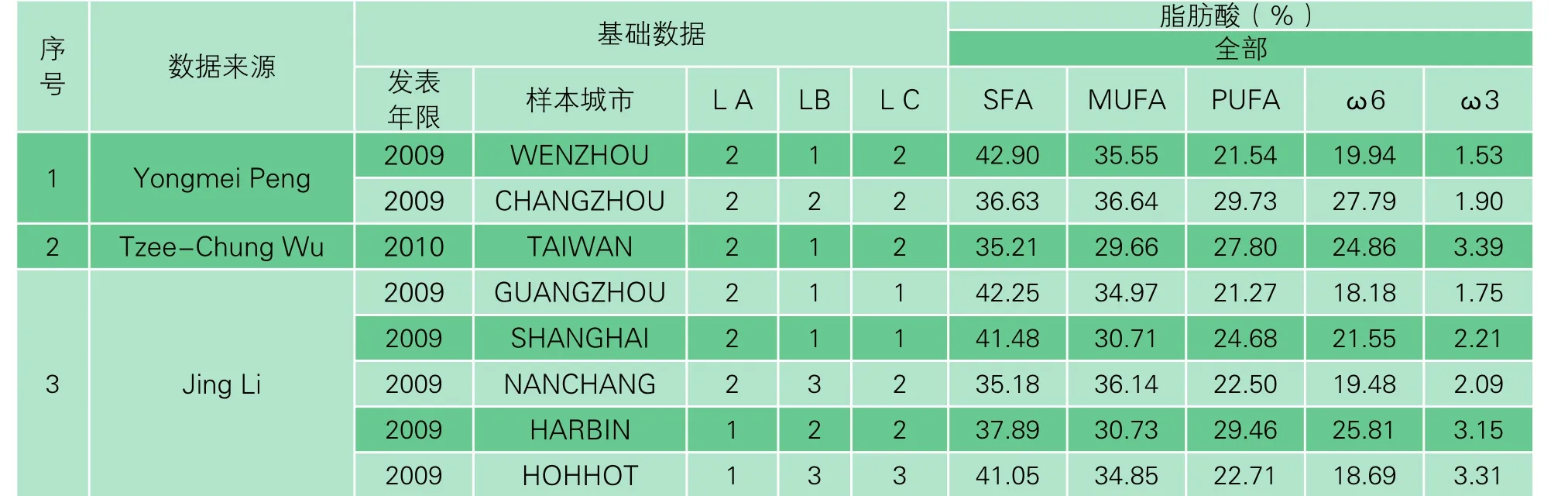
表1 数据统计一览
当以南北方地域因素作固定因子分析时,共5 组数据出现显著差异。北方地区部分饱和脂肪酸(C12∶0月桂酸,C14∶0肉豆蔻酸,C20∶0花生酸,C22∶0山嵛酸,C24∶0木焦油酸)显著高于南方地区(P<0.05),推测可能是由于北方食肉更多,且烹调方式多为煎烤也带来了肉质内脂肪酸的改变。而南北方母乳不饱和脂肪酸含量没有显著差异(P>0.05)。
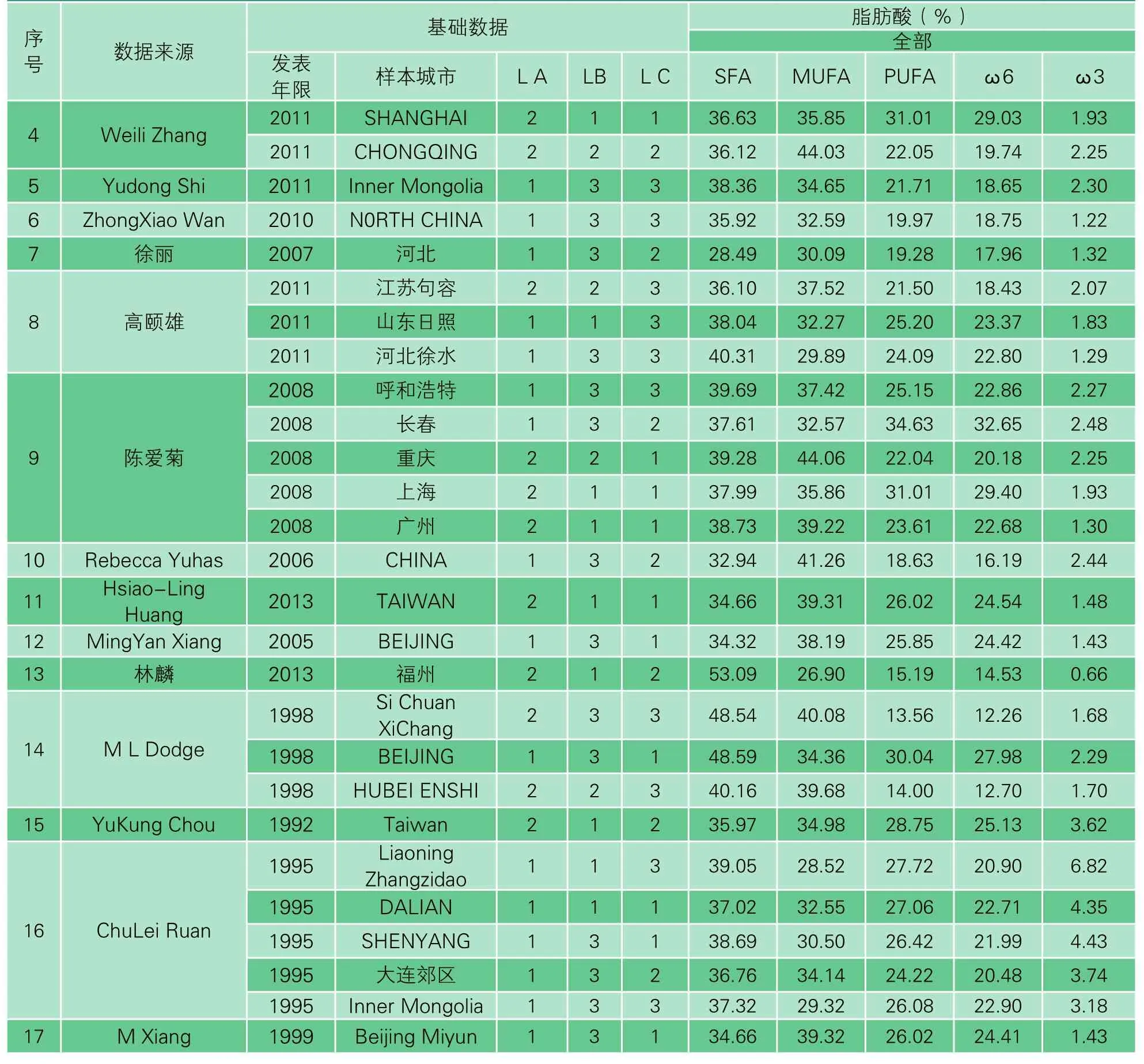
表1 数据统计一览(续上表)
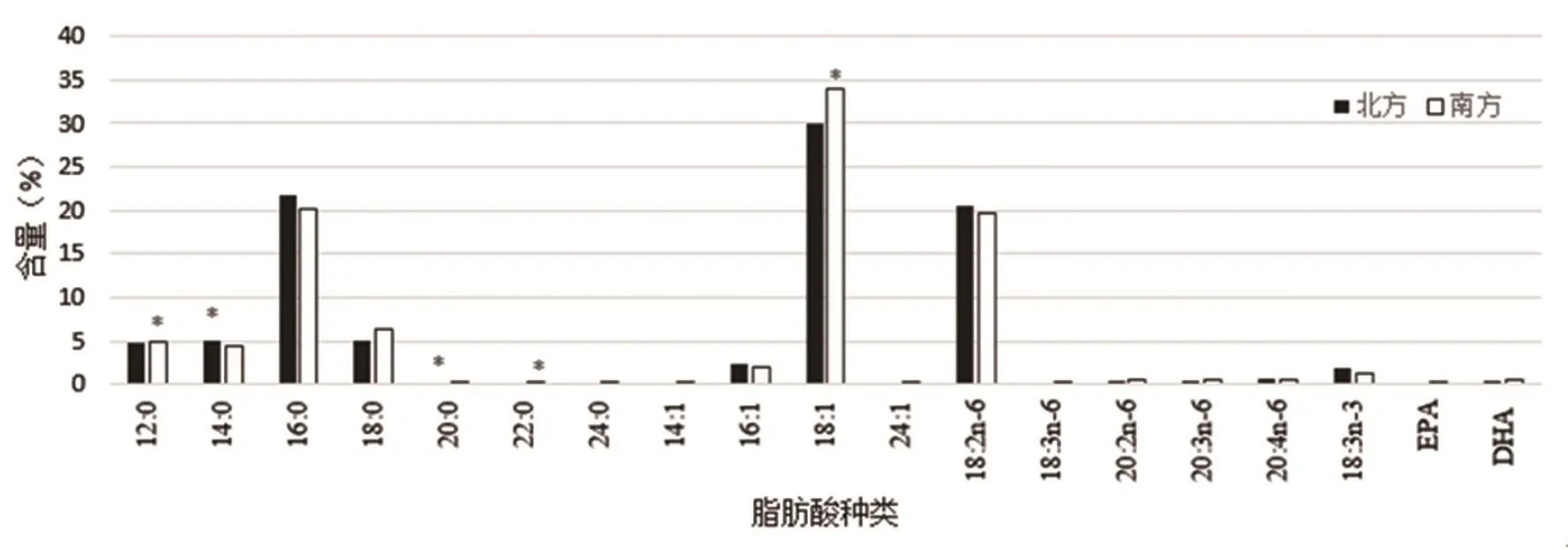
图1 南北方母乳中19 种主要脂肪酸含量
4.2 沿海内陆地域因素对母乳脂肪酸占比结构变化的影响
不同地域因素下母乳19 种主要脂肪酸含量如图2所示。当以LB(沿海,沿河、湖,内陆)作固定因子分析时,共7 组数据出现显著差异。说明受沿海内陆地域因素的影响,汇总数据显示差异情况较大。值得注意的是沿海地区母乳内单不饱和脂肪酸(C16∶1棕榈一烯酸,C18∶1油酸)含量低于沿河及内陆地区,部分多不饱和脂肪酸(C20∶4花生四烯酸,C20∶5 EPA,C22∶6 DHA)含量明显高于内陆地区(P<0.05),推测可能是由于沿海人群多食用海洋制品,膳食中脂肪以富含DHA的贝类鱼类来源更多而导致的。

图2 不同地域因素下母乳中19 种主要脂肪酸含量
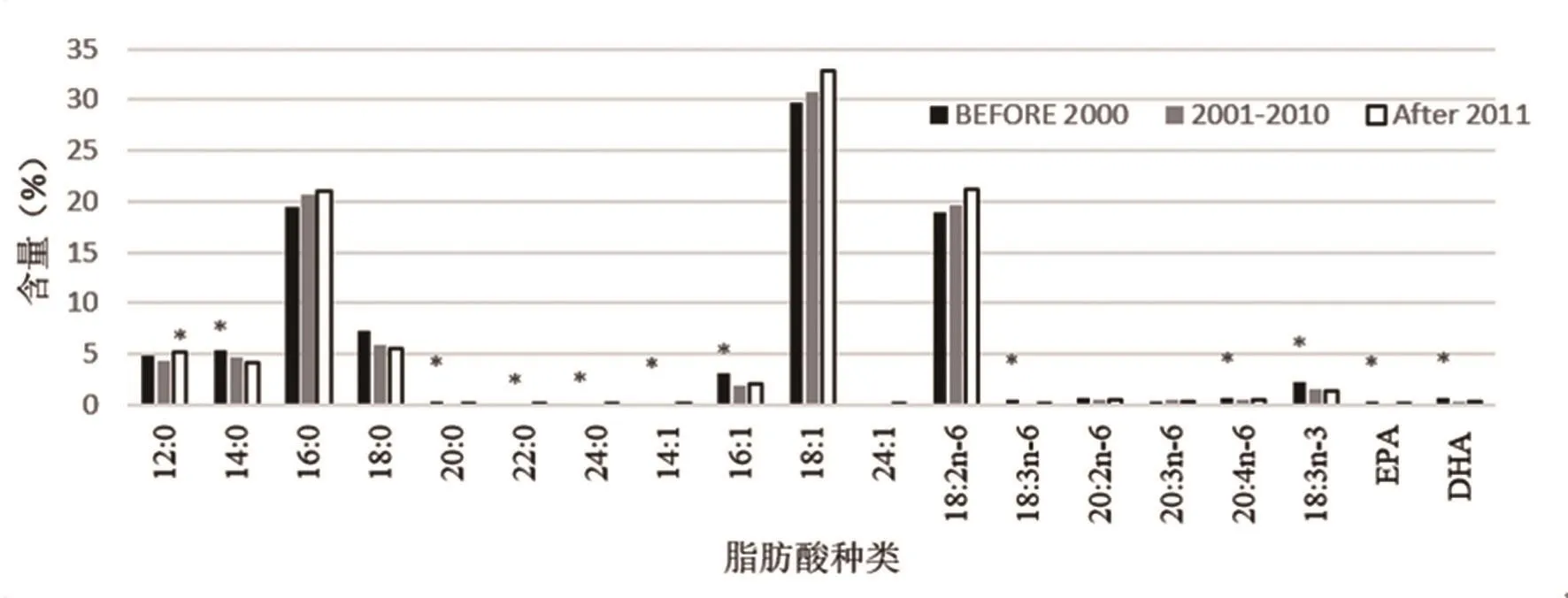
图3 不同时代母乳中19 种主要脂肪酸含量
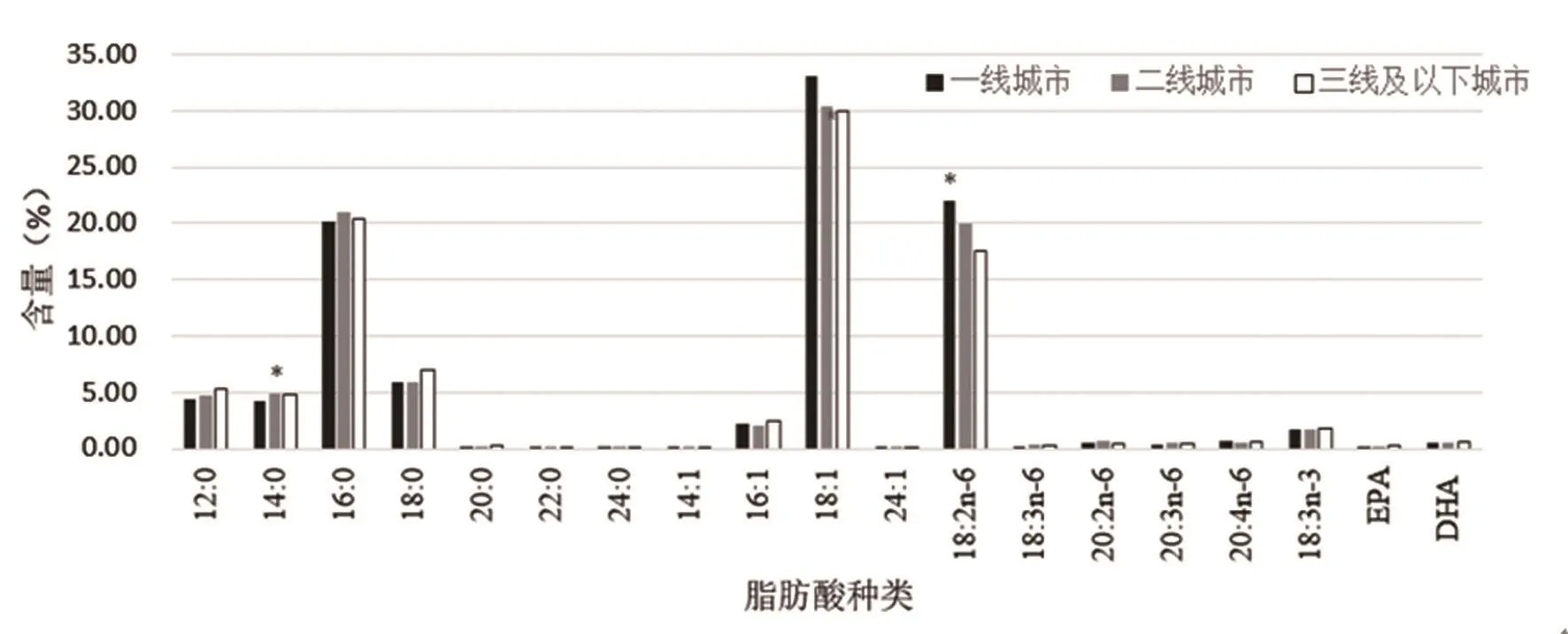
图4 不同经济条件下母乳中19 种主要脂肪酸含量
4.3 时代因素对母乳脂肪酸占比结构变化的影响
不同时代母乳中19 种主要脂肪酸含量如图3所示。当以Time作固定因子分析时,共12 组数据出现显著差异,说明中国人群母乳脂肪酸构成受时代因素影响较大。熟乳中饱和脂肪酸SPA含量随时间推移逐渐降低(P<0.05),单不饱和脂肪酸MUFA含量逐渐升高,说明我国国民油脂摄入结构趋于合理,从摄入饱和脂肪酸较多的动物油脂改变为食用单不饱和脂肪酸含量较高的植物油脂(如橄榄油等)。值得注意的是,多不饱和脂肪酸(如EPA和DHA)成分含量呈下降趋势,可能是由于中国人饮食中多不饱和脂肪酸的摄入量跟不上其它脂肪酸摄入量的上升速度。
4.4 经济水平对母乳脂肪酸占比结构变化的影响
不同经济条件下母乳中19 种主要脂肪酸含量如图4所示。当以经济水平作固定因子分析时,共2 组数据出现显著差异。说明受经济条件因素影响,母乳脂肪酸组成仅显示有个别差异,经济条件影响的膳食质量在后期对母乳熟乳脂肪酸成分影响不大。其中熟乳中一线城市相对其它两类城市母乳中饱和脂肪酸SFA含量降低,单不饱和脂肪酸MUFA含量增加,多不饱和脂肪酸PUFA含量增加(P>0.05),说明一线城市拥有更合理的母乳脂肪酸结构。
4.5 特殊脂肪酸双因素对比情况
在母乳脂肪酸结构中,饱和脂肪酸是重要的供能成分,部分特殊脂肪酸拥有不可忽视的生理功能,细分饱和脂肪酸种类,并且进行不同因素的相互比较是非常必要的。
4.5.1 部分饱和脂肪酸变化状况
C12∶0月桂酸含量不同因素对比如图5所示。月桂酸及衍生酯的抑菌作用可能不仅源于其对病毒被膜的破坏性,也与信号干扰病毒生长增殖有关[18],月桂酸还能起到防龋齿及蚀斑作用[19]。对比4 个因素月桂酸变化状况时,发现C12∶0月桂酸总体含量为5%左右,各个因素对月桂酸的影响不是很大,较为突出的是二线城市C12∶0含量随时间推移而显著升高。
C16∶0(棕榈酸)有利于增加能量和钙的吸收[20~21],改善婴幼儿大便稠度,并促进肠道菌群生长及骨骼的生长发育[22~23],减少哭闹[24]。图6可知,C16∶0棕榈酸含量随时间推移呈上升趋势。推测导致脂肪酸含量变化的可能原因是2000年后通过煎炸及调和油食用的棕榈油量大大上升,而棕榈油中C16∶0比例远高于豆油与花生油等传统油脂。C18∶0(硬脂酸)总体含量为5.96%,其中在2000年前的三线城市含量最高。由于硬脂酸多存在于动物油脂中,因此推断其含量变化特征与20 年前农村食用油脂多为猪油吻合。
4.5.2 部分单不饱和脂肪酸变化情况
单不饱和脂肪酸是指含有一个双键的脂肪酸,其种类和来源的丰富性慢慢被证实。母乳中重要的单不饱和脂肪酸成分是C18∶1(油酸),占单不饱和脂肪酸的90%左右,油酸已被证明可以降低心脑血管风险。图7显示一线城市单不饱和脂肪酸摄入量呈升高趋势,这可能与油酸含量较高的橄榄油或高油酸花生油摄入普及有关。
4.5.3 部分多不饱和脂肪酸变化情况
多不饱和脂肪酸是指含有2 个或2 个以上不饱和双键结构的脂肪酸,亚油酸及α-亚麻酸的比例对婴儿视力发育、智力发育至关重要,α-亚麻酸可以促进婴儿视力发育[25~26],增强智力,预防过敏性反应[27~28]。由图8中可见,北方亚麻酸的总体含量明显高于南方,可能是亚麻籽油多食用于北方地区而导致。另外北方地区亚麻酸含量随时间推移而降低,推测可能是亚麻籽油逐步被大豆油等其它食用油所替代。
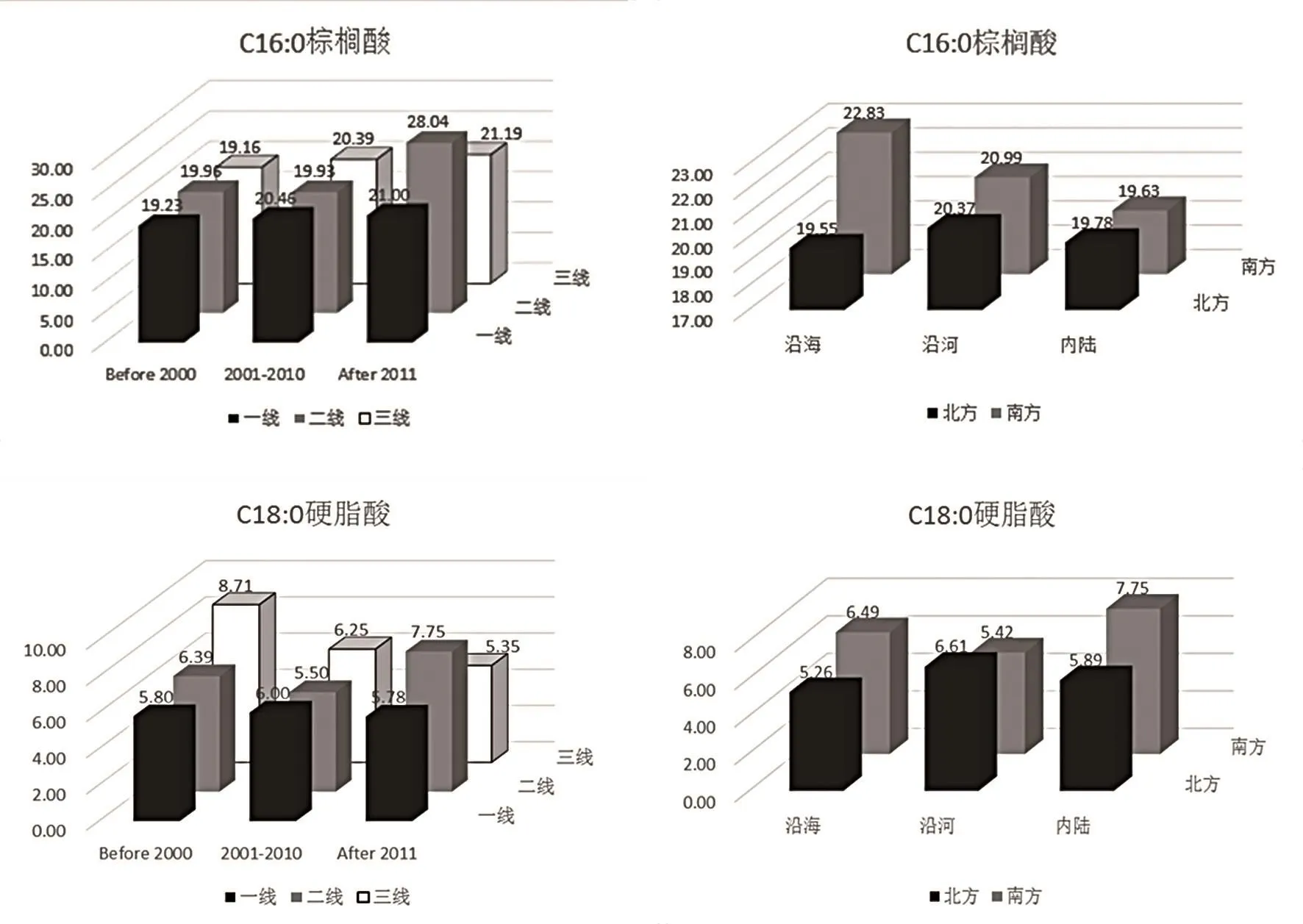
图6 C16∶0棕榈酸、C18∶0硬脂酸含量不同因素对比
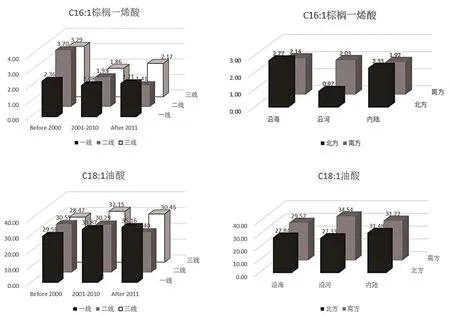
图7 C16∶1棕榈一烯酸、C18∶1油酸含量不同因素对比
EPA与DHA联动作用有益于改善婴儿早期神经和视觉功能发育[29~31],也可能有益于婴儿免疫功能和睡眠模式等[32~35]。图9显示沿海地区DHA含量明显更高,但随着时间的推移呈现先降低后升高的趋势。可能由于2000年后,随着经济开放,大豆油和其它植物油的推广使得摄入量显著增加,导致DHA占比下降,而2010年后,随着国民营养意识的重回,一线城市带头更加注重对于DHA的补充。
图5 C12∶0月桂酸含量不同因素对比
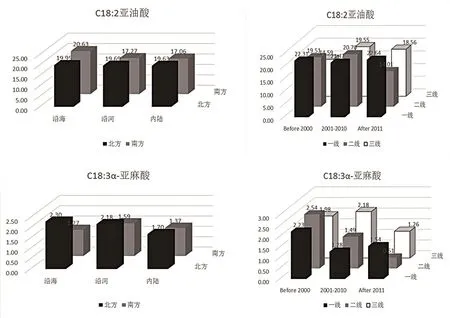
图8 C18∶2亚油酸、C18∶3亚麻酸含量不同因素对比
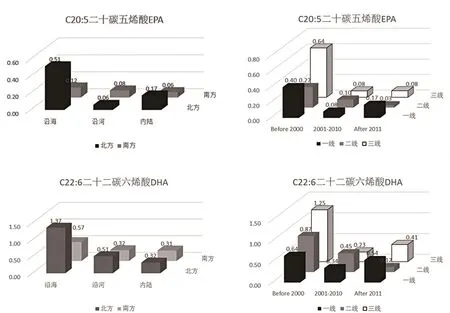
图9 C20∶5 EPA、C22∶6 DHA含量不同因素对比
5 小结
首先,本文统计文献时间跨度较长(1992~2011年),地区跨度较广(包含北京、温州、常州、广州、上海等26 个地区/城市),样本数量较大(总样本数1 279 例),经汇总分析后,可全面、深入地认识中国母乳脂类成分,成为中国母乳中脂类成分含量分析的基础和配方奶粉脂肪酸组成设计的参考依据。其次,在统计过程中,发现母乳成分研究采用了不同的检测方式、操作过程以及计量方式,为进一步汇总分析带来困难,亟需平衡统一母乳脂肪酸成分检测的流程。最后,在双因素两两对比中,原本平衡的数据被重新组合,本文发现重新组合后对于2000年以前的二线城市、北方沿河地域以及2010年后的二线城市母乳脂肪酸研究样本较少,时间无法倒退,但对于部分地域研究较少的问题应该引起后续研究者们的重视并作为重点方向。总而言之,中国幅员辽阔,为了尊重每一个地区的母乳成分差异,更正确地认识影响母乳成分的因素,中国人群母乳成分的研究还需要进一步扩大。
[1] Peng Y M,Zhou T T,Wang Q,et al.Fatty acid composition of diet,cord blood and breast milk in Chinese mothers with different dietary habits[J]. Prostaglandins Leukotrienes & Essential Fatty Acids,2009,81(5–6):325-330.
[2] Wu T C,Lau B H,Chen P H,et al. Fatty acid composition of Taiwanese human milk[J]. Journal of the Chinese Medical Association,2010,73(11):581-588.
[3] Li J,Fan Y,Zhang Z,et al. Evaluating the trans fatty acid,CLA,PUFA and erucic acid diversity in human milk from five regions in China[J]. Lipids,2009,44(3):257-271.
[4] Zhang W L,Chen A J,Jiang M H,et al.Fatty acid composition of human breast milk in Shanghai and Chongqing of China[J].Journal of Clinical Pediatrics,2011,29(3):201-207.
[5] Shi Y D,Sun G Q,Zhang Z G,et al.The chemical composition of human milk from Inner Mongolia of China[J]. Food Chemistry,2011,127(3):1193-1198.
[6] Wan Z X,Wang X L,Xu L,et al. Lipid content and fatty acids composition of mature human milk in rural North China[J].British Journal of Nutrition,2010,103(6):913-916.
[7] 徐丽,杜彦山,马健,等. 河北省某地区母乳氨基酸与脂肪酸含量调查[J]. 食品科技,2008,33(4):231-233.
[8] 高颐雄,张坚,王春荣,等. 中国三地区人成熟母乳脂肪酸含量的研究[J]. 卫生研究,2011,40(6):731-734.
[9] 陈爱菊,张伟利,蒋明华,等. 上海地区人乳中脂肪酸成分的研究[J]. 临床儿科杂志,2012,30(1):37-42.
[10] Yuhas R,Pramuk K,Lien E L. Human k fatty acid composition from nine countries varies most in DHA[J]. Lipids,2006,41(9):851-858.
[11] Huang H L,Chuang L T,Li H H, et al.Docosahexaenoic acid in maternal and neonatal plasma phospholipids and milk lipids of Taiwanese women in Kinmen:fatty acid composition of maternal blood,neonatal blood and breast milk[J]. Lipids in Health and Disease,2013,12(1):27.
[12] Xiang M ,Harbige L S,ZetterstrÖm R.Long-chain polyunsaturated fatty acids in Chinese and Swedish mothers:Diet,breast milk and infant growth[J]. Acta Paediatrica,2005,94(11):1543-1549.
[13] 林麒. 母乳反式脂肪酸分析及乳母膳食结构相关性研究:[硕士论文][D]. 福建:福建医科大学,2013.
[14] Dodge M L,Wander R C,Xia Y,et al.Glutathione peroxidase activity modulates fatty acid profiles of plasma and breast milk in Chinese women[J]. Journal of Trace Elements in Medicine & Biology,1999,12(4):221-230.
[15] Chou Y K,Wu T C,Chang S C,et al.Composition of long chain polyunsaturated fatty acids in breast milk[J]. Journal of Medical Sciences,1993,13(5):301-308.
[16] Ruan C,Liu X,Man H,et al. Milk composition in women from five different regions of China: the great diversity of milk fatty acids[J]. Journal of Nutrition,1995,125(12):2993-2998.
[17] Xiang M,Lei S,Li T,et al. Composition of long chain polyunsaturated fatty acids in human milk and growth of young infants in rural areas of northern China[J]. Acta Paediatrica,1999,88(2):126-131.
[18] Dawson P,Carl G D,Acton J C,et al.Effect of lauric acid and nidin-impregnated soy-based films on the growth of Listeria monocytogenes on turky bologna[J].Poultry Science,2002,81(5):721-726.
[19] Schuster G S, Dirksen T R, Ciarlone A E,et al. Anticaries and antiplaque potential of free-fatty acids in vitro and in vivo[J]. Pharmacology & Therapeutics in Dentistry,1980,5(1-2):25-33
[20] Litmanovitz I,Davidson K,Eliakim A,et al. High beta-palmitate formula and bone strength in term infants:a randomized,double-blind,controlled trial[J]. Calcified Tissue International,2013,92(1):35-41.
[21] Litmanovitz I,Bar-Yoseph F,Lifshitz Y,et al. Reduced crying in term infants fed high beta-palmitate formula:a doubleblind randomized clinical trial[J]. BMC Pediatrics,2014,14(1):1-6.
[22] Bar-Yoseph F,Lifshitz Y,Cohen T.Review of sn-2 palmitate oil implications for infant health[J]. Prostaglandins Leukotrienes & Essential Fatty Acids,2013,89(4):139-143.
[23] Yaron S,Shachar D,Abramas L,et al. Effect of high β-palmitate content in infant formula on the intestinal microbiota of term infants[J]. Journal of Pediatric Gastroenterology & Nutrition,2013,56(4):376-381.
[24] Lu P,Bar-Yoseph F,Levi L,et al. High beta-palmitate fat controls the intestinal inflammatory response and limits intestinal damage in mucin muc2 deficient mice[J].Plos One,2013,8(6):e65878.
[25] Udell T,Gibson R A,Makrides M,et al.The effect of α-linolenic acid and linoleic acid on the growth and development of formula-fed infants:A systematic review and meta-analysis of randomized controlled trials[J]. Lipids,2005,40(1):1.
[26] Sangiovanni J P,Berkey C S,Dwyer J T,et al. Dietary essential fatty acids,long-chain polyunsaturated fatty acids,and visual resolution acuity in healthy fullterm infants: a systematic review[J].Early Human Development,2000,57(3):165-188.
[27] Listed N. Human energy requirements:report of a joint FAO/ WHO/UNU Expert Consultation[J]. Food & Nutrition Bulletin,2005,26(1):166.
[28] Koletzko B,Baker S,Cleghorn G,et al.Global standard for the composition of infant formula: recommendations of an ESPGHAN coordinated international expert group[J]. Journal of Pediatric Gastroenterology & Nutrition,2005,41(5):584.
[29] Hibbeln J R,Davis J M,Steer C,et al.Maternal seafood consumption in pregnancy and neurodevelopmental outcomes in childhood(ALSPAC study): an observational cohort study[J]. Lancet,2007,369(9561):578-585.
[30] Qawasmi A,Landerosweisenberger A,Leckman J F,et al. Meta-analysis of long-chain polyunsaturated fatty acid supplementation of formula and infant cognition[J]. Pediatrics,2012,129(6):1141.
[31] Colombo J,Carlson S E,Cheatham C L,et al. Long-term effects of LCPUFA supplementation on childhood cognitive outcomes[J]. American Journal of Clinical Nutrition,2013,98(2):403-412.
[32] Judge M P,Harel O,Lammi-Keefe C J.A docosahexaenoic acid-functional food during pregnancy benefits infant visual acuity at four but not six months of age[J].Lipids,2007,42(2):117-122.
[33] Hoffman D R,Birch E E,Birch D G,et al. Impact of early dietary intake and blood lipid composition of long-chain polyunsaturated fatty acids on later visual development[J]. Journal of Pediatric Gastroenterology & Nutrition,2000,31(5):540-553.
[34] Koletzko B,Sauerwald T,Demmelmair H,et al. Dietary long-chain polyunsaturated fatty acid supplementation in infants with phenylketonuria:a randomized controlled trial[J]. Journal of Inherited Metabolic Disease,2007,30(3):326-332.
[35] Anderson J W,Johnstone B M,Remley D T. Breast-feeding and cognitive development: a meta-analysis[J]. American Journal of Clinical Nutrition,1999,70(4):525-535.

