奶牛围产期日粮补充复合B族维生素对改善酮病发生与提高产奶量的研究
文/刘汉根 刘文忠 吴 疆 孟 杰
(1 上海炫烨饲料有限公司;2 北京博利煌科技有限公司;3 加拿大JEFO营养公司)
奶牛除一般的营养需求外,B族维生素可能是长期被忽略的营养素。奶牛临床较少发现B族维生素的缺乏症,使奶牛业者与反刍学者对B族维生素的关注较少。过去普遍认为奶牛需要的B族维生素可由日粮提供[1~3]和瘤胃微生物自行合成[4,5]来满足基本需求。B族维生素进入瘤胃,大部分会被瘤胃微生物降解掉[胆碱(Choline)99%,核黄素(B2)97%~99%,叶酸(B9)97%,VB12(63%~90%)],导致仅有极少量顺利通过瘤胃成功被小肠吸收利用[6~9]。利用脂质包被的过瘤胃保护B族维生素,能有效避免奶牛所需的营养成分直接在瘤胃被降解。越来越多研究显示高产奶牛在围产期或泌乳期日粮补充B族维生素,可有效提高干物质采食量、免疫力、产奶量[叶酸[10,11]、 生物素(VB8)[12,13]、硫胺素(VB1)[14]]、繁殖效率[15]、饲料利用率[15,16],改善肢蹄健康[17],降低代谢疾病发生率与淘汰率[18,19]。这些研究显示高产奶牛实际需要的B族维生素可能远大于由日粮与瘤胃微生物合成所能提供的[10,20~22]。日粮补充B族维生素被认为是改善奶牛健康与提高产能的有效方法之一。
围产期干物质采食量对奶牛生产性能和健康情况至关重要。奶牛干奶期干物质采食量占体重的2%,围产前期逐渐下降,产犊前7~10 天降至1.4%,分娩时降至最低,随后慢慢回升,约至12 周前达高峰[23~25]。Brown等研究指出奶牛的干物质采食量和产奶量呈正相关[26]。B族维生素(叶酸、生物素、VB12)在奶牛的能量代谢过程, DNA和甲基化循环中扮演重要辅酶角色[27]。Evans等[18]研究显示奶牛产前日粮每日补充B族维生素(50~100 g/牛·天),干物质采食量逐渐提高,2 周后可达最高水平,若将补充的B族维生素从日粮中移除,则奶牛干物质采食量随之下降,约2 周后降至最低水平[18]。这些证实奶牛干物质采食量直接受B族维生素影响。
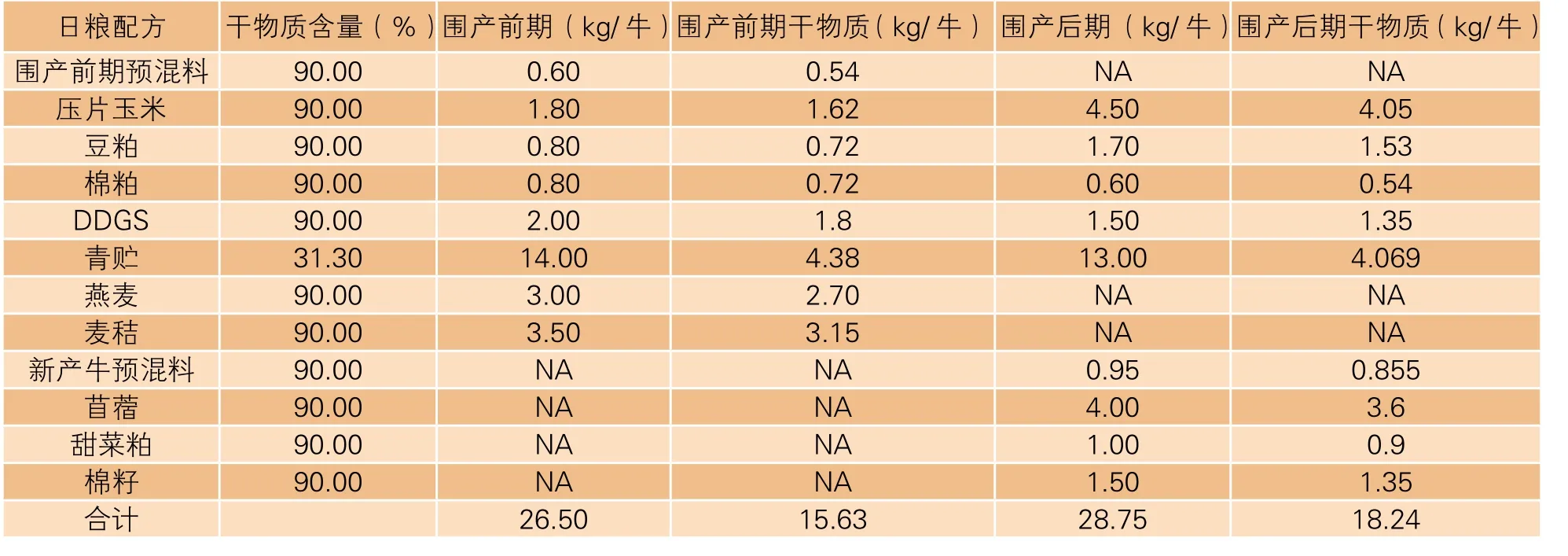
表1 奶牛围产期[前期(产前21 天)和后期(产后14 天)]TMR日粮配方表
奶牛围产期至关重要,高产奶牛产后易引发能量营养代谢失调与产后疾病,造成牛场经济损失。本试验主要检测高产奶牛在围产期日粮补充过瘤胃保护复合B族维生素对干物质采食量、酮病发生率、 产奶量和淘汰率的影响,并提供奶牛场未来预防与改善围产期牛只健康与生产表现的重要参考依据。
1 材料与方法
1.1 试验材料与仪器
1.1.1 试验材料
维产康(过瘤胃保护复合B族维生素):加拿大JEFO公司技术生产(Transition VBTM,Jefo Nutrition Inc, St.Hyacinthe,QC,Canada)。过瘤胃保护复合B族维生素主要包含胆碱(Choline)、核黄素(B2)、叶酸(B9)、 VB12[18],其过瘤胃率80%,小肠释放率85%。Jefo嵌入式微胶囊脂质包被保护技术,有效防止牛只咀嚼和反刍所造成的机械与物理性破坏,并避免牛只所需的大部分过瘤胃保护复合B族维生素于瘤胃中被降解[18,19,28]。
1.1.2 围产期日粮配方
奶牛围产期全混合日粮(TMR)组成包括围产前期预混料、压片玉米、豆粕、棉粕、新产牛预混料、DDGS、青贮、燕麦草、麦秸草、新产牛预混料、苜蓿、甜菜粕、棉籽(表1)。围产牛TMR日粮每日全饲2 次,于饲喂前移除前一次的剩料并计算牛只干物质采食量。奶牛干物质根据日粮配方与干物质比例估算,并由日粮配方和每日牛只实际采食量计算。
1.1.3 试验仪器
携带型ABBOTT血酮检测仪与血酮试纸(Free Style Precision Neo,Abbott Diabetes Care,Abingdon,UK)用于快速检测奶牛酮体[β-羟基丁酸(beta hydroxybutyric acid,BHBA)]值[28]。携带型ABBOTT血酮检测仪可检测的血酮浓度范围为0~8.0 mmol/L,检测精确度的变异系数小于3.8%。利拉伐(Delaval)挤奶系统(型号MPC580/680)用于收集与监测记录产奶量(1 天3 次挤奶)。
1.2 试验设计
1.2.1 试验奶牛
江苏一商业奶牛场,产前21 天的荷斯坦经产奶牛(3~5 胎)随机分为对照组(n=71)和过瘤胃保护复合B族维生素组(n=31)。对照组(未补充过瘤胃保护复合B族维生素)奶牛每日全饲饲喂标准TMR日粮2 次(表1)。过瘤胃保护复合B族维生素组奶牛从产前21 天开始,每头牛每天日粮补充过瘤胃保护复合B族维生素100 g (均匀混入TMR日粮),直至产后14 天。
1.2.2 试验步骤
怀孕奶牛产犊前21 天被转移至围产前期牛圈舍,临产前转移至产房,产犊后转移入围产后期(新产)牛圈舍,以应用不同日粮组合配方(表1)。在产后8~14 天,对照组与过瘤胃保护复合B族维生素组牛只于TMR日粮饲喂后2~4 h进行尾静脉采血,取1 滴血液(>1.5 μL)至ABBOTT携带型血酮仪的试纸检测BHBA值。亚临床酮病的判断标准为,BHBA浓度在1.2~2.0 mmol/L。而临床酮病的标准为BHBA浓度大于2.0 mmol/L[28,29]。围产前期奶牛干物质采食量根据日粮配方与牛只实际采食量计算。泌乳量每日记录至试验结束(产后210 天)。产犊后至泌乳高峰(70 DIM)和试验结束(210 DIM)计算奶牛淘汰率。

表2 对照组与过瘤胃保护复合B族维生素组经产牛(3~5 胎)产后(8~14 天)酮病(临床与亚临床)发生率比较
1.3 数据处理
牛只干物质采食量、 产奶量和淘汰天数使用Sigma Plot 12.5 的One-Way ANOVA进行统计分析。当P<0.05时,数值(Mean±SEM)为差异显著。
2 试验结果
2.1 过瘤胃保护复合B族维生素提高奶牛围产前期干物质采食量
本试验因牛棚的圈舍场地限制,无法检测单独个别牛只干物质采食量,只能通过总量监测整个牛群的采食情况并计算奶牛干物质采食量。奶牛围产前期与后期的圈舍每天牛数浮动,牛只有转进也有转出,因此围产前期牛舍的所有奶牛处于产犊前后的不同日期。围产前期干物质采食量是以同一牛圈舍全群牛只实际采食量的平均值计算。
围产前期(产前)牛只,对照组和过瘤胃保护复合B族维生素组的干物质采食量分别为(10.45±0.57)和(12.36±0.43)kg/牛·天(P<0.01,图1)。在围产前期,过瘤胃保护复合B族维生素组牛只干物质采食量较对照组提高18.28%。
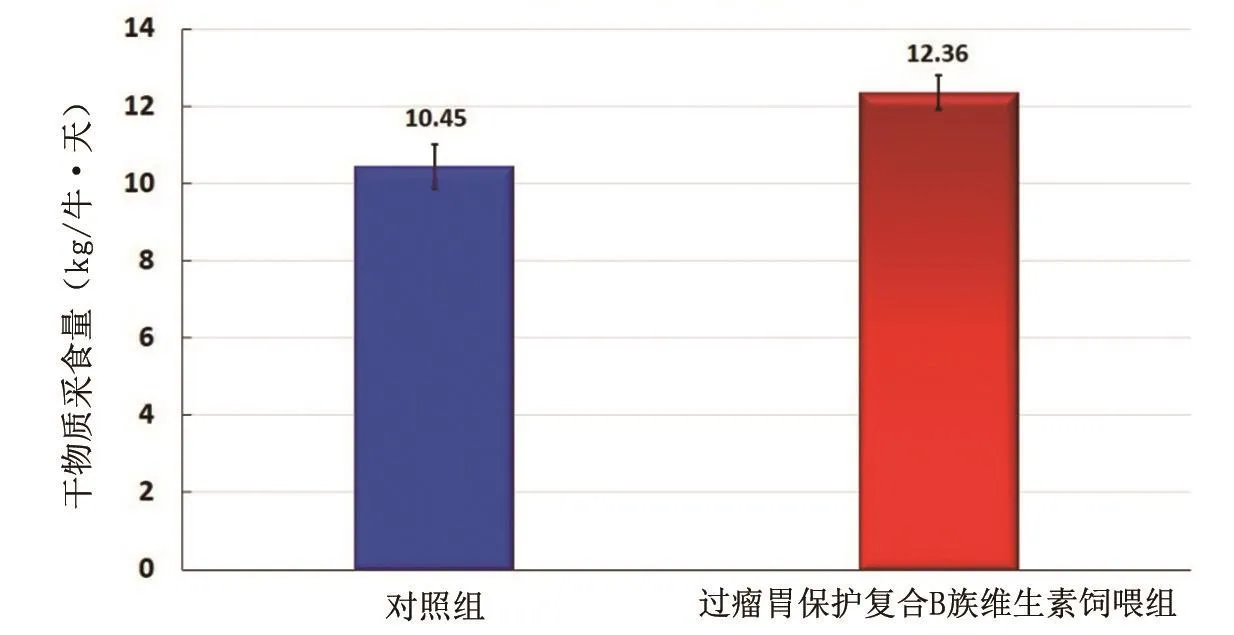
图1 对照组与过瘤胃保护复合B族维生素组在围产前期(产前21 天)干物质采食量
2.2 过瘤胃保护复合B族维生素降低奶牛酮病发生率
对照组与过瘤胃保护复合B族维生素组牛只,酮病发生率分别为32.39%和16.13%(表2)。对照组(n=71)有12 头临床酮病(>2.0 mmol/L)牛(发病率16.90%)与11 头亚临床酮病(1.2 mmol/L≤BHBA≤2.0 mmol/L)牛(发病率15.49%)。过瘤胃保护复合B族维生素组(n=31),有2 头临床酮病(发病率6.45%)与3 头亚临床酮病牛(发病率9.68%)。牛只围产期补充过瘤胃保护复合B族维生素组较对照组的酮病发生率降低50.20%(表2)。
个别牛只血酮浓度分别显示于图2。每一圆点表示个别牛只血酮值。酮病的发生计入临床和亚临床酮症。
3 过瘤胃保护复合B族维生素提高奶牛产奶量
在产后70 天(泌乳高峰),过瘤胃保护复合B族维生素组奶牛平均每天产奶量(43.31±1.79) kg,显著高于对照组[(38.67±1.95) kg /牛·天](P<0.001)。过瘤胃保护复合B族维生素组牛只平均产奶量的泌乳曲线在产后至203 天均较对照组的产奶量高,产后奶量增加的趋势在产后210 天结束(图3)。过瘤胃保护复合B族维生素组较对照组产后210 天平均产奶量提高8.96%[分别为(40.38±0.88)和(37.06±0.77) kg /牛·天,P<0.01] 。过瘤胃保护复合B族维生素组奶牛在210 天的总奶量较对照组提高697 kg/牛。
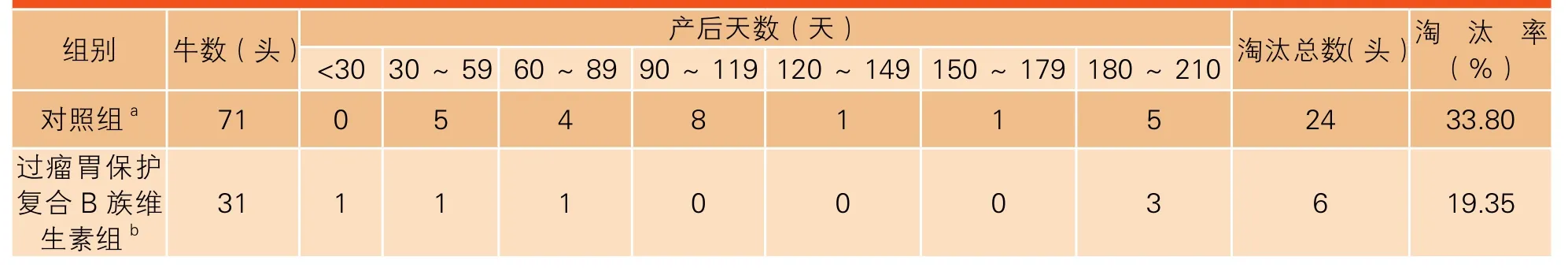
表3 对照组和过瘤胃保护复合B族维生素组高产奶牛产后210 天主动和被动淘汰率比较
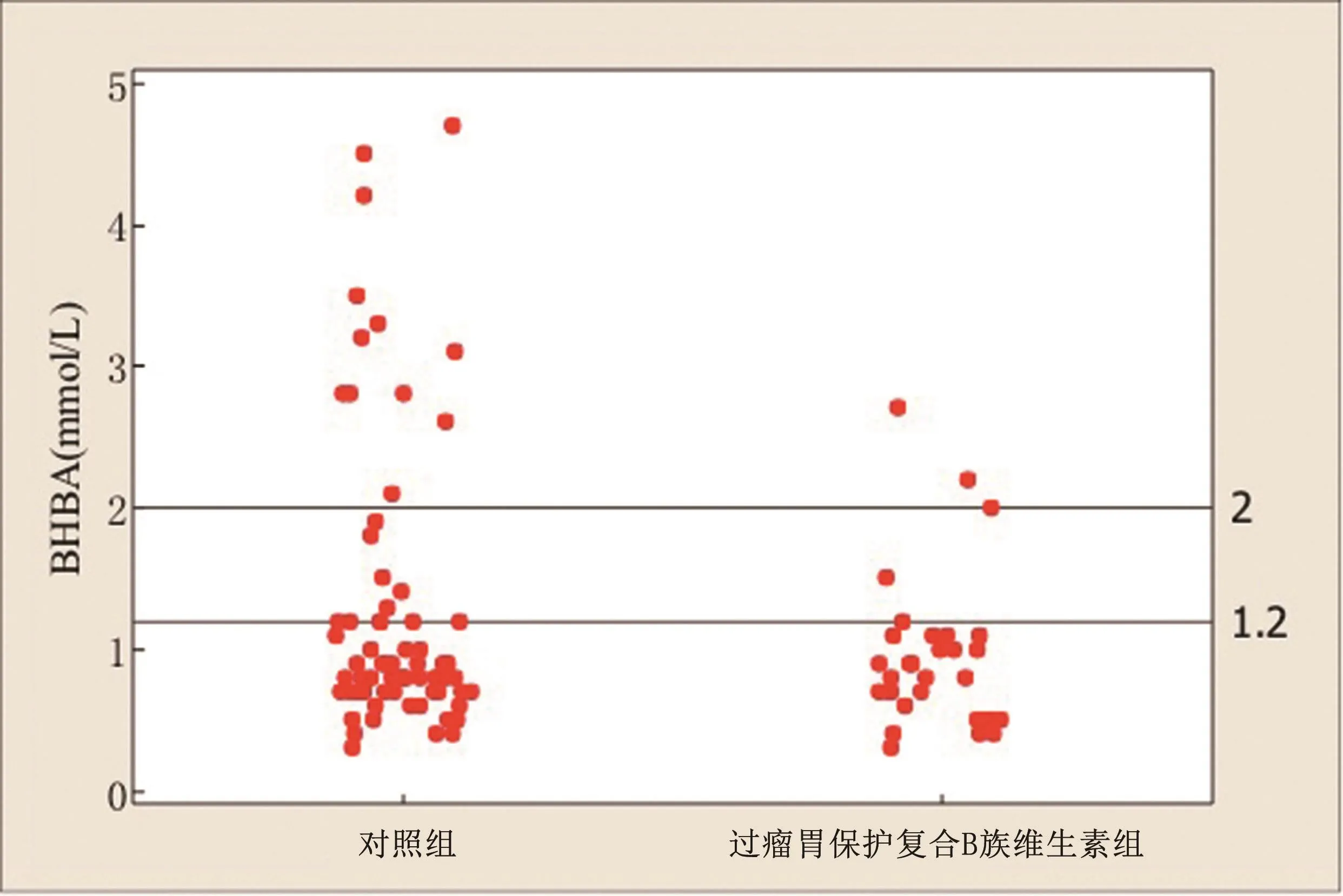
图2 对照组(n=71)与过瘤胃保护复合B族维生素组(n=31)经产(3~5 胎)奶牛产后个别牛只血酮值散点图
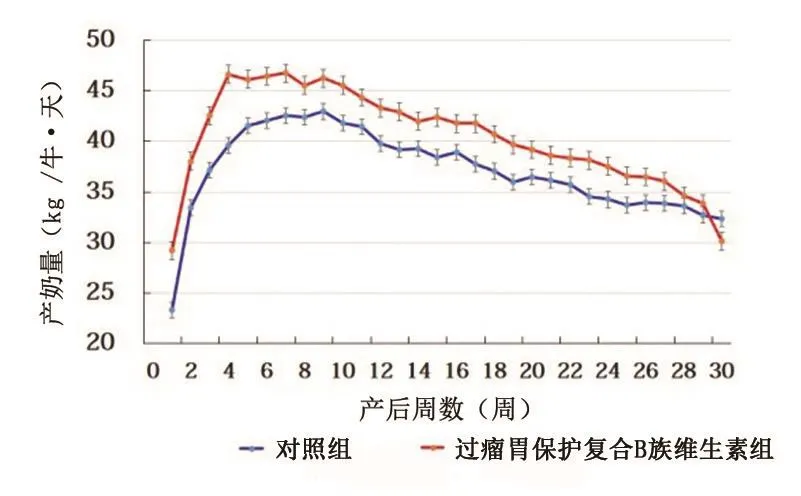
图3 对照组与过瘤胃保护复合B族维生素组经产奶牛210 天平均产奶量
4 过瘤胃保护复合B族维生素降低奶牛泌乳期的淘汰率
奶牛淘汰包括主动和被动淘汰。对照组和过瘤胃保护复合B族维生素组在泌乳高峰期分别淘汰6 头和2 头奶牛,淘汰率分别为8.45%和6.45%。过瘤胃保护复合B族维生素组奶牛淘汰率较对照组降低23.67%。产后210 天过瘤胃保护复合B族维生素组牛的淘汰率较对照组降低42.75%(分别为19.35%和33.80%)(表3)。但对照组和过瘤胃保护复合B族维生素组奶牛产后各项疾病(消化系统、乳房、肢蹄、呼吸系统和营养代谢)在淘汰时的泌乳天数无显著不同(表4)。
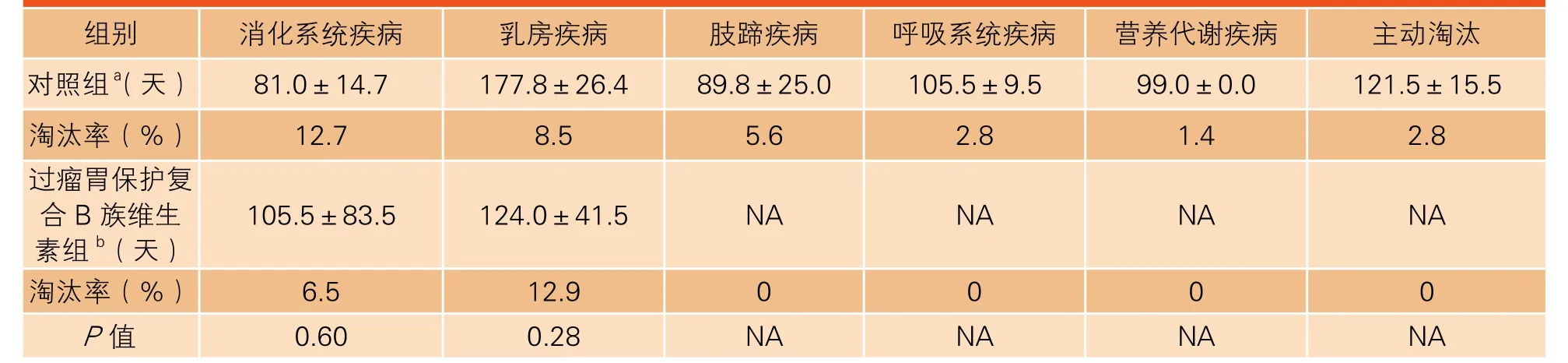
表4 对照组和过瘤胃保护复合B族维生素组高产奶牛产后210 天各项疾病淘汰时的平均泌乳天数与淘汰率

表5 过瘤胃保护复合B族维生素组较对照组奶牛干物质采食量、酮病发生率、产奶量和淘汰率比较
5 奶牛围产期日粮补充过瘤胃保护复合B族维生素提高经济效益
综合比较,高产奶牛在围产期日粮补充过瘤胃保护复合B族维生素可以有效维持健康,提高围产前期干物质采食量,改善能量代谢,降低酮病发生率和淘汰率,增加产奶量,提高经济效益(表5)。
6 讨论
许多研究显示B族维生素是高产奶牛需要的营养素。围产期和泌乳期补充B族维生素,包括胆碱[30~32]、VB1[14]、VB2[8]、VB3(Niacin[33,34])、VB5(Pantothenic acid[15,16,35,36])、VB6(Pyridoxine[15,16])、有效维持奶牛健康,提高免疫能力,降低代谢疾病、淘汰率,提高繁殖效率和产奶量。
围产期干物质采食量与能量负平衡和代谢疾病有一定关联。产犊前干物质采食量下降被认为可能导致脂质由脂肪组织游离出来,并导致与脂肪代谢失调相关的疾病,如脂肪肝和酮症。Zamet等[39]研究指出围产前期干物质采食量降幅大的(由体重的1.8%降至0.9%)较降幅小的(由体重的1.8%降至1.2%)奶牛,易造成产后代谢疾病,且降低泌乳早期的产奶量。本试验奶牛围产前期干物质采食量增加,有效改善能量负平衡。虽有研究指出干奶期干物质采食量不因奶牛日粮补充过瘤胃胆碱而改变[30,40],但Evans等[18]研究显示过瘤胃保护复合B族维生素直接影响奶牛干物质采食量。奶牛产前日粮补充过瘤胃保护复合B族维生素,干物质采食量每天平均提高1.44 千克(13.2%)。这些干物质采食量增加的趋势支持本试验的结果。相较于单独使用胆碱的研究[30,40],过瘤胃保护复合B族维生素所含的B2、B9和B12可能协同参与能量营养代谢和干物质采食量的改变[27]。过瘤胃保护复合B族维生素在高产奶牛的能量平衡与健康扮演重要角色。
随着遗传改良水平的提高,高产奶牛产后易发酮症和相关疾病,使正常产奶潜力无法充分发挥。许多研究证实,围产期日粮补充过瘤胃保护复合B族维生素有效改善(降低35%~55%)酮病发生率[19,28]。相关研究也显示,酮病与产后代谢和免疫相关疾病成正相关[41,42]。虽然降低酮病发生率间接降低奶牛淘汰率,但大部分奶牛场缺乏牛群酮病的定期监测,无法有效且及时地掌握牛群酮病的发生情况,发现时奶牛健康往往已经受到严重伤害。
虽然许多因子,例如头胎/经产、体况分数[43]等直接影响B族维生素对产奶量的作用,但有充足证据显示,经产奶牛在围产期日粮补充过瘤胃保护复合B族维生素有效提高产奶量与修饰乳成分[16,18,44,45]。过瘤胃保护复合B族维生素组奶牛在产后210 天平均每日产奶量提高3.32 kg(总量共提高697 kg/牛)。若奶价每千克以4 元计算,每头牛较对照组可提高2 788 元盈余。奶牛能量负平衡引起的酮症易导致在泌乳期间的各项疾病,繁殖和产奶量不同程度产生损失,造成牛只淘汰。酮症的经产奶牛平均每一例损失256美元[46]。过瘤胃保护复合B族维生素除了使奶牛产奶潜力充分发挥,若计入淘汰率,每头牛每年潜在利益将远高于2 788 元。
奶牛泌乳期淘汰率的提高,严重影响牛场经济效益。在追求高产奶量的同时,非自愿的淘汰率有逐年增加趋势。郭刚等[47]分析大量淘汰奶牛信息,指出消化道疾病是造成淘汰重要原因之一,消化道疾病在产后90 天的淘汰约占此疾病在整个泌乳期的50%。本试验这些泌乳早期较高的淘汰(消化和营养代谢疾病)可能是由于产前干奶和泌乳期日粮组成突然大量变化,导致瘤胃无法迅速适应日粮的剧烈变化。虽然奶牛个别疾病淘汰时在过瘤胃保护复合B族维生素组和对照组的泌乳天数无显著不同,但过瘤胃保护复合B族维生素组奶牛在210 DIM淘汰率较对照组显著降低。这些显示奶牛围产前期补充过瘤胃保护复合B族维生素有效提高奶牛干物质采食量,较大程度保护瘤胃健康与改善能量负平衡,并有效降低淘汰率。
7 总结
高产奶牛需要的B族维生素常被忽略,但越来越多的研究和商业试验数据显示,日粮补充过瘤胃保护复合B族维生素有效提高围产期牛只的干物质采食量,改善围产期牛只能量负平衡,降低产后酮病发生率。过瘤胃保护复合B族维生素除了使奶牛在围产期参与修饰能量和营养代谢过程,维持较佳健康状态外,在产奶高峰期显著且持续提高产奶量,有效降低产后淘汰率,并为牛场创造较佳经济效益与投资回报。
[1] Schwab E C,Schwab C G,Shaver R D,et al. Dietary forage and nonfiber carbohydrate contents influence B-vitamin intake,duodenal flow,and apparent ruminal synthesis in lactating dairy cows[J]. Journal of Dairy Science,2006,89(1):174-187.
[2] Ragaller V,Hüther L,Lebzien P. Folic acid in ruminant nutrition:a review[J]. British Journal of Nutrition,2009,101(2):153-164.
[3] Seck M,Linton J A,Allen M S,et al.Apparent ruminal synthesis of B vitamins in lactating dairy cows fed diets with different forage-to-concentrate ratios[J]. Journal of Dairy Science,2017, 100(3):1914-1922.
[4] Bechdel S I,Honeywell H E,Dutcher R A,et al. Synthesis of vitamin B in the rumen of the cow[J]. Journal of Biological Chemistry,1928,80(1):231-238.
[5] 赵芸君,孟庆翔. B族维生素在瘤胃中的合成及影响因素[J]. 动物营养学报,2007,19(suppl):492-497.
[6] Zinn R A,Owens F N,Stuart R L,et al.B-vitamin supplementation of diets for feedlot calves[J]. Journal of Animal Science,1987,65(1):267-277.
[7] Sharma B K,Erdman R A. In vitro degradation of choline from selected feedstuffs and choline supplements[J]. Journal of Dairy Science,1989,72(10):2772-2776.
[8] Santschi D E,Berthiaume R,Matte J J,et al. Fate of supplementary B-vitamins in the gastrointestinal tract of dairy cows[J]. Journal of Dairy Science,2005,88(6):2043-2054.
[9] Girard C L,Santschi D E,Stabler S P,et al. Apparent ruminal synthesis and intestinal disappearance of vitamin B12 and its analogs in dairy cows[J]. Journal of Dairy Science,2009,92(9):4524-4529.
[10] Girard C L,Matte J J. Dietary supplements of folic acid during lactation:effects on the performance of dairy cows[J]. Journal of Dairy Science,1998,81(5):1412-1419.
[11] Graulet B,Matte J J,Desrochers A,et al.Effects of dietary supplements of folic acid and vitamin B12 on metabolism of dairy cows in early lactation[J]. Journal of Dairy Science,2007,90(7):3442-3455.
[12] Zimmerly C A,Weiss W P. Effects of supplemental dietary biotin on performance of Holstein cows during early lactation[J].Journal of Dairy Science,2001,84(2):498-506.
[13] Majee D N,Schwab E C,Bertics S J,et al. Lactation performance by dairy cows fed supplemental biotin and a B-vitamin blend[J]. Journal of Dairy Science,2003,86(6):2106-2112.
[14] Shaver R D,Bal M A. Effect of dietary thiamin supplementation on milk production by dairy cows[J]. Journal of Dairy Science,2000,83(10):2335-2340.
[15] Juchem S O,Robinson P H,Evans E.A fat based rumen protection technology post-ruminally delivers a B vitamin complex to impact performance of multiparous Holstein cows[J]. Animal Feed Science &Technology,2012,174(1-2):68-78.
[16] Sacadura F C,Robinson P H,Evans E,et al. Effect of a ruminally protected B-vitamin supplement on milk yield and composition of lactating dairy cows[J]. Animal Feed Science& Technology,2008, 144(1-2):111-124.
[17] Pötzsch C J,Hedges V J,Blowey RW ,et al. The impact of parity and duration of biotin supplementation on white line disease lameness in dairy cattle[J]. Journal of Dairy Science,2003,86(8):2577-2582.
[18] Evans E,Mair D T,Gauthier R, et al.Effects of providing a protected vitamin and choline supplement in the transition period on dairy cow production and reproduction[J].Professional Animal Scientist,2006,22(2):158-163.
[19] Evans E,Mair D T,Gauthier R,et al. Case study:Effects of a protected vitamin and choline supplement in the transition period on dairy cow metabolic parameters and health[J]. Professional Animal Scientist,2006,22(2):164-169.
[20] Girard C L,Matte J J. Effects of intramuscular injections of vitamin B12 on lactation performance of dairy cows fed dietary supplements of folic acid and rumen-protected methionine[J]. Journal of Dairy Science,2005,88(2):671-676.
[21] Schwab E C,Garaviello D Z,Shaver R D.A meta-analysis of lactation responses to supplemental dietary niacin in dairy cows[J].Professional Animal Scientist,2005,21(4):239-247.
[22] Chen B,Wang C,Wang Y M,et al. Effect of biotin on milk performance of dairy cattle: a meta-analysis[J]. Journal of Dairy Science,2011, 94(7):3537-3546.
[23] Bertics S J,Grummer R R,Cadorniga-Valino C,et al. Effect of prepartum dry matter intake on liver triglyceride concentration and early lactation[J]. Journal of Dairy Science,1992,75(7):1914-1922.
[24] Hayirli A,Grummer R R,Nordheim E V,et al. Animal and dietary factors affecting feed intake during the prefresh transition period in Holsteins[J]. Journal of Dairy Science,2002,85(12):3430-3443.
[25] Hayirli A,Grummer R R,Nordheim E V,et al. Models for predicting dry matter intake of Holsteins during the prefresh transition period[J]. Journal of Dairy Science,2003,86(5):1771-1779.
[26] Brown A C,Chandler P T,Holter J B.Development of predictive equations for milk yield and dry intake in lactating cows[J].Journal of Dairy Science,1977,60(11):1739-1754.
[27] Girard C L,Matte J J.Impact of B-vitamin supply on major metabolic pathways of lactating dairy cows[J]. Canadian Journal of Animal Science,2006,86(2):213-220.
[28] 刘汉根,刘文忠,吴疆,等. 维产康降低荷斯坦奶牛酮病发生率效果的研究[J]. 中国乳业,2016,169(1):50-52.
[29] Oetzel G R. Herb-Level Ketosis-Diagnosis and risk factors .American association of bovine practitioners 40th annual conference, 2007.
[30] Hartwell J R,Cecava M J,Donkin S S.Impact of dietary rumen undegradable protein and rumen-protected choline on intake,peripartum liver triacylglyceride,plasma metabolites and milk production in transition dairy cows[J]. Journal of Dairy Science,2000,83(12):2907-2917.
[31] Pinotti L,Baldi A,Politis I,et al. Rumenprotected choline administration to transition cows: effects on milk production and vitamin E status[J]. Journal of Veterinary Medicine A Physiology Pathology clinical medicine 2003,50(1):18-21.
[32] Jayaprakash G,Sathiyabarathi M,Robert M A, et al. Rumen-protected choline: A significance effect on dairy cattle nutrition[J].Veterinary World,2016,9(8):837-841.
[33] Erickson P S,Murphy M R,Clark J H.Supplementation of dairy cow diets with calcium salts of long-chain fatty acids and nicotinic acid in early lactation[J]. Journal of Dairy Science,1992,75(4):1078-1089.
[34] Zimmerman C A,Rakes A H,Daniel T E,et al. Influence of dietary protein and supplemental niacin on lactational performance of cows fed normal and low fiber diets[J]. Journal of Dairy Science,1992,75(7):1965-1978.
[35] Ragaller V,Lebzien P,Bigalke W,et al.Effects of a pantothenic acid supplementation to different rations on ruminal fermentation,nutrient flow at the duodenum,and on blood and milk variables of dairy cows[J]. Journal of Animal Physiology & Animal Nutrition,2011,95(6):730-743.
[36] Ragaller V,Lebzien P,Südekum KH,et al. Pantothenic acid in ruminant nutrition:a review[J]. Journal of Animal Physiology &Animal Nutrition,2011,95(1):6-16.
[37] Fitzgerald T,Norton B W,Elliott R,et al.The influence of long-term supplementation with biotin on the prevention of lameness in pasture fed dairy cows[J]. Journal of Dairy Science,2000,83(2):338-344.
[38] Duplessis M,Girard CL,Santschi D E,et al. Effects of folic acid and vitamin B12 supplementation on culling rate,diseases,and reproduction in commercial dairy herds[J]. Journal of Dairy Science, 2014,97(4):2346-2354.
[39] Zamet C N,Colenbrander V F,Callahan C J,et al. Variables associated with peripartum traits in dairy cows. I. Effect of dietary forages and disorders on voluntary intake of feed, body weight and milk yield[J]. Theriogenology,1979,11(3):229-244.
[40] Piepenbrink M S,Overton T R. Liver metabolism and production of cows fed increasing amounts of rumen-protected choline during the periparturient period[J].Journal of Dairy Science,2003,86(5):1722-1733.
[41] Sordillo L M. Nutritional strategies to optimize dairy cattle immunity[J]. Journal of Dairy Science, 2016,99(6):4967-4982.
[42] Zhang G,Hailemariam D,Dervishi E,et al. Dairy cows affected by ketosis show alterations in innate immunity and lipid and carbohydrate metabolism during the dry off period and postpartum[J]. Research in Veterinary Science,2016,107:246-256.
[43] Zahra L C,Duffield T F,Leslie K E,et al. Effects of rumen-protected choline and monensin on milk production and metabolism of periparturient dairy cows[J]. Journal of Dairy Science,2006, 89(12):4808-4018.
[44] Sales J,Homolka P,Koukolová V. Effect of dietary rumen-protected choline on milk production of dairy cows:a metaanalysis[J].Journal of Dairy Science,2010,93(8):3746-3754.
[45] Evans E,Mair D T. Effects of a rumen protected B vitamin blend upon milk production and component yield in lactating dairy cows[J]. Journal of Animal Science,2013,3(1):78-82.
[46] McArt J A,Nydam D V,Overton M W. Hyperketonemia in early lactation dairy cattle: a deterministic estimate of component and total cost per case[J].Journal of Dairy Science,2015,98(3):2043-2054.
[47] 郭刚,罗杨,刘善超,等. 奶牛淘汰原因与淘汰时泌乳天数关系研究[J]. 中国奶牛,2012(17):47-49.

