胸腔镜肺段切除及胸腔镜辅助小切口、胸腔镜肺叶切除治疗早期肺癌的临床观察
程 鹏,于在诚△,谢琳琳
(1.安徽医科大学第一附属医院普胸外科,合肥 230022;2.安徽医学高等专科学校,合肥 230601)
目前肺癌已是发病率最高的恶性肿瘤[1]。因早期肺癌临床症状较隐匿而容易延误治疗,预后5年生存率仅为16%[2]。得益于影像诊疗的不断发展,临床早期肺癌诊断率不断提高,尤其是肺小结节及磨玻璃样影的小病灶能被更早发现。手术对于肺癌仍然是治疗首要选择[3]。随着微创理念的不断推广和腔镜手术技巧不断提高,胸腔镜肺叶切除术已列入美国国立综合癌症网络(NCCN)早期肺癌手术治疗指南[4]。腔镜手术本身具备小创伤、出血少、快恢复等优点,而且术中对淋巴结清扫亦符合规范化要求,治疗效果等同于开胸手术[5]。对于肺癌合并长期烟龄及慢性基础疾病的人群,术前心肺功能欠佳,肺叶切除术式会增加术后心肺并发症风险。而早期肺癌肺段切除能否取得与肺叶切除一致的临床疗效尚存在争议[6]。结合安徽医科大学第一附属医院胸腔镜肺癌手术的发展历程,本次研究选取2013年1月至2016年6月120例早期肺癌手术治疗患者作为研究对象,比较分析在早期肺癌患者中应用胸腔镜辅助小切口、胸腔镜肺叶切除及胸腔镜肺段切除3种不同术式的围术期指标和治疗效果。
1 资料与方法
1.1一般资料 选取2013年1月至2016年6月120例早期肺癌手术治疗患者作为研究对象,根据手术方法分为胸腔镜辅助小切口肺叶切除术(A组)38例,男女比例为18∶20,平均年龄(69.1±3.9)岁;胸腔镜下肺叶切除术(B组)42例,男女比例为22∶20,平均年龄(70.8±3.5)岁;全胸腔镜下肺段切除术(C组)40例,男女比例为19∶21,平均年龄(70.1±3.2)岁;病变部位中,右肺63例,其中上中下肺叶分别为23例、15例、25例,左肺57例,其中上下肺叶分别为21例、26例;病理资料中,浸润腺癌72例,鳞癌7例,腺鳞癌5例,非典型腺瘤样增生7例,原位腺癌16例,微侵润腺癌13例。三组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。本次研究经医院伦理委员会批准并获得患者知情同意。
1.2纳入与排除标准
1.2.1纳入标准 (1)依据NCCN肺癌的TNM分期标准,临床分期为Ⅰa期患者;(2)患者术前评估无手术禁忌证;(3)所有患者术前未接受放化疗等抗肿瘤措施;
1.2.2排除标准 (1)严重脏器功能异常或障碍者;(2)小细胞肺癌患者。
1.3方法 患者入手术室后均行双腔气管插管静吸复合全身麻醉,健侧卧位,肋部垫高,进胸后阻断患侧肺通气。对于一些微小病灶进胸后结合术前高分辨CT及手指触摸定位,三组病灶行术中冰冻病理检查明确肺癌,术中均常规清扫淋巴结,右侧清扫组数为2~4、 7~9、10~12组,左侧清扫组数为4~9、10~12组。
A组患者在手术侧腋中线第7肋间切开一长约2.0 cm切口,置入戳卡,作为腔镜观察孔,腔镜探查胸膜腔,确定肿瘤组织的大小、位置及胸腔粘连情况,在同侧腋前线第4肋间切开一长5~7 cm小切口,逐层进胸,小号撑开器固定拉大切口,腔镜器械及常规器械在该切口一并使用。电刀与电钩相结合游离粘连带,将含有癌组织肺叶的肺静脉、肺动脉和支气管依次分离,采用传统结扎及闭合器结合的方法予以切断,常规清扫淋巴结;注水鼓肺检查支气管残端无漏气后,在腔镜孔置入胸管关胸。
B组患者在手术侧腋中线第7肋间切开一长约2.0 cm切口,置入戳卡,作为腔镜观察孔,腔镜探查胸膜腔,确定肿瘤组织的大小、位置及胸腔粘连情况,分别在第4肋间和胸大肌后缘、背阔肌肌前缘做切口,直径在4 cm,作为腔镜主操作孔,在第7肋间做一个1.5 cm切口作为腔镜副操作孔,显露肺门组织结构,采用单一“由浅入深,由易至难,有粘连的结构最后处理”的解剖顺序,游离显露出肺叶血管及支气管,使用Endo-GIA切割缝合器将其离断。而对于一些肺裂发育不全的病例,术中肺血管的离断顺序可根据实际手术需要加以选择,相关研究表明:肺血管处理顺序不影响肿瘤复发、转移和生存[7]。注水鼓肺检查支气管残端无漏气后,在退镜前查看各切口有无出血,在腔镜孔置入胸管关胸。
C组患者进胸过程及操作孔位置与B组相同,明确病灶所在肺段后,超声刀与电钩相结合解剖分离肺段动静脉及段支气管,细小血管推节器丝线结扎后离断,段间动静脉使用Endo-GIA 切割缝合器将其离断。游离段支气管后切割缝合器切断,使用“膨肺萎陷法”用氩气刀标注充气无法萎陷的肺段界限,切割缝合器离断其与余肺连接部,术中冰冻明确肺切缘距病灶大于或等于2 cm,注水鼓肺检查支气管残端无漏气后,在退镜前查看各切口有无出血,在腔镜孔置入胸管关胸。
1.4观察指标 比较三组患者围术期各项指标:手术时间、住院时间、术中出血量及术后胸腔引流量;记录比较三组患者术后2个月肺功能各项指标:第1秒用力呼气量(FEV1)、最大通气量(MVV)、用力肺活量(FVC);比较三组患者术后并发症:肺不张、肺部感染、心律失常、支气管胸膜瘘的发生情况;比较三组患者15个月的中位随访期有无肿瘤复发和转移情况。

2 结 果
2.1围术期各项指标比较 B、C组在手术时间、住院时间、术中出血量及术后胸腔引流量较A组均降低(P<0.05),C组术后胸腔引流量低于B组(P<0.05)。见表1。

表1 三组患者手术观察指标比较
*:P<0.05,与A组比较;#:P<0.05,与B组比较
2.2术前、术后3个月肺功能指标比较 A组术后3个月的MVV、FVC及FEV1低于B组和C组(P<0.05),而C组各项肺功能指标又高于B组(P<0.05)。见表2。

表2 三组患者术前、术后3个月肺功能指标比较
△:P<0.05,与同组术前比较;*:P<0.05,与A组术后3个月比较;#:与B组术后3个月比较,P<0.05
2.3术后并发症发生情况比较 三组术后均未出现支气管胸膜瘘,B、C组在术后肺部感染、肺不张及心律失常发生率低于A组(P<0.05),而C组并发症发生率与B组差异无统计学意义(P>0.05)。见表3。
2.4预后情况比较 三组患者术后均定期复查,中位随访时间为15个月(12~18个月),均未发现复发和淋巴结及远处血型转移情况。
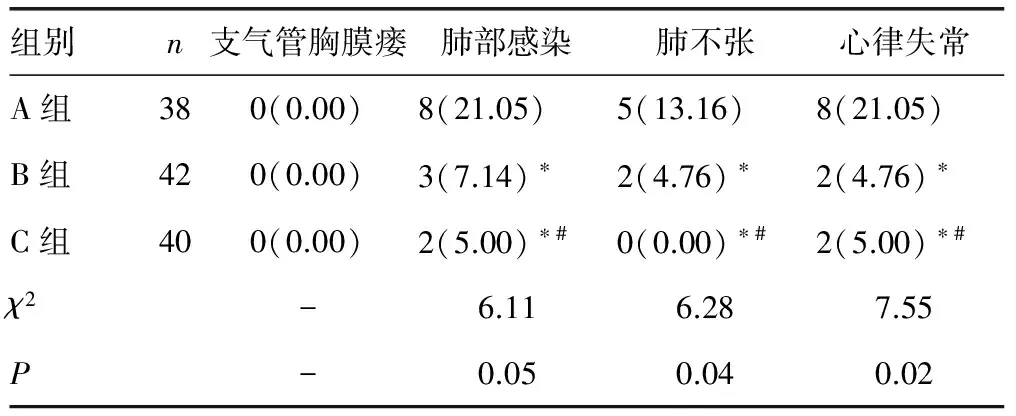
表3 三组术后并发症发生情况比较[n(%)]
*:P<0.05,与A组比较;#:P>0.05,与B组比较;-:无数据
3 讨 论
胸腔镜因其切口对胸壁损伤小,恢复快,使得术后疼痛明显减轻,对于心肺功能的保护优势明显[8]。目前胸腔镜手术在临床肺癌治疗领域已广为普及,而在术式方面,肺叶切除+系统性淋巴结清扫仍然被认为是肺癌的标准治疗方案[9]。但对于脏器功能储备减退的高龄早期肺癌患者,其术后并发症发生率仍较高,胸腔镜下肺段切除自1993年首次报道以来[10],采用该术式的肺癌治疗相关研究不断增多。有研究对85例Ⅰ期肺腺癌患者的研究报道亦表明肺段切除与肺叶切除在围术期指标、术后并发症发生率方面差异无统计学意义(P>0.05)[11]。本研究结果表明,肺段切除与肺叶切除在围术期如手术时间、住院时间、术中出血量方面差异无统计学意义(P>0.05),肺段切除术后胸腔引流更少,可能与残腔缩小渗出减少有关,提示手术安全性方面两组一致,肺段切除组术后肺部并发症发生率与肺叶切除组方面差异无统计学意义(P>0.05),但其单组发生率较肺叶切除组有下降趋势,其差异不明显,可能与样本量有关,需进一步收集病例加以研究。
因肺叶切除降低了患者有效通气量及气体弥散面积,对于肺癌合并肺部基础疾病的高龄患者胸腔镜肺叶切除会增加术后心肺并发症风险[12]。而肺段切除能最大限度地保留健康肺组织,对于术后降低肺功能的减损优势明显,对预防术后肺部并发症如肺炎、肺不张等有积极意义,同时提高了术前肺功能欠佳患者的手术适应症。本次研究中,肺段切除组术后肺功能各项指标FVC、MVV、FEV1均优于肺叶切除组,差异有统计学意义(P<0.05),说明肺段切除肺功能恢复更为迅速,大大改善了患者术后生活质量。
相较于肺叶切除,肺段切除对术者的解剖认知及手术技巧要求更高。因肺段内血管位置深且变异大,尤其是肺段内静脉显露不清时,可参照变异较少的段支气管加以明确,而对于肺段血管的处理,尤其是注意避免误伤其他肺段静脉而引起的血液回流障碍,导致术后肺实变及咳血情况。明确切除肺段的界限也是术中关键,目前国内大部分相关病例报道采用夹闭段支气管后膨肺,通过肺段间的充气与萎陷来判断切除范围,但在膨肺过程中气体仍可通过段间细支气管及肺泡小孔将目标肺段膨起,而通过“膨肺萎陷法”即膨肺后再阻断通气,目标肺段因支气管闭塞后无法像正常肺段塌陷,从而切除充气的肺段提高目标肺段的精确性。
随着人们对日常体检的重视及影像诊疗技术的发展,以肺磨玻璃样结节(GGO)代表的早期肺癌诊断率不断提高。但对于肺段切除适应症目前尚有争议,主要分歧是对肺癌治疗的预后判断。参照2015年NCCN肺癌治疗指南中的肺段切除适用标准[13],笔者认为肺段切除适用于浸润性肺腺癌(T1N0M0)的非小细胞肺癌且直径小于或等于2 cm,术中冰冻肿瘤切缘大于或等于2 cm,其段间、叶间淋巴结阴性及无法耐受肺叶切除的患者。其中肺癌切缘距离及淋巴结转移情况直接影响其预后,而对于微小早期肺癌病理研究表明无明显淋巴结转移[14],使得早期肺癌肺段切除有着不亚于肺叶切除的生存预后,与本研究早期肺癌肺段切除疗效相同。而受限于本次随访时间较短,肺段切除方式对于其术后肿瘤转移及远期生存率等临床治疗效果有待进一步研究探讨。
综上所述,对早期肺癌治疗中,胸腔镜肺段切除较肺叶切除能减少术后胸腔渗出,更好地保护肺功能,且生存预后无明显差异,临床疗效值得肯定。
[1]黄佳,赵晓菁,林皓,等.单向四孔法全胸腔镜肺叶切除术治疗非小细胞肺癌的临床研究[J].中国胸心血管外科临床杂志,2012,19(2):125-129.
[2]焦鹏,李简,佟宏峰,等.两孔与三孔胸腔镜肺叶切除、淋巴结清扫术治疗肺癌的对比研究[J].腔镜外科杂志,2015,20(9):684-688.
[3]LANG-LAZDUNSKI L.Surgery for non-small cell lung cancer[J].Eur Respir Rev,2013,129(22):382-404.
[4]丁仁泉,童向东,许世广,等.达芬奇机器人手术系统与电视胸腔镜手术与开胸手术治疗纵膈肿瘤的临床疗效比较分析[J].中国肺癌杂志,2014,19(7):557-562.
[5]吕宾,胡德宏,卢恒孝,等.全胸腔镜单向式肺叶切除在Ⅰ/Ⅱ期非小细胞肺癌治疗中的临床应用[J].中华腔镜外科杂志,2012,5(1):46-49.
[6]VILLAMIZAR N,SWANSON S J.Lobectomy vs.segmentectomy for NSCLC(T<2 cm)[J].Ann Cardiothorac Surg,2014,3(2):160-166.
[7]姜冠潮,李凤卫,李晓,等.全胸腔镜肺叶切除术中肺动、静脉切断顺序对早期非小细胞肺癌疗效的影响[J].中华胸心血管外科杂志,2014,30(9):513-516.
[8]张艳娇,高禹舜.肺癌胸腔镜肺叶切除、胸腔镜肺段切除与开胸肺叶切除术后对肺功能影响的研究[J].中国肺癌杂志,2016,19(10):700-704.
[9]韦诗友,赵珂嘉,郭成林,等.肺磨玻璃结节的外科诊断和治疗分析——附663例报告[J].四川大学学报(医学版),2017,48(3):359-362.
[10]胡牧,张毅,许庆生,等.早期非小细胞肺癌切除范围的临床研究[J].首都医科大学学报,2016,37(6):763-766.
[11]TSUTANI Y,MIYATA Y,NAKAYAMA H,et al.Oncologic outcomes of segmentectomy compared with lobectomy for clinical stage IA lung adenocarcinoma:propensity score-matched analysis in a multicenter study[J] Thorac Cardiovasc Surg,2013,146(2):358-364.
[12]毛宇,郭伟,黎明,等.计划性亚肺叶切除
术的肺功能的影响[J/CD].中华胸部外科电子杂志,2017,4(2):101-106.
[13]刘世学,王君,徐美清,等.全胸腔镜下解剖学肺段切除41例临床分析[J].中国微创外科杂志,2016,16(12):1127-1130.
[14]柴振达,陈志军,竺王玉,等.原发性周围型微小肺癌临床特征及预后分析[J].浙江医学杂志,2017,39(5):332-335.

