DWI对前列腺癌诊断与Gleason评分的相关性分析
刘 勇,宋震宇,张刘璐,陈正君
(1.西南医科大学附属中医医院MRI室,四川泸州 646000;2.西南医科大学附属医院功能科,四川泸州 646000)
随着我国人口老龄化和人民生活方式的改变,前列腺癌在我国的发病率及患病率呈逐年上升的趋势,成为影响我国男性健康的重要因素并为社会医疗增加了负担[1]。前列腺癌恶性程度高,骨转移早,早期准确诊断是目前影像科医生工作的重点和难点。随着MRI新兴功能成像序列的发展和应用,已有较多学者应用扩散加权成像(diffusion weighted imaging,DWI)对前列腺癌进行诊断研究,但鲜有学者分析DWI诊断前列腺癌的准确率与Gleason评分的相关性。本文旨在研究DWI诊断前列腺癌准确率与Gleason评分的相关性,为临床诊断提供参考价值。
1 资料与方法
1.1一般资料 收集西南医科大学附属中医医院2013年12月至2015年12月临床怀疑前列腺癌的患者91例。所有患者均被病理证实为前列腺增生或前列腺癌。患者年龄59~72岁,平均(65.0±6.3)岁。主要症状有排尿困难、肉眼血尿、腰部及髋部疼痛,前列腺特异扩原水平(PSA)为(9.22~115.2)ng/mL。
1.2方法
1.2.1MRI扫描 使用Philips 1.5T MRI扫描仪及8通道体部线圈,入选患者检查前适当饮水使膀胱充盈,排空直肠内粪便。患者取仰卧位、平卧,双手平行置于腹部两侧,头先进,以耻骨连合为中心定位扫描。先行MRI常规序列(T1WI/T2WI)轴位,再行T2WI冠状位及DWI轴位扫描。扫描参数:TR/TE=1 705 ms/77 ms,层厚/层距=4 mm/1 mm,NSA=2,矩阵=256×256,FOV=375 mm,b值为600 s/mm2。
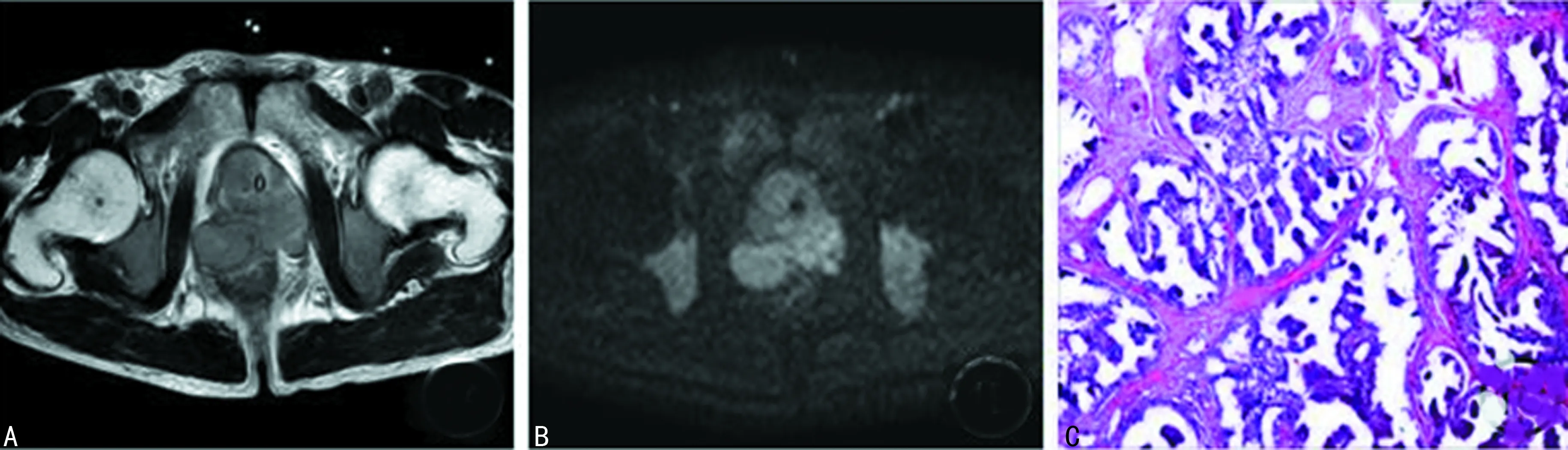
A:T2WI示前列腺周围叶体积增大并信号减低,双侧髋臼信号异常;B:DWI示前列腺周围叶及双侧髋臼呈高信号;C:常规HE染色示前列腺癌细胞呈中分化,部分腺腔结构存在,Gleason评分3+3=6分
图1男,85岁,前列腺癌

A:T2WI示前列腺周围叶与中央叶分界不清并信号减低;B:DWI示前列腺呈明显的高信号;C:常规HE染色示前列腺癌组织呈实性,细胞异型性明显,分化程度低,Gleason评分4+4=8分
图2男,73岁,前列腺癌
1.2.2图像处理及数据测量 将DWI原始图像在MR原厂后处理软件上进行重建,在重建好的表观扩散系数(ADC)图像上测量ADC值。由两位具有丰富磁共振成像诊断经验的主治及以上职称的影像医师一同测量,将ADC图和DWI图与结合常规T2WI序列,避开囊变、坏死等非病灶实体成分区,由两位诊断医师一同手工选择感兴趣区(region of interest,ROI),ROI区略小于病灶,测量所选目标组织的ADC值。
1.2.3病理结果 所有病例均行穿刺活检或手术取材,病理标本以10%福尔马林固定,用石蜡包埋切片,行常规HE染色,并由资深病理科医师进行读片,对诊断为前列腺癌的病例进行Gleason评分。将前列腺癌组病例根据Gleason评分分为高分化组(Gleason评分小于7分)、中分化组(Gleason评分7~8分)和低分化组(Gleason分大于8分)。

2 结 果
2.1病理结果与评分 前列腺增生44例,前列腺癌47例。高分化组、中分化组和低分化组分别为11、23、13例。前列腺癌中Gleason评分5分5例,6分6例,7分11例,8分12例,9分8例,10分5例。
2.2MRI表现 前列腺癌表现为高信号的外周叶中出现低信号的结节灶或肿块影,T1WI/T2WI均表现为等/低信号,DWI序列表现为高信号;病灶可向包膜外生长,侵犯膀胱、精囊腺等结构,亦可与中央叶分界不清(图1A~B,2A~B)。前列腺癌多为腺癌,高分化肿瘤表现为腺泡规则,排列拥挤;低分化癌则表现为癌细胞排列呈索条、巢状或片状(图1C,图2C)。
2.3ADC值对前列腺癌的诊断 本研究中,前列腺增生组(44例)ADC值=(1.250±0.263)×10-3mm2/s,前列腺癌组(47例)ADC值=(0.955±0.191)×10-3mm2/s,二者ADC值测量结果差异有统计学意义(t=6.10,P<0.05)。对前列腺增生和前列腺癌的ADC值作受试者工作特征(ROC)曲线绘图,得出ROC曲线下面积(AUC)=0.826。以ADC值=1.095×10-3mm2/s为最佳阈值兼备诊断前列腺增生与前列腺癌,其灵敏度、特异度、准确度分别为83.3%、71.7%、76.8%。
2.4不同前列腺癌Gleason评分组的ADC值 47例前列腺癌中,高分化组(11例)ADC值=(1.158±0.173)×10-3mm2/s,中分化组(23例)ADC值=(1.050±0.192)×10-3mm2/s,低分化组(13例)ADC值=(0.891±0.241)×10-3mm2/s。高分化组与中分化组比较,差异有统计学意义(t=5.06,P<0.05)。高分化组与低分化组比较,差异有统计学意义(t=12.65,P<0.05)。中分化组与低分化组比较,差异有统计学意义(t=6.10,P<0.05)。不同Gleason评分组间的ADC值比较,差异有统计学意义(P<0.05),且ADC值与Gleason评分呈负相关(r=-0.677)。
2.5ADC值对不同Gleason评分组前列腺癌的检出率 以ADC值≤1.095×10-3mm2/s为标准诊断前列腺癌,高分化组、中分化组及低分化组中分别有7、18、11例准确诊断为前列腺癌。高分化组准确率63.6%(7/11),中分化组准确率78.3%(18/23),低分化组准确率84.6%(11/13),三组差异有统计学意义(χ2=8.06,P<0.05),且ADC值诊断前列腺癌的准确率与Gleason评分呈正相关(r=0.689,P<0.05)。
3 讨 论
3.1弥散加权成像原理及其对前列腺癌的诊断价值 弥散运动,即为分子所作的随机无规则自由运动,又称为布朗运动或分子热运动。由于分子所处环境不同,其扩散能力也不尽相同。在常规MRI的自旋回波序列(SE)中施加一对大小相同、方向相反的射频脉冲,组成的新序列称为DWI。在正常人体组织中,水分子扩散运动是受到多种不定因素影响。因此,需要一个客观、准确的数值来量化水分子作扩散运动的能力。ADC是量化分析病灶在DWI图像上信号强弱的一个数量指标,能够客观地反映组织水分子的扩散能力。
前列腺良性增生(bening prostate hyperplasia,BPH)主要发生于前列腺的中央带,其组织病理学上主要以前列腺纤维间质、腺体及平滑肌等组织的良性增生所构成,由于这些增生组织致密,导致前列腺组织质地坚硬,组织间隙中的纤维成分增多,细胞间隙内的水分子运动受限,其ADC值低于正常的前列腺组织。前列腺癌细胞异型性增加,癌细胞体积小,核浆比增大;同时,癌细胞没有正常的组织结构和生理功能,癌组织供血血管异常增生,细胞外间隙减小,导致水分子弥散运动能力明显受限。因此前列腺癌在DWI图表现为异常的高信号,ADC图则表现为结节状的低信号灶。
任静等[2]研究发现BPH增生结节的ADC值为(1.576±0.101)×10-3mm2/s和前列腺癌灶的ADC值为(0.934±0.166)×10-3mm2/s,与本研究中前列腺增生组的ADC值(1.250±0.263)×10-3mm2/s和前列腺癌组的ADC值(0.955±0.191)×10-3mm2/s的研究结果基本相同。本组数据根据诊断检验实验,当ADC值等于1.095×10-3mm2/s时最具有诊断价值,以此为诊断最佳阈值,其诊断前列腺癌的灵敏度、特异度、准确度分别为83.3%、71.7%、76.8%,此结果与国内相关学者的研究报道基本符合[3-4]。
3.2DWI对前列腺癌不同Gleason评分组的检出价值 已有较多学者就ADC值与肿瘤的病理类型之间进行了相关性研究,发现不同病理类型的恶性肿瘤,其ADC值也会有差异。但鲜有学者就DWI序列对前列腺癌的准确率与Gleason评分之间的关系进行相关性研究[5-6]。Gleason系统评分是前列腺癌病理结果的一种独特的评分系统,其分值由肿瘤的恶性程度所决定,可以为临床提供患者的预后情况。笔者推测认为,随着前列腺癌的恶性程度增加,细胞异型性也将增大,同时细胞外正常的组织间隙也将减少,导致水分子扩散运动的能力进一步受限,因此恶性程度越高的肿瘤,其ADC值越低。
目前,已有学者研究认为ADC值与Gleason评分呈负相关,即ADC值越大, Gleason评分越低,反之亦然,并且认为ADC值可以作为非侵袭性手段来评价前列腺癌的生物学特性及其预后情况[7-8]。ROSENKTRATZ等[9]研究b=1 000 s/mm2时,ADC图对外周带前列腺癌的检出率,发现Gleason评分大于6分的前列腺癌检出率明显高于Gleason评分小于或等于6分,两者之间差异有统计学意义(P=0.027)。在本研究中,11例前列腺癌高分化组(Gleason评分小于7分)的准确率为63.6%;23例中分化组(Gleason评分7~8分)的准确率为78.3%;13例低分化组(Gleason评分大于8分)的准确率为84.6%。三组间差异有统计学意义(χ2=8.06,P<0.05),且APC值对前列腺癌诊断的准确率与Gleason评分呈正相关(r=0.689,P<0.05)。
综上所述,DWI不仅对前列腺癌具有较高的灵敏度和特异度,其ADC值还与前列腺癌的Gleason评分具有一定的相关性,前列腺癌分化程度越低,Gleason评分分值越高,DWI序列对其诊断的准确性也越高。
[1]韩苏军,张思维,陈万青,等.中国前列腺癌发病现状和流行趋势分析[J].临床肿瘤学杂志,2013,18(4):330-334.
[2]任静,宦恰,常英娟,等.DWI在正常前列腺及前列腺疾病的初步应用[J].中国医学影像技术,2007,23(5):748-750.
[3]吴道清,陈自谦.DCE-MRI与DWI对良恶性前列腺疾病诊断的价值[J].临床放射学杂志,2010,29(2):211-215.
[4]沈新平,叶炯贤,张娜,等.扩散加权成像对诊断前列腺癌的初步研究[J].中国医学影像学杂志,2012,20(7):485-488.
[5]王功伟,沈丹华.国际泌尿病理协会前列腺癌Gleason分级系统基本特征初步分析[J].中华男科学杂志,2014,22(6):514-517.
[6]马艺宁,杨华.前列腺癌预后因素的探讨[J].病理学杂志,2007,14(5):387-389.
[7]利华,郑晓林,高云,等.MR扩散加权成像评价前列腺癌生物学特性的研究[J].临床放射学杂志,2011,30(5):678-680.
[8]VERMA S,RAJESH A,MORALES H,et al.Assessment of aggressiveness of prostate cancer:correlation of apparent diffusion coefficient with histologic grade after radical prostatectomy[J].AJR Am J Roentgenol,2011,196(2):374-381.
[9]RSENKTRATZ A B,HINDMAN N,LIM R P,et al.Diffusion-Weighted Imaging of The Prostate:Comparison of b1000 and b2000 Image Sets for Index Lesion Detection[J].J Magn Reson Imaging,2013,38(3):694-700.

