乳腺癌患者外周血miRNA-134表达及化疗耐药的机制
顾 峰,周 岩,韦培培
(上海市浦东新区人民医院检验科 201200)
微RNA(microRNAs,miRNA)是哺乳动物体内存在的一类非编码RNA,在细胞内主要调节基因的表达[1]。国外研究证实miRNA表达异常可能诱导癌基因或抑癌基因表达,并诱导肿瘤细胞对化疗药物耐药[2-3]。miRNA-134是广泛存在于多种恶性肿瘤中的miRNA,研究证实miRNA-134具有抑制肿瘤细胞增殖、迁移、侵袭和诱导肿瘤细胞凋亡等一系列生物学功能[4-5]。RONG等[6]证实诱导miRNA-134高表达能够增加人肺腺癌对化疗药物的敏感性,提示miRNA-134可能与化疗耐药有关。本研究采用miRNA基因芯片技术检测乳腺癌化疗敏感和化疗耐药患者外周血miRNA-134表达,并通过体外建立表柔比星、多西他赛耐药的乳腺癌细胞系,观察各细胞系间miRNA-134表达的差异,旨在探讨外周血miRNA-134预测乳腺癌化疗耐药的作用机制,现将研究成果报道如下。
1 资料与方法
1.1一般资料 选择2013年7月至2014年7月在本院行多西他赛+表柔比星+环磷酰胺方案(TEC方案)化疗的初诊乳腺癌患者98例,所有患者经病理学确诊后行TEC新辅助化疗:静脉滴注多西他赛75 mg/m2,第1天;静脉滴注表柔比星50 mg/m2,第1天;静脉滴注环磷酰胺500 mg/m2,第1天;21 d为1个周期,总计化疗6个周期。6个化疗周期结束后参考RECIST 1.1版实体瘤疗效评价标准[7]对疗效进行评价,完全缓解(CR):所有目标病灶消失;部分缓解(PR):基线病灶长径总和缩小大于或等于30%;进展(PD):基线病灶长径总和增加大于或等于20%或出现新病灶;稳定(SD):基线病灶长径总和有缩小但未达PR或有增加但未达PD。根据化疗耐药的评价标准[8]:将CR和PC患者列为化疗敏感组(n=68),SD和PD患者列为化疗耐药组(n=30)。化疗结束后抽取患者外周肘静脉血3 mL,静置10~20 min,12 000 r/min离心15 min,吸取上清液置于-80 ℃冰箱保存待检。
1.2方法
1.2.1材料与试剂 人乳腺癌细胞系MCF-7为本院实验室保存,正常传代培养;多西他赛注射液购自海正辉瑞制药有限公司,盐酸表柔比星注射液购自奥地利依比威药品有限公司,RNeasy MineElute clanup kit、miScript II RT Kit、miScript SYBR®Green PCR Kit均购自德国QIAGEN公司,RNA寡核苷酸miRNA mimics、miRNA抑制剂miRNA inhibitor均购自上海吉凯基因化学技术有限公司,转染试剂LipofectamineTM2000、总RNA抽提试剂Trizol均购自美国Invitrogen公司,小鼠抗人Bax单克隆抗体、小鼠抗人Caspase-3单克隆抗体、荧光标记的羊抗兔IgG抗体购自武汉博士德生物工程有限公司,RPMI 1640培养基、胎牛血清(FBS)、二甲亚砜(DMSO)购自美国Gibco公司。
1.2.2仪器 VILBER凝胶成像仪及凝胶成像分析系统购自法国VILBER LOURMAT公司,流式细胞仪购自美国BD公司,紫外可见分光光度计和酶标仪均购自美国BioRad公司,PCR扩增仪购自德国Eppendorf公司,倒置显微镜购自日本奥林巴斯公司,高速离心机购自美国贝克曼库尔特公司。
1.2.3血清miRNA-134检测 取约500 μL血清,参考RNeasy MineElute clanup kit说明书提取总RNA,检测总RNA吸光度(optical delnsity,OD)值,以OD260/280值1.8~2.0表示样品合格。将总RNA用反转录试剂盒反转录为cDNA,以cDNA为模板、实时定量miRNA-134作为引物进行PCR反应,反应条件:引物浓度0.3 μmmol/L,96 ℃变性20 s,60 ℃退火45 s,总计35个循环。70~94 ℃绘制熔解曲线,分析PCR熔解曲线,每个样品设3个平行孔,以U6作为内参照,计算miRNA-134的相对表达量(2-△△Ct)。引物委托上海生物科技工程有限公司合成,miRNA-134引物序列上游:5′-CCT AGC AGC ACA GAA A-3′,下游:5′-GAG CAG GCT GGA GAA-3′;内参U6上游:5′-CTC GCT TCG GCA GCA CAT G-3′,下游:5′-CGC TTC ACG AAT TTG CGT G-3′。
1.2.4表柔比星耐药细胞系的构建 参考QIN等[9]报道的方法,取对数生长期细胞,加入150 μL胰蛋白酶充分消化,1 500 r/min离心5 min收集细胞,加入不含血清的培养基重悬,调整细胞计数为1.0×109个/L;取10 mL细胞常规接种于培养瓶中,继续培养24 h;再向培养瓶中加入含10 mg/L表柔比星的培养液,培养48 h后弃去培养液;加入新鲜培养液继续培养48 h。待细胞重新恢复生长,继续消化细胞,再换用含50 mg/L表柔比星的培养液培养48 h,如此反复,分别加入含10、50、100、200、500 mg/L表柔比星的培养液反复诱导培养,最终获得耐500 mg/L表柔比星的细胞株,将此细胞株在不含表柔比星的培养液中继续培养。
1.2.5多西他赛耐药细胞系的构建 参考QIN等[9]报道的方法,多西他赛耐药细胞株诱导方法同表柔比星耐药细胞系,只是向培养瓶中加入含10 mg/L多西他赛的培养液,最终获得耐500 mg/L多西他赛的细胞株,将此细胞株在不含多西他赛的培养液中继续培养。
1.2.6细胞增殖能力检测 采用噻唑蓝(MTT)比色法检测各组细胞增殖能力:取对数生长期细胞,加入150 μL胰蛋白酶充分消化,1 500 r/min离心5 min收集细胞,加入不含血清的培养基重悬,调整细胞计数为1.0×109个/L;轻轻混匀细胞,于96孔板每孔中加入100 μL细胞悬液,再分别加入10、50、100、200、500 mg/L的表柔比星或多西他赛,每组浓度设置3个复孔,37 ℃、5% CO2下孵育。分别于孵育2、3、4、5、6、7 d后各取出1块96孔板,弃去原培养液,加入新配置RPMI 1640培养液,再于每孔中加入20 μL浓度为5 mg/mL的MTT溶液,继续孵育4 h,然后终止培养;再向每孔中加入100 μL DMSO,充分振荡15 min,检测各孔570 nm处的OD值。
1.2.7miRNA mimics、miRNA inhibitor转染 取对数生长期的MCF-7细胞(MCF-7组)和经表柔比星、多西他赛处理过的MCF-7细胞(表柔比星组、多西他赛组),分别加入150 μL胰蛋白酶充分消化,1 500 r/min离心5 min收集细胞,加入不含血清的培养基重悬,调整细胞计数为1.0×109个/L,将细胞接种于24孔板中,约2.0×105个/孔,再向每孔中含有LipofectamineTM2000、miRNA mimics或miRNA inhibitor的培养基,以仅加入LipofectamineTM2000试剂孔作为对照组,转染36 h后弃去原培养液,重新更换新鲜含FBS完全培养基,37 ℃、5% CO2下继续培养。
1.2.8细胞凋亡检测 取对数生长期的MCF-7细胞(MCF-7组)和经表柔比星、多西他赛处理过的MCF-7细胞(表柔比星组、多西他赛组),PBS冲洗3次,调整细胞计数为1.0×109个/L,向Falcon试管中加入200 μL细胞悬液,再分别加入Annexin Ⅴ和核酸染料,轻轻摇匀,室温避光静置10 min,再分别加入5 μL PI和0.5 μg SAv-FITC试剂,于1 h内上流式细胞仪进行检测。
1.2.9细胞Bax、Caspase-3蛋白检测 取200 μL细胞悬液,接种于培养瓶中,待培养瓶细胞融合度大于或等于80%时,将培养液吸出,PBS冲洗3次;再向每孔中加入100 μL 含1%PMSF的细胞裂解液,待细胞完全裂解后,15 000 r/min离心5 min,留取上清液。将上清液移至EP管中,加入等量上样液,100 ℃煮沸5 min,使蛋白完全变性。采用Western blot检测细胞Bax、Caspase-3蛋白表达:十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,并转移至PVDF膜上,100 mA、40 min电转后将PVDF膜取出。5%脱脂牛奶封闭2 h,分别加入Bax单克隆抗体和Caspase-3单克隆抗体,4 ℃孵育过夜;PBS冲洗3次,再分别加入羊抗兔IgG抗体(二抗),室温下振摇3 h,PBS冲洗3次。荧光图像扫描及条带灰度值分析,目的蛋白相对表对量为样本条带与GAPDH条带灰度值之比。

2 结 果
2.1化疗耐药组与化疗敏感组血清miRNA-134表达比较 化疗耐药组、化疗敏感组miRNA-134表达水平分别为0.763±0.069、1.048±0.114,化疗敏感组血清miRNA-134表达水平明显高于化疗耐药组,差异有统计学意义(P<0.05)。
2.2表柔比星、多西他赛耐药细胞系形态学表征 加药前MCF-7细胞呈长梭形,排列均匀;加入表柔比星24 h后,细胞胞体变圆,部分出现凸起,折光率变强;加入多西他赛24 h后,细胞核明显肿胀,颗粒感增强;随着撤药时间的延长,表柔比星耐药细胞和多西他赛耐药细胞均恢复长梭形,见图1、2。
2.33组细胞增殖能力比较 MCF-7组、表柔比星组、多西他赛组增殖能力均随时间延长逐渐增强,第3、4、5、6、7天表柔比星组、多西他赛组细胞增殖能力明显低于MCF-7组(P<0.05),见表1。
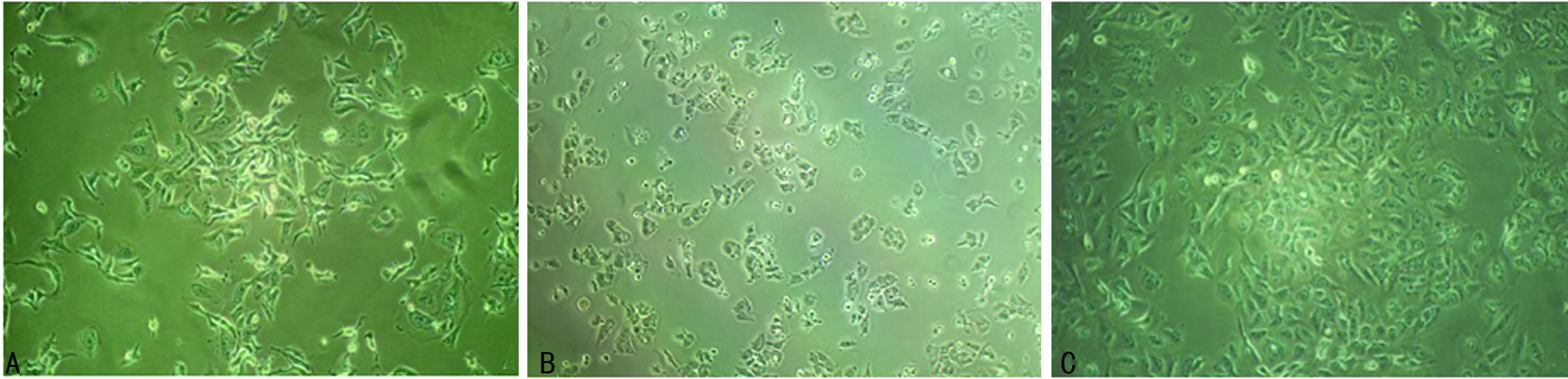
A:加药前;B:加药24 h;C:不含表柔比星的培养液继续培养第20天
图1表柔比星加药前后细胞形态变化(×100)
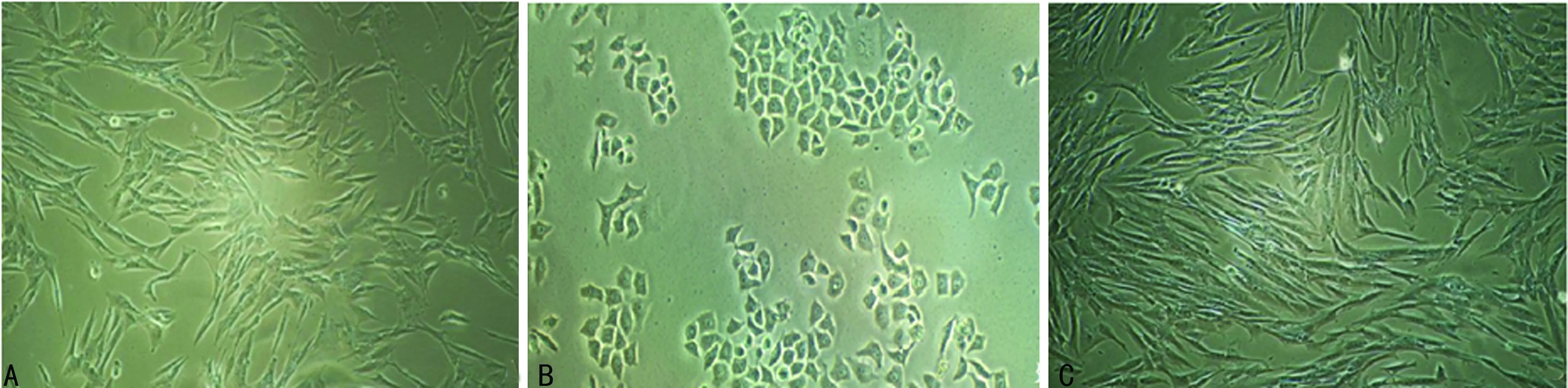
A:加药前;B:加药24 h;C:不含多西他赛的培养液继续培养第20天

图2 多西他赛加药前后细胞形态变化(×100)
a:P<0.01,与MCF-7细胞组比较
表2 miRNA mimics等转染后细胞miRNA-134表达
a:P<0.01,与同组转染miRNA mimic细胞比较

表3 miRNA mimics等转染后细胞凋亡率
a:P<0.01,与同组转染miRNA-mimic细胞比较

表4 转染后细胞Bax、Caspase-3蛋白表达
a:P<0.01,与同组转染miRNA mimic细胞比较
2.4MCF-7细胞、表柔比星耐药细胞、多西他赛耐药细胞miRNA-134表达水平比较 MCF-7细胞、表柔比星耐药细胞、多西他赛耐药细胞miRNA-134表达水平分别为1.145±0.103、0.604±0.057、0.597±0.062。与MCF-7细胞系比较,表柔比星耐药细胞系、多西他赛耐药细胞系miRNA-134表达水平均明显降低(P<0.05)。
2.5miRNA mimics、miRNA inhibitor转染后各组细胞miRNA-134表达水平比较 各组转染miRNA mimic细胞miRNA-134表达明显高于未转染细胞和转染miRNA inhibitor细胞(P<0.05);未转染细胞与转染miRNA inhibitor细胞miRNA-134表达比较,差异无统计学意义(P>0.05),见表2。
2.6miRNA mimics、miRNA inhibitor转染后各组细胞凋亡水平比较 各组转染miRNA mimics细胞凋亡率明显高于未转染细胞和转染miRNA inhibitor细胞(P<0.05),未转染细胞与转染miRNA inhibitor细胞凋亡率比较,差异无统计学意义(P>0.05),见表3。
2.7miRNA mimics、miRNA inhibitor转染后各组细胞Bax、Caspase-3蛋白表达 各组转染miRNA mimics细胞Bax、Caspase-3蛋白表达水平均明显高于未转染细胞和转染miRNA inhibitor细胞(P<0.05);未转染细胞与转染miRNA inhibitor细胞Bax、Caspase-3蛋白表达水平比较,差异无统计学意义(P>0.05),见表4。
3 讨 论
WHO调查显示,近10年来乳腺癌发病率呈明显上升,且发病呈现年轻化趋势[10]。新辅助化疗是治疗局部中晚期乳腺癌的标准方案,但是并非所有乳腺癌患者均能从新辅助化疗中获益。耐药是导致化疗失败的主要原因。由于疾病的特异质和个体差异,目前依然有15%~30%的患者对化疗不敏感[11]。因此,寻找准确、方便、快捷的化疗耐药预测指标,对提高乳腺癌患者的综合疗效具有重要意义。KATANODA等[12]报道称miRNA能够通过抑制细胞周期阻滞、促进损伤DNA修复、增强细胞侵袭能力等过程参与肿瘤化疗耐药。miRNA属于独立于细胞外的RNA,可以避免血液循环酶系的降解,其水平相对稳定[13],外周血miRNA也成为理想的生物标志物。
本研究显示,化疗敏感组血清miRNA-134表达水平明显高于化疗耐药组(P<0.05)。ANDERSON等[14]报道称miRNA-134能够通过调控叉头框蛋白M1、多药耐药相关蛋白1的表达,提高肺癌细胞对铂类药物的敏感性。本研究在光镜下观察发现,加药前细胞主要以梭形为主,化疗药物诱导初期,敏感的细胞逐渐凋亡,这部分细胞形态从梭形向圆形转变;但是撤药后细胞形态逐渐恢复,提示细胞形态学改变可能与乳腺癌细胞耐药有关。另外,耐药细胞增殖能力和miRNA-134表达明显降低,说明miRNA-134可能与乳腺癌细胞增殖、分化有关。VIVEK等[15]研究也发现miRNA-134能够通过抑制细胞增殖达到抗癌作用。
本研究分别用miRNA mimic和miRNA inhibitor上调和下调乳腺癌细胞株miRNA-134表达,结果显示未转染细胞和转染miRNA inhibitor细胞miRNA-134表达比较差异无统计学意义(P>0.05),这可能是miRNA-134在乳腺癌细胞中本身即存在低表达,即使转染miRNA inhibitor,miRNA-134下降的差异依然不明显。此外,转染miRNA mimics细胞凋亡率明显升高,提示miRNA-134可以促进乳腺癌细胞发生凋亡。顾玺等[16]研究发现,用他莫昔芬诱导获得敏感的子宫内膜癌细胞株miRNA-134表达明显升高,而耐药细胞株miRNA-134表达明显降低;且miRNA-134高表达的细胞株更容易发生凋亡,说明miRNA-134的耐药机制与细胞凋亡有关。
Bax蛋白是Bcl-2家族中的促凋亡蛋白,KUMAR等[17]研究发现,Bax不仅能促进细胞自发凋亡,还能启动细胞能多种凋亡信号途径诱导细胞凋亡。Caspase-3蛋白是白细胞介素1β家族成员,在细胞凋亡中发挥关键作用[18-19]。窦越等[20]研究发现,乳腺癌化疗耐药细胞株Caspase-3蛋白表达明显降低,细胞凋亡受阻。GAO等[21]报道称Bax是Caspase-3重要的上游调控基因,上调Bax表达能够通过线粒体途径促进细胞色素C的释放,并促进下游靶基因Caspase-3的表达,起到诱导细胞凋亡的作用。本研究发现miRNA-134可能通过促进Bax、Caspase-3的表达,负调控乳腺癌化疗耐药,这也可能是乳腺癌化疗耐药逆转的一条信号路径。
综上所述,miRNA-134可能通过促进Bax、Caspase-3的表达,增强乳腺癌细胞对化疗的敏感性。
[1]WANG C,WANG X C,KIBET N K,et al.Deep sequencing of grapevine flower and berry short RNA library for discovery of novel microRNAs and validation of precise sequences of grapevine microRNAs deposited in miRBase[J].Physiol Plant,2011,143(1):64-81.
[2]FENDLER W,MALACHOWSKA B,MEGHANI K,et al.Evolutionarily conserved serum microRNAs predict radiation-induced fatality in nonhuman primates[J].Sci Transl Med,2017,9(379):2408-2409.
[3]MA C P,LIU S,SHI C.Ultrasensitive detection of microRNAs based on hairpin fluorescence probe assisted isothermal amplification[J].Biosens Bioelectron,2014,58(12):57-60.
[4]MURRAY S T,HANIGAN C L,WOSTER P M,et al.Histone deacetylase inhibition overcomes drug resistance through a miRNA-Dependent mechanism[J].Mol Cancer Ther,2013,12(10):2088-2099.
[5]POULIOT L M,SHEN D W,SUZUKI T,et al.Contributions of microRNA dysregulation to cisplatin resistance in adenocarcinoma cells[J].Exp Cell Res,2013,319(4):566-574.
[6]RONG H,LIU T B,YANG K J,et al.MicroRNA-134 plasma levels before and after treatment for bipolar mania[J].J Psychiatr Res,2011,45(1):92-95.
[7]SUN C C,LI S J,LI D J.Hsa-miR-134 suppresses non-small cell lung cancer(NSCLC) development through down-regulation of CCND1[J].Oncotarget,2016,7(24):35960-35978.
[8]BICKER S,KHUDAYBERDIEV S,WEIB K,et al.The DEAH-box helicase DHX36 mediates dendritic localization of the neuronal precursor-microRNA-134[J].Genes Dev,2013,27(9):991-996.
[9]QIN Q,WEI F R,ZHANG J B,et al.miR-134 inhibits non-small cell lung cancer growth by targeting the epidermal growth factor receptor[J].J Cell Mol Med,2016,20(10):1974-1983.
[10]SATO Y,WATANABE H,SONE M,et al.Tumor response evaluation criteria for HCC(hepatocellular carcinoma) treated using TACE(transcatheter arterial chemoembolization):RECIST(response evaluation criteria in solid tumors) version 1.1 and mRECIST(modified RECIST):JIVROSG-0602[J].Ups J Med Sci,2013,118(1):16-22.
[11]屈洪波,范原铭,韩明利,等.化疗后残存乳腺癌组织中乳腺癌耐药蛋白、P-糖蛋白的表达及其与
癌干细胞的相关性[J].中国医学科学院学报,2013,35(2):171-176.
[12]KATANODA K,YAKO-SUKETOMO H.Comparison of time trends in breast cancer mortality(1990-2006) in the world,from the WHO mortality database[J].Jpn J Clin Oncol,2010,40(2):182-183.
[13]MESLIN F,HAMAÏ A,GAO P,et al.Silencing of prion protein sensitizes breast adriamycin-resistant carcinoma cells to TRAIL-mediated cell death[J].Cancer Res,2007,67(22):10910-10919.
[14]ANDERSON D,SEIB C,TJONDRONEGORO D,et al.The women′s wellness after cancer program:a multisite,single-blinded,randomised controlled trial protocol[J].BMC Cancer,2017,17(1):98-99.
[15]VIVEK R,THANGAM R,NIPUNBABU V,et al.Multifunctional HER2-Antibody conjugated polymeric nanocarrier-Based drug delivery system for multi-drug-resistant breast cancer therapy[J].ACS Appl Mater Interfaces,2014,6(9):6469-6480.
[16]顾玺,张文海.miRNA在乳腺癌化疗耐药中的作用[J].中国肿瘤临床,2014,41(8)::538-541.
[17]KUMAR S,KEERTHANA R,PAZHANIMUTHU A,et al.Overexpression of circulating miRNA-21 and miRNA-146a in plasma samples of breast cancer patients[J].Indian J Biochem Biophys,2013,50(3):210-214.
[18]俞万钧,汪一萍,李纪鹏,等.miR-134调控人肺腺癌细胞顺铂耐药[J].中国病理生理杂志,2015,31(7):1214-1218.
[19]阳圣,张雯,杨燕青,等.胃癌组织miRNA差异表达的初步分析[J].上海交通大学学报(医学版),2010,30(11):1317-1323.
[20]窦越,唐勇.微小 RNA 在胃癌中的研究进展[J].国际肿瘤学杂志,2015,42(10):780-782.
[21]GAO Y T,LIU T,HUANG Y Y.MicroRNA-134 suppresses endometrial cancer stem cells by targeting POGLUT1 and Notch pathway proteins[J].FEBS Lett,2015,589(2):207-214.

