膀胱癌组织GPR48基因的表达及其临床意义
季德才,郝斌,姜利宁,董永良
(沧州市中心医院,河北沧州061000)
信号转导是维持细胞内环境稳定、协调细胞活动的重要过程,细胞表面的膜受体在其中发挥关键作用[1]。G蛋白偶联受体具有7个跨膜结构,是最大的膜蛋白家族,能够与多种膜信号分子相结合[2],广泛参与多种生理和病理过程,如视觉、行为和情绪调控、免疫反应[3]、内环境稳定性调节以及肿瘤的发生发展等[4]。G蛋白偶联受体主要分为A型(视紫红质)、B型(分泌素受体家族)和C型(代谢型谷氨酸),GPR48又称LGR48,属于G蛋白偶联受体超家族的A10亚型,其N端含有17个亮氨酸组成的重复序列,位于其激素结合区域。GPR48在肾[5]、毛囊[6]等组织器官发育中有重要作用;GPR48缺陷可导致胚胎死亡或胚胎发育障碍[7]。目前GPR48在组织器官发育中的功能已经明确,但GPR48在肿瘤发生发展中的作用所知甚少。本研究观察了膀胱癌组织GPR48基因表达变化,现分析其在膀胱癌发生发展中的作用。
1 资料与方法
1.1 临床资料 选择2008年6月~2012年6月我院收治的膀胱癌患者83例。纳入标准:①术前未进行放化疗;②术后经病理诊断证实为膀胱癌;③有术中切除的膀胱癌组织标本和癌旁组织标本保存;④有完整的病历资料。排除标准:①合并肝肾疾病、其他肿瘤;②合并免疫系统疾病;③合并严重的心脑血管疾病;④合并感染性疾病。其中男62例、女21例;患者年龄24~76(56.29±18.16)岁,<60岁者27例,≥60岁者56例;肿瘤直径>5 cm者49例,≤5 cm者34例;分化程度低分化53例,中高分化30例;有淋巴转移39例,无淋巴转移44例;有远处转移53例,无远处转移30例;临床分期Ⅰ期61例,Ⅱ~Ⅳ期22例。本研究已获得医院医学伦理委员会审核同意,患者均签署知情同意书。
1.2 膀胱癌组织和癌旁组织GPR48 mRNA检测 采用实时荧光定量PCR法。先用TRIzol法提取组织或者细胞总RNA,按照RNA提取试剂盒的说明书操作。紫外分光光度计检测总RNA浓度及纯度,逆转录试剂盒进行逆转录,cDNA产物置于-20 ℃保存备用。实时荧光定量PCR引物序列:GPR48正向引物5′-TGTTTCAACCTTTTAAAGACTGTAGC-3′,反向引物5′-TAAAGGACTTAATGCCAAATGTGAT-3′;内参GAPDH正向引物5′-ACAACTTTGGTATCGTGGAAGG-3′,反向引物5′-GCCATCACGCCACAGTTTC-3′。PCR扩增体系为10 μL。反应条件:50 ℃预热2 min,95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火1 min,72 ℃延伸55 s,进行35个循环。采用2-ΔΔCt表示GPR48 mRNA相对表达量。重复3次,结果取平均值。
1.3 膀胱癌组织和癌旁组织GPR48蛋白检测 采用免疫组织化学法。膀胱癌组织和癌旁组织样本经4%中性甲醛固定,石蜡包埋,5 μm厚切片;二甲苯脱蜡,100%、95%、85%的酒精浸泡水化,在98 ℃的枸橼酸钠溶液(0.01 mol/L,pH值6.0)中浸泡15 min进行抗原修复。为了降低内源性过氧化物酶造成的非特异性背景染色,将切片放在Hydrogen Peroxide Block中孵育10~15min。滴加正常山羊血清室温封闭20 min,弃去血清,滴加GPR48一抗工作液(稀释比1∶150),37 ℃孵育2 h,PBS洗涤3次,每次5 min,滴加生物素二抗(稀释比1∶200),室温孵育30 min,PBS洗涤3次,每次5 min,DAB显色,充分冲洗后,苏木素复染,常规脱水,透明,干燥,封片。以PBS替代一抗作阴性对照,已知阳性切片作阳性对照。随机选取10个含有阳性细胞的200倍视野进行观察。按阳性细胞比例评分:无阳性细胞为0分,≤25%为1分,>25%~≤50%为2分,>50%为3分;按染色程度评分:无阳性着色为0分,浅黄色为1分,深黄色为2分,棕黄色为3分。两项得分之和为最终得分。癌组织最终得分高于癌旁组织为GPR48高表达,否则为低表达。

2 结果
2.1 膀胱癌组织、癌旁组织GPR48 mRNA相对表达量比较 膀胱癌组织、癌旁组织GPR48 mRNA相对表达量分别为4.68±2.24、1.12±0.31,P<0.05。
2.2 膀胱癌组织GPR48 mRNA相对表达量与患者临床病理参数的关系 GPR48 mRNA相对表达量与膀胱癌患者的年龄、有无淋巴结转移、有无远处转移和临床分期有关(P均<0.05),而与患者的性别、肿瘤直径和分化程度无关(P均>0.05)。见表1。
2.3 膀胱癌组织GPR48蛋白表达情况及其与患者预后的关系 免疫组化结果显示,患者中GPR48蛋白高表达者71例,低表达12例。手术后随访1~60个月,癌组织GPR48蛋白高、低表达者的生存曲线见图1。Log-Rank检验结果显示, GPR48蛋白低、高表达者术后5年总生存率分别为91.67%、57.75%,生存时间分别为(56.00±3.83)、(47.97±2.07)个月,P均<0.05。

表1 膀胱癌组织GPR48 mRNA相对表达量与患者临床病理参数的关系
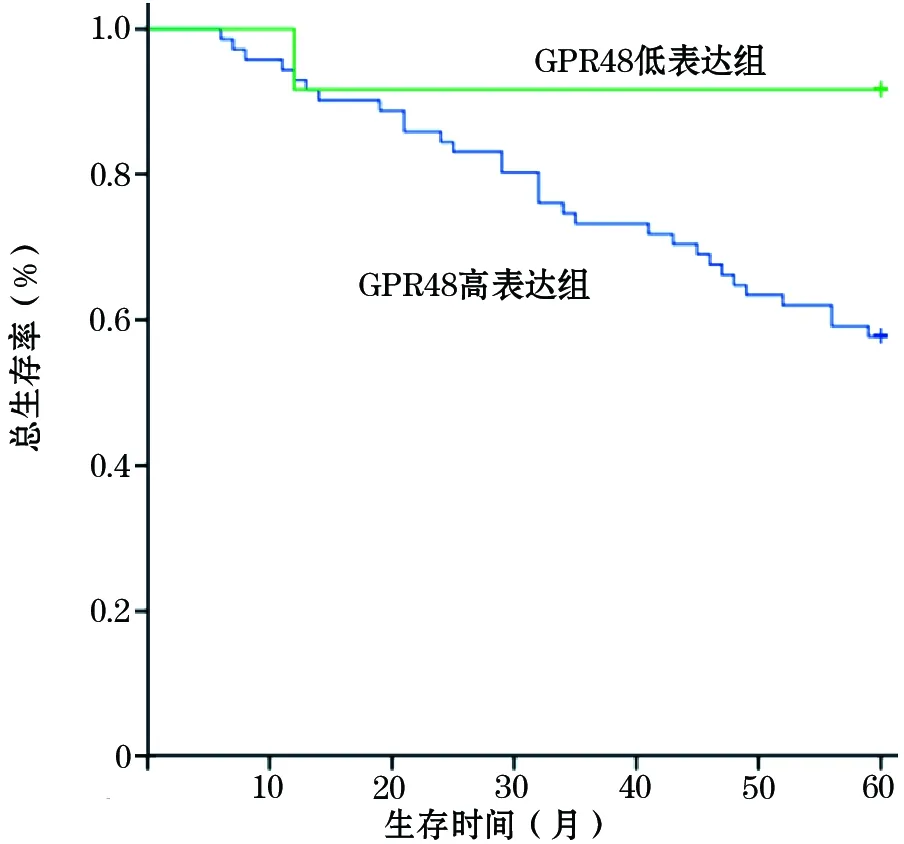
图1 膀胱癌组织GPR48蛋白高、低表达患者的生存曲线
3 结论
GPR48蛋白含有3个主要的功能结构域,即胞外的N端,胞内的C端以及7跨膜结构域。GPR48是胚胎发育的关键调节因子,参与维持细胞微环境稳定[8]、促进内胚层发育[9]等。GPR48在机体的多种组织器官发育中也发挥作用,如调控胚胎肝脏发育[10]、促进性腺发育[11]、调节昼夜节律[12]、参与骨骼肌的葡萄糖和脂质代谢[13]等。GPR48还是骨形成和骨吸收过程的关键调节因子[14],如在小鼠模型中,敲除GPR48基因后,导致成骨细胞分化和矿化过程被显著抑制,GPR48通过cAMP-PKA-Atf4信号通路,调节骨形成和骨重塑过程[15]。在成骨细胞中,骨形态发生蛋白(BMP)促进GPR48基因表达[16]。GPR48异常表达与多种疾病相关,如GPR48失活导致先天性AGR综合征[17]。GPR48在肿瘤的发生和恶性进展中也发挥作用;GPR48基因突变使得发生皮肤和胆道扁平细胞癌的风险增加[18];GRP48通过调节Jmjd2a/AR细胞通路促进前列腺癌的形成[19]等。Xu等[20]在对皮肤癌形成机制的研究中发现,GPR48可通过调节MEK/ERK和Wnt/β-catenin信号通路活性促进肿瘤形成,本研究结果显示,膀胱癌组织GPR48 mRNA和蛋白表达高于癌旁组织,提示GPR48高表达可能参与并促进了膀胱癌的肿瘤形成,GPR48在肿瘤形成过程中可能发挥促癌基因的作用。本研究结果还显示,GPR48在膀胱癌患者癌组织中的表达水平与患者的年龄、淋巴结转移、远处转移和临床分期有关,提示GPR48高表达可促进膀胱癌病情的进展。
Luo等[21]对前列腺癌细胞小鼠移植瘤进行研究发现,沉默GRP48基因后,小鼠的存活率显著增加,且肺转移的发生率也明显下降;GPR48能够促进肺癌细胞的侵袭,敲除GPR48基因后,细胞增殖和侵袭能力均减弱[22];GPR48基因沉默后,人宫颈癌细胞的侵袭和迁移能力均被抑制[23]。以上研究结果提示,GPR48高表达可增强肿瘤细胞的侵袭能力。本研究结果显示,GPR48高表达者术后总生存率低于、生存时间短于GPR48低表达者,提示GPR48可作为判断膀胱癌患者不良预后的指标,与Wu等[24]在结肠癌中关于GPR48的研究结果一致。
综上所述,GPR48在结直肠癌的发生发展中起促癌基因作用。膀胱癌组织GPR48 mRNA表达情况有助于判断患者病情及预后。本研究的不足为样本数量较小。
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015,65(2):87-108.
[2] Venkatakrishnan AJ, Deupi X, Lebon G, et al. Molecular signatures of G-protein-coupled receptors[J]. Nature, 2013,494(7436):185-194.
[3] Du B, Luo W, Li R, et al. Lgr4/Gpr48 negatively regulates TLR2/4-associated pattern recognition and innate immunity by targeting CD14 expression[J]. J Biol Chem, 2013,288(21):15131-15141.
[4] Lin HH. Adhesion family of G protein-coupled receptors and cancer[J]. Chang Gung Med J, 2012,35(1):15-27.
[5] Mohri Y, Oyama K, Sone M, et al. LGR4 is required for the cell survival of the peripheral mesenchyme at the embryonic stages of nephrogenesis[J]. Biosci Biotechnol Biochem, 2012,76(5):888-891.
[6] Mohri Y, Kato S, Umezawa A, et al. Impaired hair placode formation with reduced expression of hair follicle-related genes in mice lacking Lgr4[J]. Dev Dyn, 2008,237(8):2235-2242.
[7] Mazerbourg S, Bouley DM, Sudo S, et al. Leucine-rich repeat-containing, G protein-coupled receptor 4 null mice exhibit intrauterine growth retardation associated with embryonic and perinatal lethality[J]. Mol Endocrinol, 2004,18(9):2241-2254.
[8] Snyder JC, Rochelle LK, Marion S, et al. Lgr4 and Lgr5 drive the formation of long actin-rich cytoneme-like membrane protrusions[J]. J Cell Sci, 2015,128(6):1230-1240.
[9] Tsai YH, Hill DR, Kumar N, et al. LGR4 and LGR5 Function Redundantly During Human Endoderm Differentiation[J]. Cell Mol Gastroenterol Hepatol, 2016,2(5):648-662.e8.
[10] Planas-Paz L, Orsini V, Boulter L, et al. The RSPO-LGR4/5-ZNRF3/RNF43 module controls liver zonation and size[J]. Nat Cell Biol, 2016,18(5):467-479.
[11] Koizumi M, Oyama K, Yamakami Y, et al. Lgr4 controls specialization of female gonads in mice[J]. Biol Reprod, 2015,93(4):90.
[12] Wang F, Zhang X, Wang J, et al. LGR4 acts as a link between the peripheral circadian clock and lipid metabolism in liver[J]. J Mol Endocrinol, 2014,52(2):133-143.
[13] Sun Y, Hong J, Chen M, et al. Ablation of Lgr4 enhances energy adaptation in skeletal muscle via activation of Ampk/Sirt1/Pgc1α pathway[J].Biochem Biophys Res Commun,2015,464(2):396-400.
[14] Jin Y, Yang Y. LGR4: A new receptor for a stronger bone[J]. Sci China Life Sci, 2016,59(7):735-736.
[15] Luo J, Zhou W, Zhou X, et al. Regulation of bone formation and remodeling by G-protein-coupled receptor 48[J]. Development, 2009,136(16):2747-2756.
[16] Pawaputanon NMC, Ezura Y, Kawasaki M, et al. BMP-2 Enhances Lgr4 Gene Expression in Osteoblastic Cells[J]. J Cell Physiol, 2016,231(4):887-895.
[17] Yi T, Weng J, Siwko S, et al. LGR4/GPR48 inactivation leads to aniridia-genitourinary anomalies-mental retardation syndrome defects[J]. J Biol Chem, 2014,289(13):8767-8780.
[18] Styrkarsdottir U, Thorleifsson G, Sulem P, et al. Nonsense mutation in the LGR4 gene is associated with several human diseases and other traits[J]. Nature, 2013,497(7450):517-520.
[19] Zhang J, Li Q, Zhang S, et al. Lgr4 promotes prostate tumorigenesis through the Jmjd2a/AR signaling pathway[J]. Exp Cell Res, 2016,349(1):77-84.
[20] Xu P, Dang Y, Wang L, et al. Lgr4 is crucial for skin carcinogenesis by regulating MEK/ERK and Wnt/β-catenin signaling pathways[J]. Cancer Lett, 2016,383(2):161-170.
[21] Luo W, Tan P, Rodriguez M, et al. Leucine-rich repeat-containing G protein-coupled receptor 4 (Lgr4) is necessary for prostate cancer metastasis via epithelial-mesenchymal transition[J]. J Biol Chem, 2017,292(37):15525-15537.
[22] Gong X, Yi J, Carmon KS, et al. Aberrant RSPO3-LGR4 signaling in Keap1-deficient lung adenocarcinomas promotes tumor aggressiveness[J]. Oncogene, 2015,34(36):4692-4701.
[23] Gao Y, Shan ZY, Wang H, et al. Inhibitory effect of shRNA targeting GPR48 on invasion and metastasis of human cervical carcinoma cell line HeLa[J]. Ai Zheng, 2009,28(2):104-107.
[24] Wu J, Xie N, Xie K, et al. GPR48, a poor prognostic factor, promotes tumor metastasis and activates β-catenin/TCF signaling in colorectal cancer[J].Carcinogenesis,2013,34(12):2861-2869.

