长链非编码RNA H19对胃癌细胞侵袭、迁移的影响及其机制
吴小飞,康海锋,陈赛赛,赵程进
(1 南通市第一人民医院,江苏南通226001;2 南通大学附属医院)
人类基因组计划表明,哺乳动物基因组中,仅有1.2%基因能够编码蛋白质,且大多数基因转录产物为非编码RNA[1~3],长链非编码RNA(lncRNAs)是一类长度大于200个核苷酸的非编码RNA[4],已证实其在肿瘤形成和侵袭过程中发挥作用。最近的研究证实lncRNA H19在乳腺癌[5]和宫颈癌[6]等多种肿瘤组织中表达增加。H19表达与肿瘤分级密切相关,且可以作为膀胱癌复发早期的诊断靶分子[7];H19异常表达能够促进肝癌细胞的体外肿瘤形成能力[8]。以上研究结果均提示H19可能具有促癌基因的功能,但其与胃癌的关系尚不明确。2017年2~8月,本研究观察了上调、下调胃癌细胞H19表达对胃癌细胞侵袭、迁移能力的影响,现分析结果并探讨其作用机制。
1 材料与方法
1.1 材料 人胃癌细胞株MKN28、BGC-823(中国科学院上海细胞库);RPMI 1640培养基和FBS(美国Gibco公司);TRIzol试剂和脂质体Lipofectamine®3000(美国Invitrogen公司),RNA提取试剂盒和逆转录试剂盒(北京宝日医生物技术有限公司),实时荧光定量 PCR引物、全长H19 cDNA、突变H19 cDNA(不含第一个内含子)、H19 siRNA 和siRNA无关序列(上海吉玛制药技术有限公司),Matrigel基质胶(美国BD公司),结晶紫溶液(百灵威科技有限公司),EZ-Magna RIP Kit试剂盒(美国Millpore公司),RIPA蛋白裂解液和BCA蛋白定量试剂盒(上海碧云天生物技术有限公司),COL4A1(ab21295)、CPT1C(ab87498)、ISM1(ab103338)、THBS4(ab121094)和GAPDH(ab9485)抗体(美国Abcam公司),HRP标记的鼠抗兔二抗(上海恒远生物科技有限公司)。二氧化碳培养箱(240i/150i,美国Thermo公司),NanoDrop分光光度计(ND-2000,美国Thermo公司),定量PCR扩增仪(ABI7500,美国ABI公司),Transwell小室(美国Corning公司),酶标仪(ELx800,美国Bio-Tek公司),凝胶成像仪(GelDoc XR,美国Bio-Rad)。
1.2 细胞分组及转染 将MKN28、BGC-823细胞分别置于含RPMI 1640培养基(含10% FBS)的培养箱中,37 ℃、5% CO2条件下培养,取复苏后第4~10代细胞进行试验。①上调H19表达:取对数生长期MKN28细胞,接种于培养皿中,24 h后将细胞分为MKN28/H19组、MKN28/H19mut组和空白对照1组,每组5孔,每孔约1×105个。空白对照组不转染;MKN28/H19组、MKN28/H19mut组采用脂质体法分别转染全长H19 cDNA和突变H19 cDNA(不含第一个内含子);按步骤参照试剂盒说明书操作。转染12 h。②下调H19表达:取对数生长期BGC-823细胞,接种于培养皿中,24 h后将细胞分为BGC-823/siH19组、BGC-823/NC组和空白对照2组,每组5孔,每孔约1×105个。空白对照组不转染。BGC-823/siH19组、BGC-823/NC组采用脂质体法将分别转染H19 siRNA(5′-CATCAAAGACACCATCGGA-3′)及H19 siRNA无关序列,试剂盒说明书操作。转染12 h。
1.3 相关指标观察
1.3.1 H19表达 TRIzol法提取上述组织样本和细胞中总RNA,提取步骤参照RNA提取试剂盒的说明书。NanoDrop分光光度计检测总RNA浓度及纯度(OD260/OD280比值),逆转录试剂盒逆转录获得cDNA,置于-20 ℃保存备用。采用实时荧光定量PCR法检测各组H19相对表达量。H19正向引物5′-GTCCGGCCTTCCTGAACACCTT-3′,H19反向引物5′-GCTTCACCTTCCAGAGCCGAT-3′;内参β-actin正向引物 5′-TTGATTTTGGAGGGATCTCGCTC-3′,β-actin反向引物 5′-GAGTCAACGGATTTGGTCGTATTG-3′。反应体系为10 μL,反应条件:50 ℃ 2 min,95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,共进行35个循环。采用2-ΔΔCt法计算H19相对表达量。实验重复3次,取平均值。
1.3.2 细胞侵袭能力 采用Transwell细胞侵袭试验。Transwell小室放置于24孔板中,加入50 μL Matrigel基质胶(250 μg/mL),37 ℃、5% CO2培养箱中过夜,对上室的聚碳酯膜进行包被。在Transwell小室的下室中加入500 μL含10% FBS的RPMI 1640。用无血清的RPMI 1640培养液重悬各组细胞,取100 μL细胞悬液(细胞总数约1×105个)转移至Transwell小室的上室。24 h后去除下室中的培养液,Transwell小室置于甲醛中固定5 min,棉签擦去Transwell小室内室膜上的细胞,结晶紫溶液(0.1%)染色5 min,双蒸水漂洗后,显微镜下观察,每孔随机选取3个视野拍照。每个Transwell小室的上室中加入100 μL RIPA细胞裂解液,收集裂解液后,酶标仪检测570 nm处的吸光度(OD570)值并记录,以其表示各组细胞的侵袭能力。实验重复3次,取平均值。
1.3.3 细胞迁移能力 采用Transwell细胞迁移试验。除不加基质胶外,其余同1.3.2,以OD570值表示各组细胞迁移能力。
1.3.4 H19共结合蛋白CPT1C表达 检索Gene Ontology (GO)和Kyoto Encyclopedia of Genes and Genomes (KEGG) 数据库,构建H19共表达网络,Bonferroni多重校正后筛选出可能与H19共表达的候选蛋白有COL4A1、CPT1C、ISM1和THBS4。在BGC-823细胞中采用RIP-PCR法进行验证结果显示CPT1C蛋白是H19的共结合蛋白。采用Western blotting法检测各组CPT1C蛋白。收集各组约1×107个细胞,加入RIPA蛋白裂解液,提取细胞总蛋白,BCA蛋白定量试剂盒检测蛋白浓度。8% SDS-PAGE分离蛋白后,湿转法将蛋白转到PVDF膜上,5%脱脂奶粉室温震荡封闭1 h,TBS-T洗膜,分别加入CPT1C和内参GAPDH抗体,4 ℃孵育过夜。TBS-T洗膜后,加入HRP标记的鼠抗兔二抗,室温孵育1 h,加ECL发光液进行化学发光显影,凝胶成像仪对蛋白条带进行观察,获取图像,采用Image Lab软件对图像进行灰度分析,记录灰度值,用CPT1C蛋白与内参蛋白灰度值的比值表示CPT1C相对表达量。实验重复3次,取平均值。

2 结果
2.1 上调H19表达对胃癌MKN28细胞侵袭、迁移能力及CPT1C蛋白表达的影响 转染12 h时MKN28/H19组、MKN28/H19mut组、空白对照1组H19相对表达量、侵袭能力、T迁移能力、CPT1C相对表达量见表1。转染12 h时MKN28/H19组H19相对表达量、侵袭能力、迁移能力、CPT1C相对表达量均高于MKN28/H19mut组、空白对照1组(P均<0.05),MKN28/H19mut组上述指标与空白对照1组相比,P均>0.05。
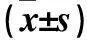
表1 转染12 h三组MKN28细胞H19相对表达量、侵袭能力、迁移能力、CPT1C相对表达量比较
注:与MKN28/H19mut组、空白对照1组比较,*P<0.05。
2.2 下调H19表达对胃癌BGC-823细胞侵袭、迁移能力及CPT1C蛋白表达的影响 转染12 h时BGC-823/siH19组、BGC-823/NC组、空白对照2组BGC-823细胞H19相对表达量、侵袭能力、迁移能力、CPT1C相对表达量见表2。转染12 h时BGC-823/siH19组H19相对表达量、侵袭能力、迁移能力、CPT1C相对表达量均低于BGC-823/NC组、空白对照2组(P均<0.05),BGC-823/NC组上述指标与空白对照2组相比,P均>0.05。

表2 转染12 h三组BGC-823细胞H19相对表达量、侵袭能力、迁移能力、CPT1C相对表达量比较
注:与BGC-823/NC组、空白对照2组比较,*P<0.05。
3 讨论
目前关于胃癌细胞发生侵袭和迁移的内在作用机制尚不明确,临床亦缺乏转移性胃癌的有效干预手段。本研究的主要目的是寻找与胃癌侵袭和迁移相关的lncRNAs。
lncRNAs可通过多种机制调控基因表达。大量研究证据表明,lncRNAs异常表达是导致肿瘤发生、发展的一个重要因素,如lncRNAs可通过调节促癌基因或者抑癌基因信号通路,参与肿瘤形成、恶性进展和侵袭过程[9~12]。H19在肝癌[8]、头颈部扁平细胞癌[13]等多种肿瘤组织中表达升高,且其高表达常常与肿瘤患者的不良预后相关。H19在多种胃肠道肿瘤形成和恶性进展中发挥作用,如在结直肠癌中,lncRNA H19可促进细胞上皮间质转化(EMT)过程[14];在食管癌中,H19表达增加可促进细胞侵袭,并诱导EMT[15]。Chen等[16]认为,lncRNA H19可作为胃癌诊断的分子标志物,其高表达提示患者预后不良。本研究结果显示,采用脂质体转染技术上调H19表达可提高胃癌细胞的侵袭和迁移能力,而抑制H19表达可抑制胃癌细胞的侵袭和迁移能力。提示H19与胃癌细胞发生侵袭和迁移有关。其原因是H19可调节HMGA1基因[17]、EZH2基因[18]等侵袭、迁移相关基因表达。也有研究表明,H19可促进胃癌细胞增殖[19,20],本研究并未对此结论进行验证。
lncRNAs调节基因转录的机制非常复杂。本研究对 H19促进胃癌细胞侵袭和迁移的内在机制进行了初步探究。H19可通过与特定蛋白或者microRNAs相互作用,直接或者间接调节靶基因表达[21]。本研究中生物信息学分析结合RIP-PCR验证结果表明CPT1C可能是H19共表达蛋白,进一步采用Western blotting法检测各组细胞CPT1C表达,发现改变H19表达后,细胞中CPT1C蛋白表达也随之改变,其趋势与H19变化一致,进一步证实上述结论。CPT1C是脂肪酸氧化代谢限速酶CPT1家族的重要成员,在脂肪酸代谢和糖分解中的发挥着重要作用。目前,关于CPT1C在肿瘤中的研究甚少,有研究发现CPT1C高表达可能与肿瘤细胞化疗耐药有关,而在乳头状甲状腺癌中AMPK可调节CPT1C基因表达,从而促进肿瘤细胞存活[22]。
综上所述,H19能增强胃癌细胞的侵袭和迁移能力,其机制可能为调节CPT1C蛋白表达。今后的研究中我们将对H19/CPT1C在胃癌细胞侵袭和迁移过程中的具体调节机制进行探讨。
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015,65(2):87-108.
[2] Birney E, Stamatoyannopoulos JA, Dutta A, et al. Identification and analysis of functional elements in 1% of the human genome by the ENCODE pilot project[J]. Nature, 2007,447(7146):799-816.
[3] Carninci P, Kasukawa T, Katayama S, et al. The transcriptional landscape of the mammalian genome[J]. Science, 2005,309(5740):1559-1563.
[4] Furuno M, Pang KC, Ninomiya N, et al. Clusters of internally primed transcripts reveal novel long noncoding RNAs[J]. PLoS Genet, 2006,2(4):37.
[5] Vennin C, Spruyt N, Dahmani F, et al. H19 non coding RNA-derived miR-675 enhances tumorigenesis and metastasis of breast cancer cells by downregulating c-Cbl and Cbl-b[J]. Oncotarget, 2015,6(30):29209-29223.
[6] Iempridee T. Long non-coding RNA H19 enhances cell proliferation and anchorage-independent growth of cervical cancer cell lines[J]. Exp Biol Med (Maywood), 2017,242(2):184-193.
[7] Luo M, Li Z, Wang W, et al. Upregulated H19 contributes to bladder cancer cell proliferation by regulating ID2 expression[J]. FEBS J, 2013,280(7):1709-1716.
[8] Zhang L, Yang F, Yuan JH, et al. Epigenetic activation of the MiR-200 family contributes to H19-mediated metastasis suppression in hepatocellular carcinoma[J]. Carcinogenesis, 2013,34(3):577-586.
[9] Ferro A, Peleteiro B, Malvezzi M, et al. Worldwide trends in gastric cancer mortality (1980-2011), with predictions to 2015, and incidence by subtype[J]. Eur J Cancer, 2014,50(7):1330-1344.
[10] Inoue M, Otsuka K, Shibata H. Circulating tumor cell count as a biomarker of a specific gastric cancer subgroup characterized by bone metastasis and/or disseminated intravascular coagulation-an early indicator of chemotherapeutic response[J]. Oncol Lett, 2016,11(2):1294-1298.
[11] Umemura A, Koeda K, Fujiwara H, et al. Totally laparoscopic total gastrectomy for gastric cancer at a single institutional experience and changes in technique of esophagojejunostomy[J]. Indian J Surg, 2016,78(3):249-253.
[12] van Werven FJ, Neuert G, Hendrick N, et al. Transcription of two long noncoding RNAs mediates mating-type control of gametogenesis in budding yeast[J]. Cell, 2012,150(6):1170-1181.
[13] Guan GF, Zhang DJ, Wen LJ, et al. Overexpression of lncRNA H19/miR-675 promotes tumorigenesis in head and neck squamous cell carcinoma[J]. Int J Med Sci, 2016,13(12):914-922.
[14] Liang WC, Fu WM, Wong CW, et al. The lncRNA H19 promotes epithelial to mesenchymal transition by functioning as miRNA sponges in colorectal cancer[J]. Oncotarget, 2015,6(26):22513-22525.
[15] Huang C, Cao L, Qiu L, et al. Upregulation of H19 promotes invasion and induces epithelial-to-mesenchymal transition in esophageal cancer[J]. Oncol Lett, 2015,10(1):291-296.
[16] Chen JS, Wang YF, Zhang XQ, et al. H19 serves as a diagnostic biomarker and up-regulation of H19 expression contributes to poor prognosis in patients with gastric cancer[J]. Neoplasma, 2016,63(2):223-230.
[17] Zhang EB, Han L, Yin DD, et al. c-Myc-induced, long, noncoding H19 affects cell proliferation and predicts a poor prognosis in patients with gastric cancer[J]. Med Oncol, 2014,31(5):914.
[18] Yang F, Bi J, Xue X, et al. Up-regulated long non-coding RNA H19 contributes to proliferation of gastric cancer cells[J]. FEBS J, 2012,279(17):3159-3165.
[19] Yang Q, Wang X, Tang C, et al. H19 promotes the migration and invasion of colon cancer by sponging miR-138 to upregulate the expression of HMGA1[J]. Int J Oncol, 2017,50(5):1801-1809.
[20] Li X, Lin Y, Yang X, et al. Long noncoding RNA H19 regulates EZH2 expression by interacting with miR-630 and promotes cell invasion in nasopharyngeal carcinoma[J]. Biochem Biophys Res Commun, 2016,473(4):913-919.
[21] Tsang WP, Kwok TT. Riboregulator H19 induction of MDR1-associated drug resistance in human hepatocellular carcinoma cells[J]. Oncogene, 2007,26(33):4877-4881.
[22] Wang R, Cheng Y, Su D, et al. Cpt1c regulated by AMPK promotes papillary thyroid carcinomas cells survival under metabolic stress conditions[J]. J Cancer, 2017,8(18):3675-3681.

