模拟手机电磁辐射系统对SD大鼠耳蜗边缘细胞影响的研究*
张应龙,左汶奇
(重庆医科大学附属永川医院耳鼻喉科,重庆 402160)
电磁辐射是继空气、水、食品污染后的第4大污染物。随着社会的进步,电子产品的使用大量增加,如微波炉、电脑、电磁炉等,人们暴露于电磁场的概率也随之增高。手机是现代社会交流传递信息必不可少的工具,人们常常随身携带。900、1 800 MHz是常用的两种手机频率,手机的辐射强度在每个国家有不同的规定,比如欧洲和美国标准是小于1.6 w/kg,但4 w/kg常被用来了解手机辐射的热效应[1]。关于手机对人体的影响,目前有学者发现手机电磁辐射可以导致精子活力的下降、神经元细胞的数量及活力的降低,同时手机电磁辐射与神经胶质瘤和听神经瘤发病有相关性[2-4]。但有研究发现电磁辐射并不会引起明显的生物学效应,原因为电磁辐射不同于电离辐射,其能量低于电离辐射,电磁辐射对各器官的影响仍是目前研究的热点[5]。双耳是手机辐射的直接效应器官,有研究发现幼鼠暴露于900 MHz手机电磁辐射装置下,尽管听力没有改变,但耳蜗超微结构有改变[6];有离体研究发现耳蜗螺旋神经节细胞在经过脂多糖处理后暴露于1 800 MHz、4 w/kg强度下,细胞有自噬小体生成,自噬蛋白LC3-Ⅱ和beclin1有阳性表达,证实细胞超微结构有改变[7];还有研究报道小鼠耳蜗毛细胞HEI-OC1暴露于1 760 MHz电磁辐射系统下,细胞周期、蛋白表达及DNA等均未见明显异常[8]。活性氧簇(ROS)系统的激活被认为是电磁辐射产生生物学效应的主要机制[9],而耳蜗边缘细胞对维持内耳生理具有重要作用。因此,本课题组选择耳蜗边缘细胞作为模拟电磁辐射研究的效应细胞,探讨1 800 MHz辐射频率、辐射强度比吸收率(SAR)在2、4 w/kg模式下,边缘细胞DAN的损伤、细胞凋亡情况及其可能的机制。
1 材料与方法
1.1材料来源 0~3 d SD大鼠的乳鼠(由重庆医科大学动物中心提供),体质量约为5 g,雌雄不限。所有动物均按照标准化流程饲养,并得到重庆医科大学伦理委员会的批准。
1.2边缘细胞原代培养及鉴定 SD大鼠乳鼠通过乙醚麻醉后,75%乙醇的容器浸泡10 min,充分消毒断头;在解剖显微镜下用显微镊去除颞骨听泡骨壳后,用显微镊分离出耳蜗外侧壁的基底回,将血管纹组织完全剥离,0.1%Ⅱ型胶原酶溶解,置于37 ℃孵箱中30 min;取出后离心,弃上清液,用1 mL MEM基础培养液与之轻轻吹打混匀后,将细胞悬液置入无菌6孔培养板,细胞在37 ℃、95%O2、5%CO2孵箱中培养24 h后可贴壁,倒置显微镜下可以观察到边缘细胞的典型形态。由于成纤维细胞贴壁较慢,隔天可用无菌磷酸盐缓冲液(PBS)轻轻冲洗培养板底部能纯化边缘细胞。将纯化后细胞悬液接种于盛有用多聚赖氨酸包被后的盖玻片无菌6孔板,当细胞单层生长至盖玻片的80%时,用免疫荧光染色方法检测细胞角蛋白18(CK18)在该细胞中的表达。弃培养基,PBS清洗,4%多聚甲醛固定,0.3% Triton X-100穿透,5% 牛血清清蛋白(BSA)封闭,100 μL一抗(1∶50 稀释)4 ℃孵育过夜;加入100 μL二抗(1∶100),避光,孵箱中孵育30 min;DAPI工作液染色,抗荧光淬灭剂封片。
1.31 800 MHz辐射系统 该系统由4部分组成:高频电磁发生器和频带放大器(购自北京博伦锐科技公司)、计算机、放置于培养箱内的两个矩形电磁波导台(放置35 mm细胞培养皿)。暴露程序所有数据均由计算机控制。可以随机设置一个波导台为暴露组,另一个波导台自动成为屏蔽组;也可以手动设置暴露组。
1.4细胞暴露程序及分组 细胞暴露于1 800 MHz辐射系统下,SAR值选择2、4 w/kg,时间是24 h,模式是开5 min,关10 min的手机通话模式。细胞分组:(1)对照组;(2)2 w/kg暴露组和屏蔽组;(3)4 w/kg暴露组和屏蔽组;(4)双氧水阳性对照组。
1.5彗星实验检测细胞DNA损伤 彗星实验是公认的检测单个细胞核损伤的技术,具有较高的特异度和灵敏度[10],具体方法是弃去培养基,PBS清洗,胰酶消化,离心弃上清液。PBS重悬,细胞计数105/mL。彗星试剂盒(购自美国Trebigen公司),低熔点琼脂糖100 ℃融化后60 ℃水浴箱中备用。吸取10 μL细胞悬液加入60 μL琼脂糖中反复吹打混匀,吸取含细胞悬液的琼脂糖10 μL铺板后在暗盒内4 ℃冷却30 min待胶凝固。将载玻片放置于4 ℃裂解液中裂解2 h,避光。将载玻片放置于电泳槽中,设置电压25 V/300 mA,时间30 min。载玻片取出后蒸馏水清洗,75%、95%无水乙醇中分别脱水。载玻片4 ℃中干燥30 min。SYBR®Green 染色15 min。荧光显微镜拍照。CASP软件分析。正常细胞无拖尾现象,而受损细胞的DNA表现为像彗星一样的拖尾,细胞的头部基本维持在原来的位置,尾部是损伤后从细胞核迁移的DNA片段,观察DNA损伤的3个参数:尾部DNA水平、尾力距和尾长。
1.6流式细胞技术检测电磁辐射对边缘细胞凋亡水平的影响 将各组细胞分别重悬于200 μL 1×结合缓冲液中,控制细胞浓度在106~107个/毫升,并分别移入流式管中;每管加入5 μL的annexin V-FITC和10 μL的PI;避光,冰上孵育15 min;流式细胞仪上读取每组10 000个细胞的凋亡率,计算出平均值。
1.7荧光酶标仪检测ROS的生成 以双氧水为阳性对照。按照1∶1 000用无血清的DMEM/F12培养基稀释DCFH-DA终浓度10 μmol/L。收集细胞后装载探针。去除细胞培养液加入50 μL稀释好DCFH-DA,37 ℃培养箱内培养20 min,以无血清培养基洗涤3次,每次5 min;收集细胞,在荧光酶标仪中观察细胞荧光值。激发波长使用488 nm,发射波长使用525 nm。

2 结 果
2.1边缘细胞原代培养及鉴定 倒置相差显微镜下观察原代培养的大鼠边缘细胞。未纯化前的边缘细胞与长梭形的成纤维细胞一起贴壁生长,边缘细胞大小不一,呈多角形,细胞间境界清楚,颜色较暗。数个细胞生长融合成单层时即呈典型的“铺路石”特征。当细胞堆积成多层时可形成“dome”结构。应用免疫荧光技术检测边缘细胞内CK-18的表达,可见CK-18在边缘细胞的细胞质内高表达,呈绿色荧光。
2.2彗星实验 随机选择200个细胞作为结果分析,细胞拍摄时一般选择200倍。分析软件采用CASP Lab。双氧水作为阳性对照,细胞有明显的拖尾现象,结果显示手机电磁辐射能量不足以引起边缘细胞DNA的损伤。DNA损伤的3个参数与阳性对照组比较,差异无统计学意义(P>0.05)。见表1。
2.3流式细胞技术检测电磁辐射对边缘细胞凋亡的影响 流式细胞检测结果显示双氧水阳性对照组边缘细胞凋亡率与对照组相比显著升高,差异有统计学意义(P<0.05);其余各组同对照组边缘细胞相比,凋亡细胞无明显变化(P>0.05),说明电磁辐射不会引起边缘细胞凋亡率增加。见表2。
2.4电磁辐射对细胞ROS生成的影响 本实验采用DCFH-DA试剂盒检测暴露于电磁辐射后细胞内ROS变化情况,以双氧水作为阳性对照。发现在4 w/kg辐射后ROS生成量和对照组相比差异有统计学意义(P<0.05)。见表2。说明4 w/kg辐射强度下ROS生成量显著增加。
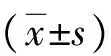
表1 各组彗星实验参数数值
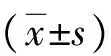
表2 细胞凋亡率和ROS生成量在各组中的表达情况
注:与对照组比较,*P<0.05
3 讨 论
离体和活体研究中已经证实ROS的激活是手机电磁辐射产生生物学效应的主要机制,过量产生的活性氧可以引起细胞不同程度的氧化应激损伤[11]。耳蜗是保持着较高有氧代谢的器官,在产生ATP供应能量的同时也能产生出大量ROS,因此极易遭到ROS的氧化攻击。维持稳定的耳蜗微电位对正常的听力至关重要,而耳蜗微电位的维持则主要取决于耳蜗外侧壁组织的泵机制。血管纹是位于耳蜗外侧壁的重要组织结构,它是由3类细胞构成的特殊的含毛细血管的复层上皮,最外层是边缘细胞,中间层是中间细胞,最内层是基底细胞。而其中的边缘细胞邻近内淋巴腔,其细胞膜上具有Na+-K+-ATP酶以及Na+/K+通道,对维持内淋巴液离子环境以及耳蜗微电位具有重要意义[12]。一旦边缘细胞受到ROS 的损害,会影响到内耳的能量供应。
本研究初期仅仅采用离体的短期暴露的方式研究手机电磁辐射对耳蜗边缘细胞的影响,但手机电磁辐射对听力系统的长期影响仍需要在活体研究中进一步证实。本研究中采用的手机通话模式,即开5 min关10 min暴露模式能更好地探讨手机电磁辐射的生物学效应,更能模拟手机电磁辐射对人体的影响。手机对SAR有明确的限制规定,各个国家规定和标准有所不同,但手机在接通瞬间或者信号不足的情况下辐射强度会较平常显著增大,4 w/kg常常被用来作为电磁辐射热效应的研究,因此本课题组采用的2、4 w/kg辐射强度是合理的。本研究发现1 800 MHz手机电磁辐射不足以引起耳蜗边缘细胞DNA的直接损伤,因为电磁辐射的能量远较电离辐射弱,但通过荧光探针发现了4 w/kg辐射强度下有ROS的激活,证实了ROS的激活是手机电磁辐射产生生物学效应的主要机制,但生成的过量的ROS不足以引起边缘细胞凋亡的增加和细胞DNA的损伤,认为ROS尽管增加明显,但尚在代偿范围之内;连续暴露于电磁辐射下,ROS的生成量会逐渐增加,超过细胞和组织的代偿能力后即会出现损伤。有研究认为手机辐射产生的过量的ROS可以引起细胞DNA损伤,Ca2+通道激活,以及热休克蛋白表达增加,但在本研究中未发现明显的损伤,考虑不同组织和细胞对电磁辐射有不同的敏感性[13-14]。本课题组拟进一步通过动物模型验证手机电磁辐射的长期累积效应。
[1]VECCHIA P.Exposure of humans to electromagnetic fields.Standards and regulations[J].Ann Ist Super Sanita,2007,43(3):260-267.
[2]AGARWAL A,DESAI N R,MAKKER K,et al.Effects of radiofrequency electromagnetic waves (RF-EMW) from cellular phones on human ejaculated semen:an in vitro pilot study[J].Fertil Steril,2009,92(4):1318-1325.
[3]SALFORD L G,BRUN A E,EBERHARDT J L,et al.Nerve cell damage in mammalian brain after exposure to microwaves from GSM Mobile phones[J].Environ Health Perspect,2003,111(7):881-883.
[4]HARDELL L,CARLBERG M,HANSSON MILD K.Use of Mobile phones and cordless phones is associated with increased risk for glioma and acoustic neuroma[J].Pathophysiology,2013,20(2):85-110.
[5]GALLONI P,LOVISOLO G A,MANCINI S,et al.Effects of 900 MHz electromagnetic fields exposure on cochlear cells' functionality in rats:evaluation of distortion product otoacoustic emissions[J].Bioelectromagnetics,2005,26(7):536-547.
[6]SECKINE,SURENBASARF,ATMACAS,etal.TheeffectofradiofrequencyradiationgeneratedbyaGlobalSystemforMobileCommunicationssource
on cochlear development in a rat model[J].J Laryngol Otol,2014,128(5):400-405.
[7]ZUO W Q,HU Y J,YANG Y,et al.Sensitivity of spiral ganglion neurons to damage caused by Mobile phone electromagnetic radiation will increase in lipopolysaccharide-induced inflammation in vitro model[J].J Neuroinflammation,2015,12(1):1-13.
[8]HUANG T Q,LEE M S,OH E H,et al.Characterization of biological effect of 1763 MHz radiofrequency exposure on auditory hair cells[J].Int J Radiat Biol,2008,84(11):909-915.
[9]KESARI K K,KUMAR S,NIRALA J,et al.Biophysical evaluation of radiofrequency electromagnetic field effects on male reproductive pattern[J].Cell Biochem Biophys,2013,65(2):85-96.
[10]NERI M,MILAZZO D,UGOLINI D,et al.Worldwide interest in the comet assay:a bibliometric study[J].Mutagenesis,2015,30(1):155-163.
[11]FRIEDMAN J,KRAUS S,HAUPTMAN Y,et al.Mechanism of short-term ERK activation by electromagnetic fields at Mobile phone frequencies[J].Biochem J,2007,405(3):559-568.
[12]GABAIZADEH R,STAECKER H,LIU W,et al.BDNF protection of auditory neurons from cisplatin involves changes in intracellular levels of both reactive Oxygen species and glutathione[J].Brain Res Mol Brain Res,1997,50(1/2):71-78.
[13]AVCI B,AKAR A,BILGICI B,et al.Oxidative stress induced by 1.8 GHz radio frequency electromagnetic radiation and effects of garlic extract in rats[J].Int J Radiat Biol,2012,88(11):799-805.
[14]DEMIREL S,DOGANAY S,TURKOZ Y,et al.Effects of third generation mobile phone-emitted electromagnetic radiation on oxidative stress parameters in eye tissue and blood of rats[J].Cutan Ocul Toxicol,2012,31(2):89-94.

